2.1.1 Vyznačení oxidačního čísla
Vyznačení oxidačního čísla se provádí:
a) ve vzorci: římskými číslicemi vpravo nahoru ke značce prvku (Stockovo číslo).
- Cl–I, O–II
b) v názvu:
- α) římskými číslicemi v kulaté závorce za název prvku (jen vzácně – viz dále)
- β) koncovkou:
- záporné oxidační číslo: koncovka -id bez ohledu na velikost oxidačního čísla
FI … fluorid S–II sulfid O–II O–II … oxid H–I … hydrid - kladné oxidační číslo: soustavou názvoslovných zakončení, závisejících na velikosti oxidačního čísla (tab. VII).
- záporné oxidační číslo: koncovka -id bez ohledu na velikost oxidačního čísla
Tabulka VII: Názvoslovná zakončení pro vyznačení kladného oxidačního čísla
| oxidační číslo |
zakončení pro jeden atom |
příklad | název | zakončení pro anion kyslíkaté soli |
příklad aniontu |
název |
| I | -ný | NaI | sodný | -nan | ClO– | chlornan |
| II | -natý | MgII | hořečnatý | -natan | [PtCl4]2– | tetrachloroplatnatan |
III |
-itý |
AlIII |
hlinitý |
-itan |
NO2– BO33– |
dusitan boritan |
| IV | -ičitý | CIV | uhličitý | -ičitan | SO32– | siřičitan |
V |
-ičný - ečný |
NV PV |
dusičný fosforečný |
-ičnan -ečnan |
NO3– PO43– ClO3– |
dusičnan fosforečnan chlorečnan |
| VI | -ový | SVI | sírový | -an | SO42– | síran |
| VII | -istý | MnVII | manganistý | -istan | MnO4– | manganistan |
| VIII | -ičelý | OsVIII | osmičelý | -ičelan | OsO52– | osmičelan |
Oxidační číslo prvku můžeme určit přímo z jeho definice, známe-li elektronegativity vzájemně vázaných atomů. Uvažujme molekulu vody:
| H2O | H—O—H | H··O··H |
Každému z vazebných partnerů náleží jeden elektron z vazebného elektronového páru: H·|·O·|·H
Význam symbolů:
- — elektronový pár
- · elektron
- ·· elektronový pár
- | čára znázorňující schematické přidělení vazebných elektronů jednotlivým atomům
Elektronegativity vázaných atomů jsou:
- X(H) = 2,2
- X(O) = 3,5
Vzhledem k tomu, že kyslík má tedy větší elektronegativitu než vodík, přidělí se mu podle definice oxidačního čísla všechny elektrony z jeho vazeb s vodíkem (myšlenkově):
H |··O··| H
Tím ovšem na atomu kyslíku přebývají dva (záporně nabité) elektrony ve srovnání s původním elektricky neutrálním uspořádáním, jeho formální náboj je tedy 2– a jeho oxidační číslo je –II. Na atomu vodíku naopak vždy jeden elektron chybí, formální náboj každého z atomů vodíku je tedy 1+ a jeho oxidační číslo je I (znaménko + se v zápise oxidačního čísla neuvádí).
Jak již bylo řečeno, oxidační číslo je formální pojem, jak naznačuje následují úvaha na příkladu molekuly methanu CH4.
Elektronegativity vazebných partnerů jsou: X(C) = 2,5 a X(H) = 2,2. Rozdíl elektronegativit je 0,3, z čehož plyne, že se ve skutečnosti jedná o sloučeninu s nepolárními vazbami a všechny vázané atomy jsou elektricky neutrální, nenesou tedy žádný elektrický náboj:
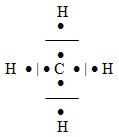
Přesto můžeme všem atomům přiřadit oxidační čísla podle definice:
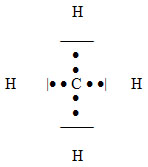
Kdyby (podle definice) byly všechny vazebné elektrony přiděleny vždy elektronegativnějšímu partnerovi (tj. uhlíku), chyběl by na každém atomu vodíku jeden elektron a každý atom vodíku by měl formální náboj 1+. Oxidační číslo vodíku v methanu je tedy I. Zároveň by byly uvažované čtyři elektrony (od každého atomu vodíku jeden) přiděleny atomu uhlíku, který by měl formální náboj 4–. Oxidační číslo uhlíku v methanu je tedy –IV.
Formální náboj iontu je v některých případech zapotřebí od oxidačního čísla pečlivě odlišovat, podobně jako je zapotřebí rozlišovat použití arabských a římských číslic:
Stockovo číslo = oxidační číslo atomu. Zapisuje se římskými číslicemi.
| UVIO2SO4 | síran uranylu(VI) | Zápis „ UVI “ znamená, že uran má v této sloučenině oxidační číslo VI. |
Ewensovo-Bassettovo číslo = formální elektrický náboj iontu. Zapisuje se arabskými číslicemi.
| UO22+ | uranyl(2+) | Zápis „uranyl(2+)“ znamená, že skupina UO2 (tj. uranyl) má celkový formální náboj 2+. |
| UO2SO4 | síran uranylu(2+) |
Způsob zápisu Stockova a Ewens-Bassettova čísla je nutno pečlivě odlišovat, jak ilustruje následující schéma:
PdF, Pedagogická fakulta, Masarykova univerzita
Návrat na úvodní stránku webu, nahoru
Technická spolupráce:
Servisní středisko pro e-learning na MU
Fakulta informatiky Masarykovy univerzity, 2009
