2.3.2 Elektronové strukturní vzorce
V některých případech je pro posouzení chemické reaktivity látek nutné mít k dispozici přesnější údaje o rozložení valenčních elektronů v molekulách uvažované látky. Tyto informace poskytují elektronové strukturní vzorce. Přestože tvorba elektronových strukturních vzorců je problémem spíše obecné chemie než chemické nomenklatury, byla tato problematika do skript zařazena, neboť odpovídá tematické náplni skript (tvorba chemických vzorců a zjišťování informací z nich).
2.3.2.1 Základní pojmy a symboly
Elektronovým strukturním vzorcem rozumíme strukturní vzorec doplněný informací o rozmístění valenčních elektronů jednotlivých atomů v molekule. Valenční elektrony jsou elektrony, které atomu přebývají nad konfiguraci nejbližšího předchozího vzácného plynu. Například atom kyslíku má 6 valenčních elektronů, neboť je prvkem VI. A podskupiny a přebývá mu tedy 6 elektronů nad konfiguraci předchozího vzácného plynu (helia). Valenční elektrony mohou být buď součástí vazby (tzv. vazebné elektrony), nebo součástí vazby nejsou (nevazebné elektrony).
Ve stabilních uspořádáních jsou elektrony spárovány (tj. tvoří dvojice). Mluvíme pak o elektronových párech. Elektronový pár se ve vzorci vyznačuje čárkou (čárka v elektronovém strukturním vzorci tedy znamená 2 valenční elektrony). Tato čárka se ve vzorci nachází buď na spojnici dvou atomů (pak se jedná o vazebný elektronový pár), nebo je dopsána k symbolu jednoho atomu (pak se jedná o nevazebný elektronový pár). Mezi dvojicí atomů může být jedna čárka (tj. atomy jsou spojeny jedním elektronovým párem, tedy jednoduchou vazbou), dvě čárky (2 vazebné elektronové páry, dvojná vazba) nebo 3 čárky (3 vazebné elektronové páry, trojná vazba).
Příklad:
![]()
O |
6 valenčních elektronů (VI. A podskupina) Jsou umístěny ve formě dvou nevazebných elektronových párů a dvou vazebných elektronů – kyslík se podílí na tvorbě dvou jednoduchých vazeb vždy jedním elektronem. Druhý elektron do vazby poskytuje vodík. Z atomu kyslíku vycházejí celkem dvě vazby (zakresleny jsou dva vazebné elektronové páry), kyslík je dvojvazný. |
H |
1 valenční elektron (I. A podskupina) Tento jeden elektron je poskytnut do vazby s kyslíkem, vodík je jednovazný. Nevazebné elektrony vodík nemá. |
V některých případech nejsou všechny elektrony ve valenční sféře atomu spárovány. Nepárový elektron se ve vzorci vyznačí tečkou k symbolu příslušného atomu. Částice s nepárovým elektronem se nazývá radikál, např. radikál chloru. Vzácně se vyskytují také tzv. biradikály (částice se dvěma nespárovanými elektrony), např. biradikál kyslíku.
Příklady:
![]()
Chlor se vyskytuje v VII. A podskupině, má tedy 7 valenčních elektronů. Volný (nevázaný) atom chloru tedy musí mít jeden nepárový elektron.
![]()
Kyslík se vyskytuje v VI. A podskupině, má tedy 6 valenčních elektronů. Existenci biradikálu kyslíku je možno vysvětlit např. takto: Odštěpením dvou atomů vodíku z molekuly vody se přeruší dvě jednoduché vazby, přičemž po každé z nich zůstane na atomu kyslíku přítomen jeden nespárovaný elektron.
| Často se stává, že se valenční elektrony v molekule přesunou tak, aby bylo dosaženo stabilnějšího uspořádání (elektronového oktetu). V důsledku toho se pak ovšem v elektronovém obalu některých atomů vyskytuje jiný počet elektronů, než odpovídá jejich protonovému číslu a na atomech se pak vyskytuje buď kladný náboj (při nedostatku elektronů) nebo záporný náboj (při nadbytku elektronů). |
Přítomnost kladného, resp. záporného elektrického náboje na atomech vzniklého uvedeným způsobem se vyznačuje symboly.
Příklad:
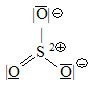
Nejčastějším případem výskytu elektrického náboje na atomech jsou ionty.
Příklady:
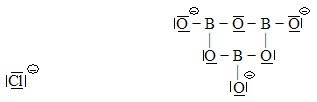
| Existuje také možnost vyznačení přítomnosti parciálních elektrických nábojů na atomech, které vznikly v důsledku velmi odlišných elektronegativit obou vazebných partnerů. |
Vyznačují se symboly:
Příklad:
![]()
2.3.2.2 Strukturní vzorce
Při tvorbě elektronových strukturních vzorců postupujeme tak, že nejprve sestavíme strukturní vzorec neelektronový, který pak doplníme symboly vyznačujícími umístění valenčních elektronů a elektrických nábojů. Vyznačení parciálních nábojů v elektronových strukturních vzorcích není povinné.
Strukturní vzorce látek není možno odvodit pouze na základě znalosti složení molekul dané látky. Struktura látek se zjišťuje pomocí speciálních fyzikálně-chemických metod, např. NMR, rentgenová difrakce, vibračně-rotační spektroskopie apod. Struktura řady látek je však již známa. Při tvorbě strukturních vzorců je nutno těchto znalostí využít.
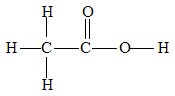
Při zápisu vzorců organických látek budeme vycházet ze znalostí organické chemie. Například víme, že octová kyselina má strukturní vzorec
Při zápisu vzorců anorganických látek s troj- a víceatomovými molekulami (u jedno- a dvojatomových molekul je struktura jednoznačná) využijeme těchto zjednodušených pravidel pro přibližný odhad struktury:
- Struktura oxidů je uvedena v kapitole 5, odpověď k úloze č. 28.
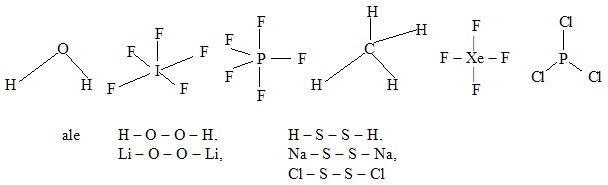
- Struktura binárních sloučenin, kde jeden z vazebných partnerů má oxidační číslo I (resp. –I), bývá taková, že všechny atomy v oxidačním stavu I jsou vázány vždy jednoduchou vazbou na druhého partnera. Výjimkou jsou například peroxidy a disulfidy.
Příklady:
- Strukturu kyslíkatých kyselin lze většinou odhadnout takto: Na centrální atom je jednoduchou vazbou vázáno tolik OH skupin, kolik atomů H molekula obsahuje. Zbývající atomy
O jsou také vázány na centrální atom. Při úpravě strukturního vzorce na elektronový strukturní se tyto atomy kyslíku zapisují vázané dvojnou vazbou k centrálnímu atomu (případně se dále uvažují přesuny elektronů, aby byl zachován elektronový oktet). Kontrolou v první fázi tvorby elektronového strukturního vzorce kyslíkaté kyseliny je, že celkový výsledný počet vazeb vycházejících z centrálního atomu by měl být roven oxidačnímu číslu centrálního atomu.
Příklady:
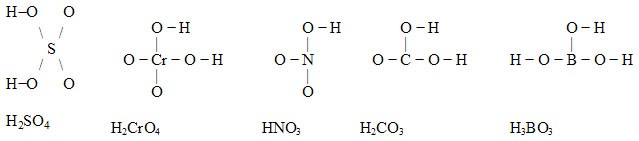
Příklady:
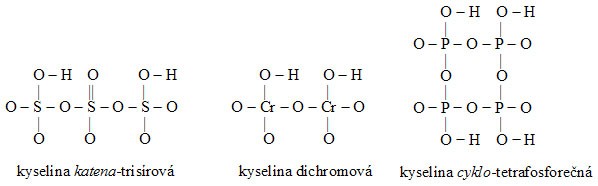
- Strukturní vzorce solí kyslíkatých kyselin se od strukturních vzorců odpovídajících kyselin odvodí náhradou kationtů vodíku ze skupiny OH příslušnými kationty solí.
Příklady:
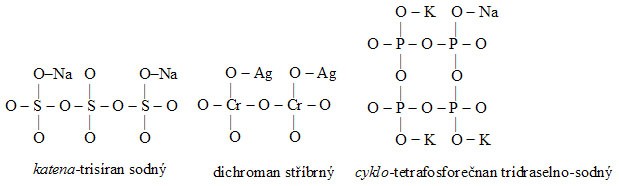
2.3.2.3 Úprava strukturních vzorců na elektronové strukturní
Úprava strukturních vzorců na elektronové strukturní probíhá tak, že do strukturních vzorců:
- Doplníme násobné vazby tak, aby celkový počet vazeb vycházejících z každého atomu byl roven absolutní hodnotě oxidačního čísla tohoto atomu. Toto pravidlo neplatí v případě, že jsou na sebe v molekule vázány dva atomy téhož prvku (např. v molekule peroxidu vodíku – oxidační číslo kyslíku je –I, ale vycházejí z něj dvě vazby). V dvojatomových molekulách plynných prvků lze na násobnost vazby usuzovat na základě diagramu molekulových orbitalů (učivo obecné chemie). Zapamatujme si, že v molekule O2 je dvojná vazba, v molekule N2 je vazba trojná a v molekule H2 a v molekulách halogenů jsou vazby jednoduché.
Příklady:

- Doplníme valenční elektrony tak, aby se počet valenčních elektronů ve valenční sféře každého z atomů shodoval s číslem skupiny, v níž se prvek nachází v periodickém systému prvků (např. S je v VI. podskupině, má tedy 6 valenčních elektronů, F je v VII. podskupině, má tedy 7 valenčních elektronů, B je v III. podskupině, má tedy 3 valenční elektrony apod.). Při vyznačení valenčních elektronů vycházíme z předpokladu, že z vazebných elektronů přísluší každému partnerovi polovina. Jedna čárka mezi atomy tedy znamená dvojici vazebných elektronů, z nichž jeden náleží do valenční sféry prvního partnera a jeden náleží do valenční sféry druhého partnera.
Příklady:
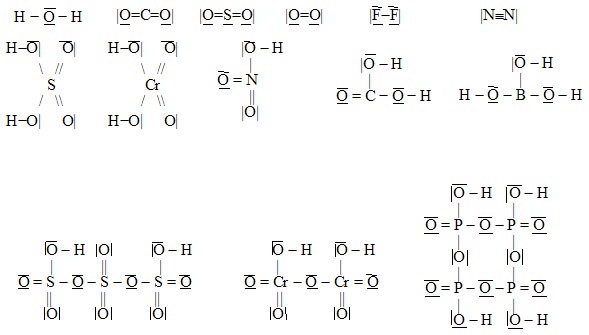
- Nakonec v případě potřeby přesuneme některé vazebné elektronové páry na jednotlivé atomy (z vazebných elektronových párů se tedy stanou elektronové páry nevazebné) tak, aby pokud možno bylo dodrženo oktetové pravidlo (součet nevazebných elektronů na daném atomu a všech vazebných elektronů ve všech vazbách z daného atomu vycházejících je dohromady 8) a vyznačíme elektrické náboje na jednotlivých atomech. Oktetové pravidlo musí být striktně dodrženo pouze u těchto atomů: C, N, O, F.
Příklady:
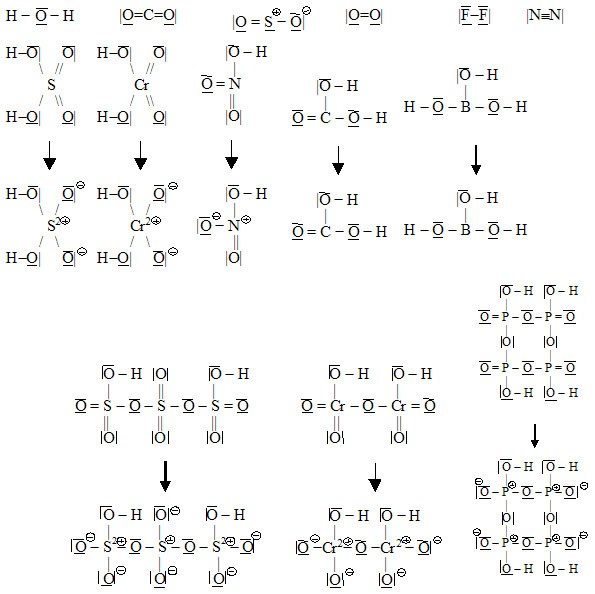
- Přesuny elektronových párů musíme provést také tehdy, pokud je v molekule iontová vazba. V tom případě se přesuny provádějí tak, aby elektrické náboje vyznačené ve vzorci byly rovny formálním nábojům iontů tvořících molekulu.
Příklad:
![]()
PdF, Pedagogická fakulta, Masarykova univerzita
Návrat na úvodní stránku webu, nahoru
Technická spolupráce:
Servisní středisko pro e-learning na MU
Fakulta informatiky Masarykovy univerzity, 2009
