Bakteriofág
Cíl cvičení
Stanovit titr fágového lyzátu metodou dvouvrstvého agaru.
Úvodní slovo
Bakteriofágy (též fágy) jsou viry napadající bakteriální buňky. Velikost bakteriofágů se pohybuje od 20 do 200 nm, velikost genomu 2 až 200 kb, jsou menší než bakterie. Jejich počet je v prostředí asi desetkrát vyšší než počet bakteriálních buněk. Ze 20–50 % jsou příčinou jejich mortality, napomáhají koloběhu látek, zvyšování množství organických látek v prostředí. Geneticky se neshodují s ostatními viry (viry živočichů a rostlin). Evoluce fágů probíhá současně s evolucí bakterií, jsou kontinuálně se vyvíjejícím rezervoárem genů.
Nukleová kyselina bakteriofága (jedno nebo dvouřetězcová, kruhová nebo lineární, DNA nebo RNA) je uložena v proteinové kapsidě většinou tvaru ikosaedru, která je pomocí krčku spojena s bičíkem umístěným v kontraktilní pochvě. Na bazální ploténku bičíku jsou napojena bičíková vlákna pro přichycení na povrchové receptory bakteriálního hostitele (obr. 18).
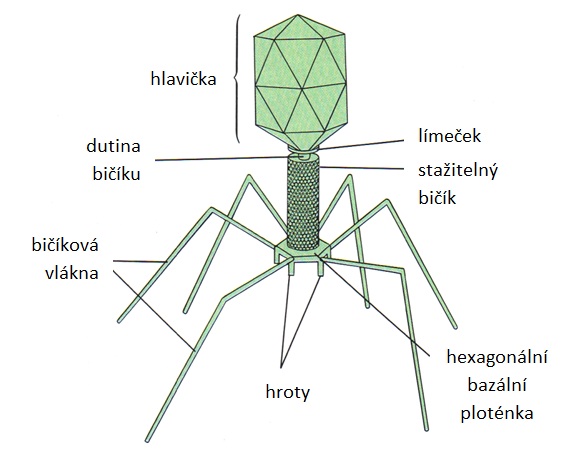
Rozmezí bakteriálního hostitele může být u fágů velice úzké či naopak široké. Některé fágy jsou natolik specifické, že se množí jen v určitých kmenech konkrétního bakteriálního druhu. Fágy se širokým spektrem hostitele se nazývají fágy polyvalentní. Chimérní fág vzniká homologní rekombinací mezi dvěma fágy, má vlastnosti od obou původních fágů.
Podle průběhu životního cyklu se fágy dělí na dvě skupiny:
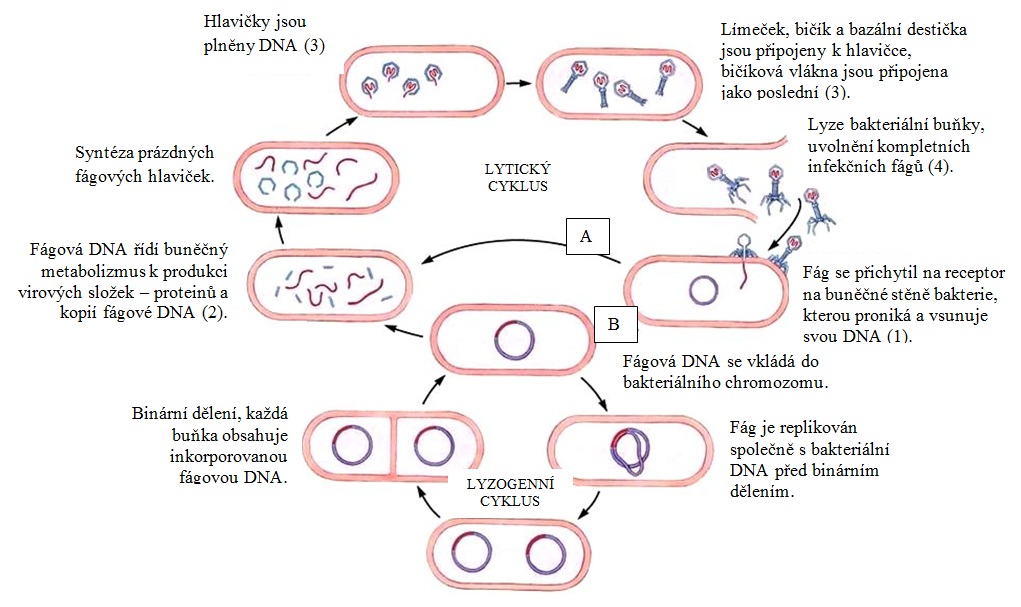
Virulentní fágy s lytickým životním cyklem (obr. 19A) způsobují lyzi hostitelského kmene bakterie. Životní cyklus má tyto fáze:
- adsorpce virionu na povrch vnímavé buňky (u grampozitivních bakterií většinou na teichoové kyseliny), penetrace nukleové kyseliny fága do cytoplazmy buňky,
- replikace fágové DNA s využitím RNA polymerázy hostitele, syntéza rané mRNA fága a proteinů kontrolujících syntézu dalších virů, syntéza pozdních bílkovin fága,
- kompletace nových virových částic (virionů),
- uvolnění virionů do vnějšího prostředí umožněné syntézou endolyzinů a lyzí buňky. Uvolněné viriony pak mohou infikovat další citlivé buňky.
Pokud lytická infekce probíhá v tekutém médiu s narostlými buňkami hostitelského kmene, dojde po určité době k vyčeření a dostaneme tzv. fágový lyzát (kultivační prostředí obsahující aktivní virové částice, zbytky membrán a vylitý buněčný obsah). Pokud probíhá lyze u hostitelského kmene na agaru, vznikají plaky, projasněná místa.
Temperované fágy s lyzogenním cyklem (obr. 19B) se rekombinací začleňují do genomu hostitele, jejich nukleová kyselina se replikuje a přenáší na potomstvo spolu s genomem. Takový fág se nazývá profág, může se uvolnit a vyčlenit z nukleové kyseliny bakteriální buňky po působení některých vnějších faktorů (např. UV záření, působení mutagenů či stresových faktorů). Při chybném vyčlenění (tj. při posunutí čtecího rámce) se může spolu s genetickou informací fága vyčlenit i část genomu hostitelské bakterie, která je součástí nové virové částice a může být šířena dál. Tento proces se nazývá transdukce a např. u druhu Staphylococcus aureus je nejčastějším způsobem horizontálního přenosu genů, který viru může přinášet určitým způsobem výhodné geny. Stejně tak i bakteriím, neboť bakteriofágy napomáhají například v shiftech sérotypů bakterií (serotype-converting phages).
Infekce bakteriální buňky fágem nemusí být vždy úspěšná. Některé bakterie překrývají receptory pro navázání fágů např. proteinem A, anebo pokud infekce a penetrace proběhne, bakterie aktivují restrikčně modifikační systémy a endonukleázy rozštěpí cizorodou nukleovou kyselinu. To jsou hlavní problémy fágové terapie. Řešením je izolace fágových mutant, které jsou schopné překonat obranné mechanizmy hostitele a lyzovat původně necitlivé kmeny.
Fágová terapie je použití fágů k léčbě bakteriálních infekcí. Bakteriofágy schopné lyze patogenních bakteriích se dostaly do popředí zájmu po objevu bakteriálních kmenů rezistentních na záložní antibiotika (např. meticilin). Jedny z prvních výzkumů fágové terapie probíhaly od 60. let v zemích bývalého Sovětského svazu; v Gruzii bylo do studií zahrnuto až 31 tisíc dětských pacientů trpících průjmy. Západní Evropa a USA se k výzkumu připojily později.
Bakteriofágy byly v minulosti hojně užívány k léčbě a prevenci infekcí. Zatímco dříve byly pro fágovou terapii využívány preparáty obsahující celé fágové částice, v současnosti otevírá nové možnosti v boji proti obtížně léčitelným infekcím izolace dobře charakterizovaných purifikovaných fágových komponent s antimikrobiálními vlastnostmi. Dnes je fágová terapie rozvíjena zejména u infekcí vyvolaných bakteriálními rody Staphylococcus, Streptococcus, Pseudomonas, Proteus, Klebsiella, Shigella, Salmonella, Escherichia, Enterococcus a Listeria.
Výhodou fágové terapie je vysoká specifita k cílovému kmeni hostitele, fágy nejsou nebezpečné pro přirozenou mikroflóru pacienta. Specifita fága však vyžaduje velmi přesnou diagnostiku patogena a stanovení jeho citlivosti k danému fágu. Výhodné je používat polyvalentní fágy nebo jejich směsi, které jsou schopné lyzovat většinu patogenních kmenů daného druhu, které se podílejí na vzniku infekce. Bakteriofágy jsou schopny pomnožit se v místě infekce, proto je možné podat pacientovi malou jednorázovou dávku preparátu. Naproti tomu antibiotika jsou metabolizována, eliminována z organizmu a nekoncentrují se v místě infekce, což vyžaduje opakované dávky.
U fágových preparátů nebyly, až na několik výjimek, dosud pozorovány závažné vedlejší účinky, ve srovnání s antibiotiky. Problém může nastat při uvolnění endotoxinů do organizmu pacienta v důsledku lyze bakteriálních buněk. Případný vznik rezistence na určitého fága je často spjat se ztrátou patogenity příslušného bakteriálního kmene. Povrchové buněčné komponenty, fágové receptory, bývají spojené s bakteriální virulencí a jejich mutace vede současně ke ztrátě obou uvedených funkcí. Naproti tomu kmeny rezistentní na antibiotika si uchovávají vlastnosti virulence. Vývoj nových antibiotik je zdlouhavý a nákladný. Vyhledání nového terapeutického fága proti rezistentnímu bakteriálnímu kmeni je rychlejší a levnější proces.
Fágová terapie se nevyužívá pouze v medicíně, ale také při ošetřování potravin proti bakteriálnímu napadení, ve fytoterapii, v pěstitelství a rostlinné výrobě proti bakteriálnímu onemocnění rostlin. Fágy je možné využít i pro další subtypizaci některých bakterií (např. fágová typizace salmonel).
Ke stanovení počtu fágových částic se používají nepřímé metody založené na tvorbě plak. Plaky jsou projasněné zóny na tuhém médiu souvisle porostlém hostitelským bakteriálním kmenem. Vznikají v místě, kde se v okamžiku očkování nacházela jedna aktivní fágová částice, která dala po infekci vznik dalším virionům, ty napadly okolní citlivé buňky. V několika po sobě následujících lytických cyklech dochází k lyzi velkého počtu sousedních hostitelských buněk a vzniká plaka. Základním předpokladem metody je, že počet hostitelských buněk musí být vyšší než počet fágových částic.
Seznam přístrojů, materiálu a mikroorganizmů
Pomůcky a chemikálie
- masopeptonový bujón (MPB)
- masopeptonový agar (MPA) – 2 % a 0,7 %
- sterilní tris HCl pufr (pH 7,2)
- sterilní 0,22 % CaCl2
- sterilní Petriho misky, pipety, zkumavky, vodní lázeň, termostat
Mikroorganizmy
- Staphylococcus aureus SA 812, stafylofág 812
Postup
Příprava fágového lyzátu
- 2 ml narostlého 24 hodinového inokula S. aureus SA 812 naočkovat do 100 ml čerstvého MPB v provzdušňovací láhvi a za intenzivního provzdušňování pokračovat v kultivaci další 4 hodiny při teplotě 30 °C.
- Po 4 hodinách asepticky přidat 10 ml sterilního 0,22% CaCl2 a 5 ml zásobního lyzátu fága 812 a pokračovat v kultivaci.
- Po 60 minutách přemístit provzdušňovací láhev do temna a laboratorní teploty.
- Za 12–24 hodin se médium vyčeří, přesto v něm zůstává určitý počet necitlivých buněk.
- Lyzát sterilizovat přídavkem chloroformu (5‑10 kapek na 10 ml lyzátu), nechat působit 1−2 hodiny, lyzát stáhnout sterilní pipetou a přenést do sterilní baňky.
- V takto připraveném lyzátu se při teplotě 4 °C významně nemění počet aktivních fágových částic po dobu 1−2 měsíců.
Příprava hostitelských buněk
- Ze zásobní kultury S. aureus SA 812 naočkovat 20 ml sterilního MPB (ve 100ml baňce) a kultivovat 24 hodin při teplotě 30 °C.
Stanovení počtu virionů:
- Lyzát fága 812 zředit ve sterilním tris HCl pufru, vždy sterilně přenášet 0,1 ml lyzátu nebo předchozího ředění do 0,9 ml pufru, na každé ředění použít novou sterilní špičku, dobře promíchávat!
- Připravit sterilní zkumavky, které budou obsahovat 3 ml 0,7% MPA, rozvařeného a vytemperovaného na 45 °C.
- K 20 ml hostitelských buněk sterilně přidat 2 ml 0,22% CaCl2 a pipetovat 0,3 ml inokula do každé zkumavky.
- Na bakteriologické plotny s 2% MPA pipetovat 0,1 ml příslušných ředění fága, ihned po pipetování misku zalít obsahem jedné zkumavky, krouživým pohybem agar promíchat s pipetovanou kapkou a ve vodorovné poloze nechat utuhnout.
- Misky umístit dnem vzhůru do termostatu a kultivovat při 30 °C 12−24 hodin.
Hodnocení cvičení
- Spočítat počet plak na miskách (obr. 20) s nejvhodnějším ředěním (na misce okolo 20−200 plak). K miskám, na kterých je méně než 10 plak při hodnocení nepřihlížet. Výsledek je v jednotkách PFU/ml (plaques forming units, počet fágových částic schopných vytvářet plaky v 1 ml, nikoliv absolutní počet virionů).
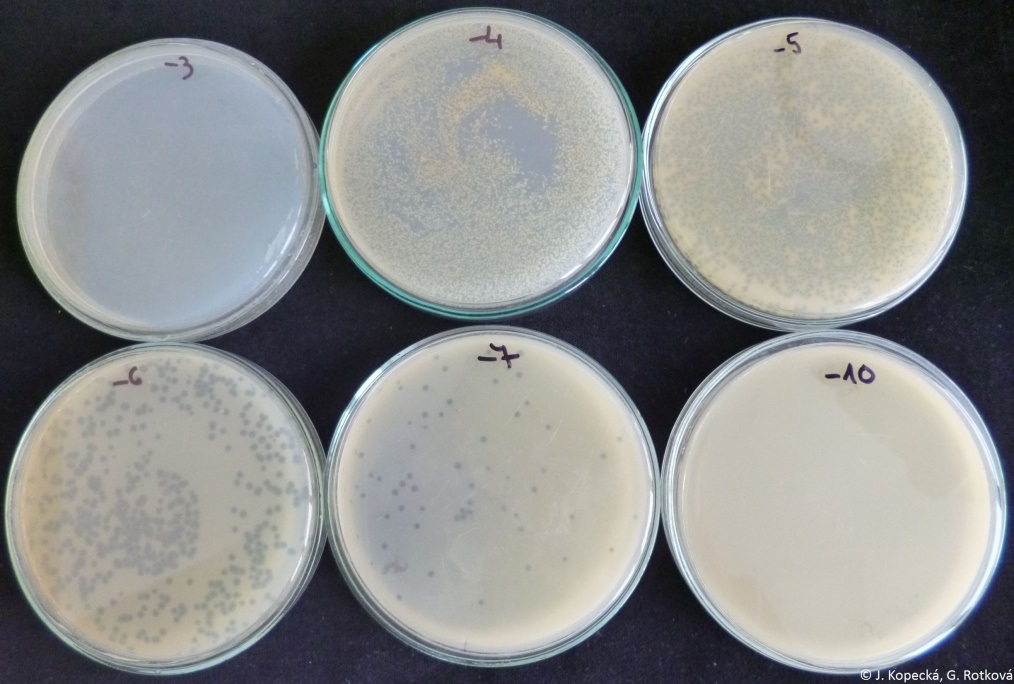
U ředění 10−3 došlo k lyzi veškerých buněk, naopak u ředění 10−10 k lyzi buněk nedošlo. Pro výpočet je nejvhodnější ředění 10−7.
Příklad výpočtu: Na 3 miskách (0,1 ml vzorku ředění 10−5/miska) se vytvořilo 122, 132, 139 plak, aritmetický průměr je 131 plak.
Titr lyzátu je = 131 · 105 = 1,31 · 107 v 0,1 ml, tedy 1,31 · 108 PFU/ml
Další informace k této problematice najdete v následující literatuře
- Eyer L., Pantůček, R., Růžičková V., Doškař J., Nové perspektivy fágové terapie, přehledový článek v Klinická mikrobiologie a infekční lékařství, 2007.
- Skripta Praktikum z mikrobiologie
- Otradovcová L., Izolace a charakterizace mutant polyvalentního stafylokokového bakteriofága účinných proti methicilin-rezistentním kmenům Staphylococcus aureus, Diplomová práce, MU, Brno, 2012.
Kontrolní otázky
- Čím se liší bakteriofágy od virů rostlin a živočichů?
- Jaký je význam virů pro přenos genetické informace v prostředí?
- Čím jsou viry prospěšné při terapii onemocnění?
- Co je nutné mít pro kultivaci bakteriofága?
- K čemu slouží CaCl2?