Boridy představují skupinu více než dvou set sloučenin boru s kovy. Zpravidla mají složitou stechiometrii (od M5B až po MB66, známy jsou i fáze obsahující více než jeden druh kovu) a v jejich struktuře se významně uplatňují polycentrické elektronově deficitní vazby. Atomy boru v nich mohou být izolované, vzájemně spojené do řetězců, šestiúhelníkových vrstev nebo trojrozměrných uskupení.
V boridech MB6 se v rozích krychlí nacházejí oktaedry B6 vzájemně propojené přes vrcholy, ve středu krychlí jsou atomy kovu koordinovány čtyřiadvaceti atomy boru.
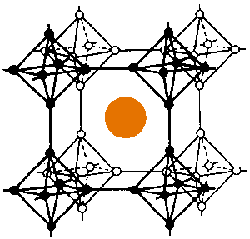
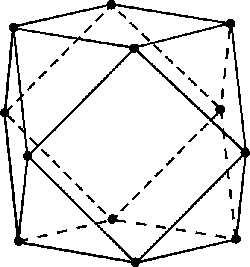
V boridech MB12 nemají jednotky B12 strukturu ikosaedru, ale kubooktaedru.
Boridy bohaté na kov jsou velmi tvrdé, žáruvzdorné, chemicky inertní a mají vysoké body tání. Zpracovávají se proto technikami práškové metalurgie, některé z nich se vyznačují velmi dobrou elektrickou a tepelnou vodivostí (často lepší než matečné kovy). K jejich přípravě lze využít přímé slučování prvků, elektrolytické vylučování z roztavených solí (zejména MB6) a redukce oxidů kovů karbidem boru B4C. Existují pestré možnosti jejich využití (vnitřní plochy raketových trysek, nádoby pro zpracování roztavených kovů, elektrody a kontrolní tyče v jaderných reaktorech).
Binární sloučeniny boru s vodíkem se nazývají borany. V posledních třech desetiletích byla jejich chemie jednou z nejrychleji se rozvíjejících oblastí chemie nekovů. Borany jsou bezbarvé diamagnetické molekulární sloučeniny s malou až střední tepelnou stabilitou. Nižší homology jsou za laboratorní teploty plynné, s rostoucí molekulovou hmotností přecházejí na těkavé kapaliny až pevné látky. Všechny jsou v důsledku mimořádné pevnosti vazeb v elementárním boru a divodíku (nikoliv slabosti vazby B-H) velmi reaktivními endotermickými sloučeninami (s rostoucí molekulovou hmotností reaktivita klesá). Dosud bylo charakterizováno více než 50 elektroneutrálních molekul BnHm a ještě větší počet anionických částic BnHmx−.
Princip názvosloví boranů je jednoduchý. Počet atomů boru se uvede latinskou číslovkou jako předpona, počet vodíkových atomů arabskou číslicí v závorce za názvem. Strukturní informace (název strukturního typu podle výše uvedeného přehledu) lze doplnit jako kursivou psaný deskriptor (předponu oddělenou pomlčkou). Složitější je názvosloví derivátů boranů vyžadující pečlivé dodržování pravidel pro číslování skeletů. Pro označování aniontů se používá podle doporučení IUPAC názvu boraty, vodíkovým atomům je vyhrazena předpona hydro (tetrahydroborat lithný LiBH4), přestože to není konsistentní s platným českým názvoslovím ostatních anorganických sloučenin.
První borany (B2H6, B4H10, B5 H9, B5H11 a B10H14) izoloval A. Stock (1914–1920) z plynných produktů reakce boridu hořečnatého MgB2 se zředěnou kyselinou chlorovodíkovou (tohoto úspěchu dosáhl vyvinutím techniky vakuových linek pro práci s těkavými a k vlhkosti či kyslíku citlivými látkami). Pro preparativní účely se dnes již této reakce neužívá a výchozí látkou pro přípravu vyšších boranů je obvykle diboran. K jeho přípravě je k dispozici několik vhodných reakcí (k jejich realizaci se často jako rozpouštědlo využívá polyether diglym CH3OCH2CH2OCH2CH2OCH3)

2 NaBH4 (s) + 2 H3PO4 (l) → B2H6 (g) + 2 NaH2PO4 + 2 H2

Průmyslově se diboran připravuje redukcí fluoridu boritého alkalickým hydridem
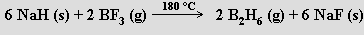
Vodou se diboran rozkládá za uvolnění vodíku
B2H6 + 6 H2O → 2 H3BO3 + 6 H2
s halogenovodíky tvoří halogenoderiváty
B2H6 + HCl → B2H5Cl + H2
a reakce s halogeny vede k halogenidům boritým
B2H6 + 6 Cl2 → 2 BCl3 + 6 HCl
S donory typu CO, PF3 nebo trimethylaminu se snadno tvoří DA-komplexy, reakcí s amoniakem vzniká komplex [H2B(NH3)2]+[BH4]−, který zahřátím přechází na cyklický borazol B3N3H6.
Nejjednodušší nabitou částicí odvozenou od boranu je anion tetrahydroboratový BH4−, existující v kombinaci s mnoha kationty. Alkalické tetrahydroboraty lze připravit řadou reakcí

4 NaH + B(OCH3)3→ NaBH4 + 3 CH3ONa
V tetrahydroboratu beryllnatém Be(BH4)2 a hlinitém Al(BH4)3 jsou skupiny BH4 spojeny s atomy kovu třícenterními vazbami. Roztoky tetrahydroboratů se používají jako silná redukovadla a zdroj hydridových aniontů.
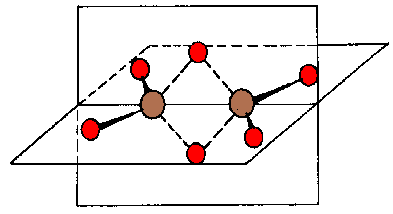
Prvním úspěchem při studiu struktury boranů bylo rentgenografické stanovení struktury dekaboranu(14) (B10H14, 1948). Uspokojivý popis vazebných poměrů byl umožněn zavedením představy třístředových dvouelektronových vazeb B–H–B (C. Longuet-Higgins, 1949). Následoval důkaz přítomnosti dvou vodíkových můstků v diboranu a stanovení struktury B5H9 (1951).
Představy o struktuře této skupiny sloučenin rozvinul W. N. Lipscomb (Nobelova cena 1976). V současné době se soudí, že se v chemii boranů uplatňuje vedle třístředových vazeb B–H–B pouze uzavřená třícenterní vazba B–B–B. (otevřené vazby B–B–B jsou užitečné pro popis vazby v karboranech a heteroatomových klastrech). Vazebné poměry v boranech se charakterizují čtyřmístným číslem nazývaným parametr styx, v němž s je počet vazeb B-H-B, t počet třístředových vazeb B-B-B, y počet dvoustředových vazeb B-B a x počet skupin BH2. Podle struktury lze borany rozdělit do pěti skupin
closo-borany (closo z clovo = klec) BnHn+2 mají uzavřené klastry z n atomů boru. Nenabité molekuly nejsou známy, pouze anionty BnHn2− (n = 6 až 12; jejich chemické chování vedlo k představě o trojrozměrné aromaticitě). Lze je připravit pyrolýzou diboranu za přesně definovaných podmínek (vyšší teplota a katalýza ethery vedou k větším aniontům, mechanismy reakcí nejsou dosud detailně známy)
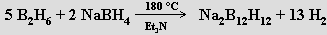

Termickou stabilitou a malou reaktivitou vynikají soli vysoce symetrických aniontů B10H102− a B12H122−, které se nerozkládají zahřátím na 600 °C, odolávají nukleofilním atakům a jsou jen mírně citlivé k elektrofilnímu napadení. U jejich derivátů se uplatňuje izomerie (B10H9X2− má dva, B10H7X32− šestnáct izomerů).
V nido-boranech (nidus = hnízdo) BnHn+4 obsazuje klastr Bn n vrcholů (n+1)-vrcholového mnohostěnu (B2H6, B5H9, B6H10, B10H14). Odstraněním můstkových atomů vodíku vznikají jednou (BnHn+3−, B5H9−, B10H13−) i dvakrát (BnHn+22−, B10H122−, B11H132−) nabité anionty. Formálně k tomuto typu patří i aniont BH4−, který je možno považovat za produkt adice H− na BH3.
nido-pentaboran(9) B5H9 (b. v. 60 °C) je termicky poměrně stálá, reaktivní, na vzduchu samozápalná kapalina. Atomy boru vytvářejí v jeho molekule tetragonální pyramidu, každý z nich nese jeden terminální atom vodíku a hrany čtvercové základny představují můstkové vazby B-H-B. S Lewisovými bázemi tvoří adukty, z nichž některé byly identifikovány jako členy hypho-boranové řady BnHn+8. Současně s tvorbou DA-vazby dochází i k nečekaně rozsáhlé reorganizaci atomů vodíku (ligand v [B5H9((CH3)2NCH2CH2N(CH3)2)] koordinuje jen jeden atom boru, který se zbytkem skeletu zůstává spojen jedinou vazbou B-B). nido-pentaboran(9) je slabou Brönstedovou kyselinou (kyselost obecně roste s velikostí boranového klastru), protože působením silných bazí (LiCH3, MH) za nízké teploty ztrácí jeden z můstkových vodíků
B5H9 + MH → M+B5H8– + H2
Reakcí M+B5H8− s chloroderiváty fosforu, křemíku nebo boru lze získat v můstku substituované deriváty nido-B5 H9.
nido-dekaboran(14) B10H14 je nejlépe prostudovaným vyšším boranem (v 50. letech se v USA vyráběl v tunových množstvích jako potenciální vysokoenergetické palivo). Je to bezbarvá těkavá krystalická látka nerozpustná ve vodě, ale dobře rozpustná v organických rozpouštědlech. Laboratorně se připravuje opatrnou pyrolýzou diboranu (100–200 °C, katalyzátor dimethylether). Ve vodně-alkoholických roztocích ho lze titrovat jako jednosytnou kyselinu (pKa = 2,70)
B10H14 + OH– → B10H13– + H2O
Anionty odvozené od nido-B10H14 lze připravit jeho reakcí a alkalickými kovy v etherech nebo kapalném amoniaku (současně dochází ke změně strukturního typu skeletu z nido- na arachno-)
nido-B10H14 + 2 Na → arachno-Na2B10H14
arachno-borany (arachne = pavučina) BnHn+6 mají otevřenější struktury, v nichž klastr Bn obsazuje n vzájemně sousedících vrcholů (n+2)-vrcholového mnohostěnu (B4H10, B5H11 , B6H12, B9H15). Jsou známy anionty BnHn+5− (B2H7−, B3H8−, B5H10−, B10H15−) i BnHn+42− (B10H142−). Arachno-borany jsou obecně reaktivnější a kyselejší než nido-borany.
hypho-borany (hyphe = síť) BnHn+8 mají nejotevřenější struktury, v nichž klastr Bn obsazuje n sousedících vrcholů (n+3)-vrcholového mnohostěnu (B8H16, B10H18).
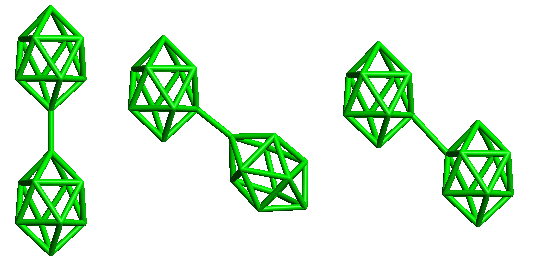
conjuncto-borany (conjuncto = spojuji) vznikají spojením dvou nebo více předchozích typů klastrů. Dosud je známo pět typů takových spojení (sdílení jednoho až čtyř atomů B nebo vytvoření dvoustředové σ-vazby B-B mezi dvěma klastry). Oxidací B10H102− lze připravit tři izomery conjuncto-B20H184−.
Významnou skupinou derivátů boranů jsou sloučeniny, v nichž je alespoň jedna skupina BH nahrazen uhlíkem. Nazývají se karborany a jejich studium se začalo intenzivně rozvíjet od druhé poloviny 60. let 20. století. Impulsem byl fakt, že studium těchto sloučenin překrývalo a současně spojovalo několik významných oblastí chemie – borany, komplexy přechodných kovů a organokovové sloučeniny. Nejpočetnější skupinu sloučenin tohoto typu tvoří closo-karborany. Jsou to těkavé kapaliny nebo pevné látky, které se připravují pyrolýzou (500–600 °C, používá se i elektrický výboj) směsi vhodného alkinu a boranu. Za mírnějších podmínek (200 °C) vznikají nido-karborany, které, podobně jako arachno-karborany, poskytují dalším tepelným zpracování closo-deriváty.
Snadnou přípravou (reakcí acetylenu s dekaboranem(14) v přítomnosti diethylsulfidu) i vysokou stabilitou jsou pozoruhodné izomery 1,2-, 1,7- a 1,12-C2B10H12. Působením silných bazí v protických rozpouštědlech na tyto sloučeniny lze získat karboranové anionty s jedním i se dvěma zápornými náboji. Rozpoznání strukturní a elektronové podobnosti otevřené pětiúhelníkové plochy v nido-karboranech s cyklopentadienylovým aniontem vedlo k objevu metalakarboranů.
Reakce nido-C2B9H112− s chloridem železnatým v tetrahydrofuranu poskytuje růžový diamagnetický komplex FeII, který je strukturně příbuzný ferrocenu a lze ho reverzibilně oxidovat na červený komplex FeIII. V přítomnosti NaC5H5 vzniká komplex [FeIII(C5H5)(C2B9H11)]. Podařilo se připravit i dvouposchoďové sendvičové komplexy kobaltu s centrálním kruhem C2B3H4− formálně isoelektronovým s cyklopentadienylovým aniontem a další komplexy s několika ionty kovu. V elektronově bohatých komplexech NiII , PdII, CuIII a AuIII byly detekovány posunuté sendvičové struktury ([Cu(C2B9H11)2]2−), v nichž je atom kovu výrazně blíže atomům boru než atomům uhlíku.
Karbid čtyřboru B4C je černá, velmi tvrdá, obtížně tavitelná a chemicky inertní látka. Vzniká žíháním boru nebo oxidu boritého s uhlím v elektrické peci (lze ho získat i ve formě vláken). V jeho krystalech existují řetězce C3 a ikosaedry B12. Používá se jako brusný materiál a k výrobě ochranných štítů letadel a neprůstřelných vest.
Nitrid boritý BN je bílý, elektricky nevodivý, termicky stálý a málo reaktivní. Jeho syntéza je provázena mimořádnými technickými obtížemi. Laboratorně se ve vyhovující čistotě připravuje tavením boraxu s chloridem amonným, technická příprava spočívá v tavení (500-950 °C) kyseliny borité s močovinou v atmosféře vodíku. Tvoří se také reakcí boru s dusíkem nebo amoniakem v žáru nebo termickou deamonací amidu boritého. Vodní parou se v červeném žáru rozkládá na oxid boritý a amoniak. Hexagonální modifikace má vrstevnatou strukturu podobnou grafitu.
 |  |
Vazebné vzdálenosti uvnitř vrstev ukazují na významný příspěvek π-vazeb. Atomy boru v jedné vrstvě se nacházejí nad atomy dusíku druhé vrstvy ve vzdálenosti 333 pm (velmi blízké hodnotě v grafitu). Při vysoké teplotě a tlaku ho lze převést na kubickou formu s mřížkou sfaleritu (1 800 °C, tlak 8 500 GPa, katalýza alkalickým kovem) nebo wurtzitu (nižší teplota). Fluor převádí nitrid boritý kvantitativně na fluorid boritý a didusík, fluorovodík na tetrafluoroboritan amonný NH4BF4.
Oxid bornatý BO vzniká dehydratací kyseliny dibornaté H4B2O4 (250 °C, nízký tlak) jako plynný dimer (BO)2, v pevném stavu má polymerní charakter (BO)n
Oxid boritý B2O3 je bezbarvá sklovitá látka, která obtížně krystaluje (do roku 1937 byl znám jen v amorfní formě). Připravuje se opatrnou dehydratací kyseliny orthoborité, s vodou ji za silného vývoje tepla opět poskytuje. Ve sklovitém stavu sestává ze síťoví částečně uspořádaných jednotek BO3, mezi nimiž převládají šestičlenné kruhy (BO)3. V běžné krystalické formě (ρ = 2,56 g.cm-3) je tvořen sítí trigonálních skupin BO3 vzájemně spojených přes kyslíkové atomy.
Vysokotlaká forma (3,5 GPa, 525 °C, ρ = 3,11 g.cm-3) je složena z deformovaných, vzájemně propojených tetraedrů BO4.
Sulfid boritý B2S3 je bezbarvá až slabě nažloutlá krystalická látka s tendencí k tvorbě skelné fáze. Vzniká přímou reakcí prvků za zvýšené teploty, vodou se rozkládá na kyselinu trihydrogenboritou a sulfán. Má zajímavou vrstevnatou strukturu (zcela odlišnou od oxidu borité ho, poněkud připomínající nitrid boritý) sestávající ze šesti- a čtyřčlenných kruhů (B3S3 resp. B2S2). Zahříváním B2S3 se sírou (300 °C) byl připraven sulfid B8S16 se strukturou připomínající porfin.

Struktura B8S16
Halogenoderiváty BX3 a B2X4 (X = F, Cl, Br, I) lze považovat za první dva členy homologické řady BnXn+2, jejíž vyšší členy jsou známy pouze v kombinaci s fluorem (B3F5, B4 F6.L, B8F12). Jsou známy také elektroneutrální closo-polyedrické sloučeniny BnXn (pro chlor je n = 4, 8-12, pro brom n = 7-10 a pro jod n = 9). Prokázány (nikoliv izolovány) byly i smíšené halogenidy BX3-nYn (n = 1, 2) a BXYZ.
Trihalogenidy borité BX3 jsou těkavé reaktivní sloučeniny s trigonálně planární strukturou (významně se v ní uplatňuje delokalizovaná π-vazba) nejevící tendenci k dimerizaci. Dosud se nepodařilo kvantitativně postihnout závislost míry přenosu náboje z halogenu k boru na atomovém čísle halogenu pro komplikace způsobené paralelním účinkem několika faktorů (rozdílný rozsah překryvu a tím i energie π-vazeb). Chovají se jako Lewisovy kyseliny, jejichž síla klesá se snižující se hmotností halogenu (BI3 > BBr3 > BCl3 > BF3).
Fluorid boritý BF3 (b. t. -131 °C, b. v. -101 °C) je bezbarvý plyn, který se připravuje zahříváním směsi oxidu boritého (nebo boritanů), fluoridu vápenatého a koncentrované kyseliny sírové
B2O3 + 3CaF2 + 3 H2SO4→ 2 BF3 + 3 CaSO4 + 3 H2O
 |  |
Vazba B-F ve fluoridu boritém je nejsilnější známá jednoduchá vazba (646 kJ.mol-1). S amoniakem tvoří stabilní adukt BF3.NH3, s vodou vytváří dva DA-komplexy BF3.H2O a BF3.2H2O. S nadbytkem vody poskytuje fluorid boritý kyselinu tetrafluoroboritou HBF4 (lze ji připravit také rozpouštěním kyseliny borité v kyselině fluorovodíkové)
4 BF3 + 6 H2O → 3 H3O+ + 3 BF4- + 3 H3BO3
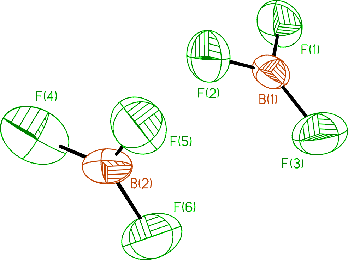
HBF4 je silnou kyselinou schopnou existence pouze v roztoku (podobně jako kyselina fluorokřemičitá). Tetrafluoroboritany se připravují její neutralizací nebo reakcemi fluoridu boritého s fluoridy kovů. Anion BF4− má tvar tetraedru, délka vazby B-F se připojením F− k BF3 významně prodlouží (ze 130 na 145 pm). Všechny tetrafluoroboritany (s výjimkou KBF4) jsou ve vodě dobře rozpustné za současné hydrolýzy aniontu BF4−
BF4– + H2O ⇌ [B(OH)F3]– + HF
Ostatní tetrahalogenoboraty jsou méně stálé a existují jen s velkými kationty (Rb+, Cs+, NR4+). Pro své akceptorické schopnosti se fluorid boritý používá jako katalyzátor v organické syntéze (mimořádný technický význam má za spolupůsobení fluorovodíku při krakování uhlovodíků).
Chlorid boritý BCl3 (b. t. -107 °C, b. v. 12,5 °C) je bezbarvý, na vlhkém vzduchu dýmající plyn. Připravuje se žíháním oxidu boritého a uhlí v proudu chloru (redukční chlorací)

Vodou se (stejně jako bromid a jodid boritý) rozkládá na kyselinu orthoboritou a halogenovodíkovou
BCl3 + 3 H2O → H3BO3 + 3 HCl
Bromid boritý BBr3 (b. t. -46 °C, b. v. 91 °C) je bezbarvá kapalina, která se připravuje vedením par bromu přes zahřátý bor. Termicky se rozkládá, stejně jako jodid boritý, za uvolnění halogenu. Jodid boritý BI3 (b. t. 43 °C, b. v. 210 °C) je pevná bezbarvá látka vznikající účinkem jodovodíku na chlorid boritý za teploty červeného žáru. Jeho reakce s vodou má explozivní charakter.
Všechny halogenidy B2X4 mají v kondenzovaných fázích planární strukturu (X2 B-BX2 s dlouhou vazbou B-B; analogickou strukturu mají anion šťavelanový C2O42− a molekula N2O4), v plynné fázi počínaje chloridem preferují neplanární konformaci. Jsou vysoce reaktivní, na vzduchu samozápalné a mnohem méně stálé než trihalogenidy. B2Cl4 (b. t. -92.6 °C, b. v. 65,5 °C) je bezbarvá kapalina, která se připravuje účinkem elektrického výboje na páry chloridu boritého. S vodou poskytuje kyselinu dibornatou H4B2O4
B2Cl4 + 4 H2O → H4B2O4 + 4 HCl
Termicky se B2Cl4 a B2Br4 už při mírných teplotách rozkládají na closo-halogenoborany BnXn. B4Cl4 je světle žlutá snadno těkavá látka s pravidelnou closo-tetraedrickou strukturou, purpurové krystaly B8Cl8 obsahují dodekaedrické klastry closo-B8. Poměrně stálé jsou molekuly B9X9 (X = Cl, Br, I) se strukturou trojnásobně zastřešeného trigonálního prizmatu.
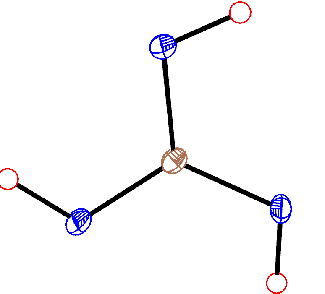
Kyselina trihydrogenboritá H3 BO3 (orthoboritá) tvoří perleťově bílé šupinkovité krystaly, jejichž rozpustnost ve vodě silně vzrůstá s teplotou. Připravuje se působením kyseliny chlorovodíkové nebo sírové na roztok tetraboritanu sodného. V měkkých a podél vrstev snadno štípatelných krystalech jsou planární molekuly H3BO3 uspořádány do vrstev (se šestiúhelníkovou výstavbou) vzájemně poutaných vodíkovými můstky.
 |  |
H3BO3 je velmi slabou pouze jednosytnou kyselinou (pKa = 9,25) působící výhradně jako akceptor aniontu OH−
H3BO3 + 2 H2O ⇌ B(OH)4– + H3O+
V bezvodé kyselině sírové se kyselina orthoboritá chová jako silná kyselina:
H3BO3 + 6 H2SO4 ⇌ [B(OSO3H)4]– + 3 H3O+
Kyselost roztoků kyseliny borité se podstatně zvyšuje přídavkem organických sloučenin s větším počtem skupin OH (glycerol, mannitol). Jako silné kyseliny se chovají vznikající cheláty, které umožňují titrační stanovení kyseliny orthoborité. Působením methanolu v přítomnosti koncentrované kyseliny sírové na kyselinu orthoboritou se tvoří její těkavý trimethylester B(OCH3)3
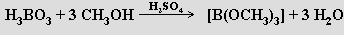
Jeho hoření provázené zeleným zbarvením plamene se využívá k důkazu boru.

Zahřátím nad 100 °C se kyselina trihydrogenboritá dehydratuje na kyselinu hydrogenboritou (metaboritou) (HBO2)n známou ve třech krystalových modifikacích (orthorhombické, monoklinické a kubické) lišících se svými stavebními jednotkami, hustotou i koordinačními čísly atomů boru (3, 3 i 4, 4).

Dalším zahříváním přechází kyselina metaboritá na oxid boritý.
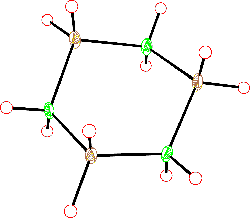
Základními stavebními jednotkami boritanů jsou trigonálně planární skupiny BO3 a tetraedrické jednotky BO4, které se prostřednictvím kyslíkových atomů spojují v polymerní řetězce nebo cykly (struktura a zákonitosti jejich výstavby jsou podobné jako u křemičitanů). Orthoboritany s izolovanými anionty BO33− jsou řídké (LnIIIBO3, Mg3(BO3)2), diboritanové anionty B2O54− byly zjištěny v CoIB2O5, Mg2B2O5 a Fe2B2O5. cyklo-triboritany (trimetaboritany) alkalických kovů MI3B3O6 jsou tvořeny šestiúhelníkovými anionty (strukturně analogickými borazolu) s delokalizovanými π-vazbami.
 [BO3]3− |  [B2O5]4− | 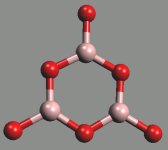 [B3O6]3− |
Metaboritany kovů alkalických zemin MII(BO2)2 obsahují nekonečné řetězce (BO2)nn−. Tetraedrické jednotky BO4 existují v TaVBO4, strukturně analogické anionty tetrahydroxoboritanové [B(OH)4]− jsou přítomny v Na2 [B(OH)4]Cl.
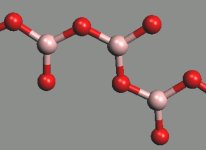 [(BO2)]nn− | 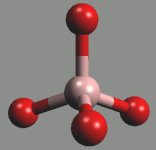 [BO4]4− |  [B(OH)4]− |
Hydratované polyboritany typu dihydrátu pentaboritanu draselného K[B5O6(OH)4].2H2O nebo oktahydrátu tetraboritanu disodného Na2[B4O5(OH)4].8H2O jsou tvořeny skupinami BO3 i BO4. Připravují se reakcemi kyseliny orthoborité s hydroxidy alkalických kovů v roztoku nebo tavením kyseliny orthoborité s oxidy nebo hydroxidy kovů (často vznikají ve sklovitém stavu). Vzdálenosti B–O v tě chto rozmanitých strukturách se mění ve značném rozmezí a obecně rostou se zvyšujícím se koordinačním číslem boru (B=O 120 pm, B-O v BO3 128-143 pm a v BO4 143-155 pm). Ve vodě jsou rozpustné jen boritany alkalických kovů. Jejich roztoky reagují v důsledku hydrolýzy silně alkalicky, krystalují obvykle jako hydráty.
Pro praxi významný borax Na2[B4O5(OH)4].8 H2O (často nesprávně formulovaný jako dekahydrát Na2B4O7.10H2O) tvoří bezbarvé krystaly, které na vzduchu zvě trávají a při zvýšené teplotě (350 až 400 °C) zcela dehydratují.
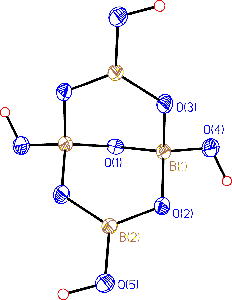 |  |
Sklovitá tavenina boraxu rozpouští mnoho kovových oxidů za vzniku charakteristicky zbarvených boraxové perličky využívaných v kvalitativní analýze. Borax se používá i při výrobě smaltovaných nádob a optických skel, úpravě glazur na keramiku a při pájení kovů.
Peroxoboritan sodný Na2[B2(O2)2(OH)4].6H2O (NaBO3.4 H2O) vzniká účinkem peroxidu vodíku na boritan sodný nebo peroxidu sodného na kyselinu orthoboritou a obsahuje dvě můstkové peroxoskupiny -O-O-. Ve vodném roztoku snadno uvolňuje peroxid vodíku, a používá se proto jako bělicí složka pracích prostředků.
Borazol B3N3H6 (b. t. -58 °C, b. v. 55 °C) je bezbarvá kapalina aromatického zápachu. Byl získán ze směsi produktů reakce diboranu s amoniakem (A. Stock, E. Pohland, 1926) a nyní se výhodněji připravuje účinkem chloridu boritého na suspenzi chloridu amonného v chlorbenzenu a následnou reakcí vzniklého trichlorborazolu s hydroboratem lithným
3 BCl3 + 3 NH4Cl → B3N3H3Cl3 + 9 HCl
B3N3H3Cl3 + 6 LiBH4 → B3N3H6 + 6 LiCl + 3 B2H6
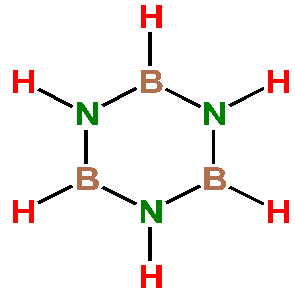
Fyzikálními vlastnostmi i strukturou je příbuzný izoelektronovému benzenu (anorganický benzen). V důsledku nesymetrického rozložení π-elektronové hustoty podél kruhu je borazol náchylnější k adičním reakcím než benzen. Ochotně reaguje s vodou, methanolem a halogenovodíky za tvorby aduktů 1:3, které zahřátím odštěpují vodík

Všechny známé reakce borazolu zahajuje nukleofilní atak na atom boru. Za podmínek obvyklých pro elektrofilní substituce se kruh B3N3 ničí buď oxidací nebo solvolýzou.
Na dusíku i boru substituované boraziny se dají připravit vhodnou volbou výchozího aminu a halogenidu boru. Zahříváním monocyklických borazinů lze dospět k polyborazinovým analogům naftalenu a bifenylu.
Zajímavou sloučeninou je (BNMe2)6 připravený (1980) ve formě oranžově červených krystalů zahříváním B2(NMe2)2. Kruh B6 má židličkovou konformaci, okolí všech atomů boru i dusíku je trigonálně planární a exocyklické skupiny NMe2 jsou pootočeny vzhledem k rovině tří přilehlých atomů boru o 65°. Struktura je blízká uhlíkatým radialenům (isoelektronovému C6(=CHMe)6 se shodnou konformací cyklu C6).