Alan AlH3 je bezbarvá netěkavá pevná polymorfní (existuje několik krystalických i amorfní modifikace) látka termicky stálá do 150 °C. V α-AlH3 je hliník oktaedricky koordinován šesti atomy vodíku (rAl-H = 172 pm), což svědčí o uplatnění třícenterních dvouelektronových vazeb podobně jako v boranech.

Alan se nejčastěji připravuje působením chloridu hlinitého na hydridohlinitan lithný v prostředí diethyletheru

Po vzniku je v roztoku monomerní, krystaluje z něho jako etherát proměnlivého složení. Delším stáním se z roztoku vylučuje pevný bílý polymerní produkt (AlH3)x. Je silným redukčním činidlem bouřlivě reagujícím s vodou. Podobně jako diboran jeví i alan tendenci k tvorbě DA-komplexů s donory (H3 Al.N(CH3)3; H3Al.2N(CH3)3 je první zjištěná sloučenina hliníku s trigonálně bipyramidální strukturou a koordinačním číslem hliníku pět).
Formální koordinace hydridového aniontu k alanu vede k hydridohlinitanům, které lze získat působením hydridů alkalických kovů na chlorid hlinitý
AlCl3 + 4 LiH → Li[AlH4] + 3 LiCl
Hydridohlinitan lithný Li[AlH4] je bílá krystalická látka, termicky stálá do 120 °C. Je rozpustná v diethyletheru, s vodou energicky reaguje za vývoje vodíku
[AlH4]– + 4 H2O → [Al(OH)4]– + 4 H2
Je všestranně použitelným redukčním činidlem (komerčně dostupným od roku 1948). Velký význam má v organické syntéze (v 70.letech bylo známo přes 60 funkčních skupin, s nimiž Li[AlH4]¨reaguje), i když v posledních letech je nahrazován selektivnějšími hydroboraty nebo organokovovými hydridy. Al[BH4]3 poskytuje při termickém rozkladu dvojjaderný komplex [Al2B4H18], znám je i Li3[AlH6]. Zajímavou čtvercově pyramidální strukturu má [Al(BH4)2CH3] vznikající reakcí Al[BH4]3 s Al2(CH3)6
Borid hlinitý o složení AlB2 má vrstevnatou strukturu, AlB12 obsahuje kubooktaedrické klastry B12, které se v kubické plošně centrované mřížce střídají s atomy hliníku (podobně je tomu i u boridů skandia, yttria, zirkonia, lanthanoidů a aktinoidů).
Karbid hlinitý Al4C3 se tvoří se přímým sloučením prvků za vysoké teploty. Je to světle žlutá, tvrdá a těžkotavitelná látka se složitou strukturou. Obsahuje izolované atomy uhlíku a vodou se proto rozkládá za vzniku methanu.
Nitrid hlinitý AlN se tvoří zahřátím hliníku v atmosféře dusíku nebo žíháním směsi oxidu hlinitého s uhlíkem v atmosféře dusíku v elektrické peci
Al2O3 + 3 C + N2→ 2 AlN + 3 CO
Je to termicky vysoce stabilní sloučenina vodou se rozkládající na hydroxid hlinitý a amoniak.
Fosfid hlinitý AlP se získává zahřátím hliníku s červeným fosforem. Je termicky stabilní, obtížně tavitelný a má, stejně jako nitrid hlinitý, strukturu wurtzitu. Vodou se rozkládá za vzniku fosfanu PH3
Oxid hlinitý se v přírodě se vyskytuje jako korund (α-Al2O3, ρ = 4,0 g.cm-3). Lze jej připravit spálením hliníku, silným žíháním (1200 °C) hydroxidu nebo oxidhydroxidu hlinitého. Je velmi tvrdý (9 v Mohsově stupnici), málo těkavý a těžko tavitelný (b. t. 2045 °C). Jeho zrnitá forma se nazývá smirek. Nerozpouští se ve vodě, kyselinách ani hydroxidech, do roztoku ho lze převést jen tavením s hydrogensírany nebo hydroxidy alkalických kovů. Používá se jako brusný materiál (i do zubních past) a součást žáruvzdorných hmot a keramiky. Termickou dehydratací hydrargyllitu (γ-Al(OH)3) i böhmitu (γ-AlO(OH)) se tvoří méně kompaktní (ρ = 3,4 g.cm-3) kubický γ-Al2O3, který má defektní strukturu spinelu. Je rozpustný v kyselinách i alkalických hydroxidech a na α-Al2O3 přechází silným žíháním. Vyznačuje se velkým aktivním povrchem („aktivovaný oxid hlinitý“) a používá se jako katalyzátor, nosič katalyzátorů nebo chromatografické medium.
 |  |
Jiný strukturní typ vykazuje ochranná vrstvička Al2O3 na povrchu kovu, která má defektní strukturu chloridu sodného s atomy hliníku obsazujícími dvě třetiny oktaedrických mezer v kubické plošně centrované oxidové mřížce. Z technologického hlediska je velmi významná výroba vláken z oxidu hlinitého, která byla vyvinuta v polovině sedmdesátých let. Tento vysoce inertní materiál našel využití v chemickém průmyslu (filtrační plachetky, nosiče katalyzátorů) i v metalurgii (zpevnění slitin hliníku a hořčíku užívaných v letectví a automobilovém průmyslu).
V některých sloučeninách existujících pouze v pevné fázi se hliník kombinuje s jedním nebo více kovovými kationty a anionty oxidovými za vzniku smíšených oxidových fází. Spinely (spinel MgAl2O4, hercynit FeAl2O4, gahnit ZnAl2O4, Thenardova modř CoAl2O4) popisuje obecný vzorec AB2X4 a jejich elementární buňka obsahuje osm vzorcových jednotek v téměř precizním nejtěsnějším kubickém uspořádání.
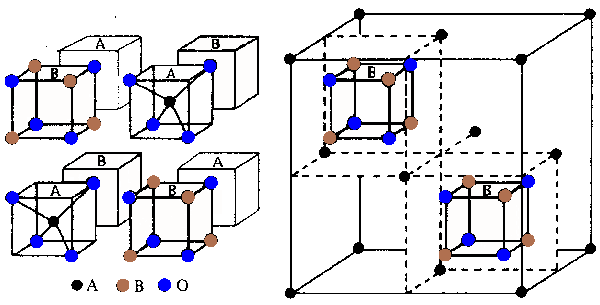
Celou buňku popisuje vzorec A8B16O32, osm atomů A je v normální spinelové struktuře umístěno v tetraedrických mezerách, šestnáct atomů B v oktaedrických mezerách. U oxidů AB2O4 lze obecně dosáhnout elektroneutrality třemi kombinacemi nábojů kationtů (AIIBIIO4, AIVBI O4 a AVIBO4, aniontem může být kterýkoliv chalkogen od kyslíku po tellur). Celkový formální náboj a rozměr kationtu určují, které kombinace prvků mohou spinelové struktury tvořit (AII – Mg, Cr, Mn, Fe, Co, Ni, Cu, Zn, Cd, Sn; BIII – Al, Ga, In, Ti, V, Cr, Mn, Fe, Co, Ni).
V některých sloučeninách o stechiometrii AB2O4 je v tetraedrických polohách umístěno osm atomů B a v oktaedrických mezerách osm atomů A a osm atomů B. Nazývají se inverzními spinely a strukturní poměry se popisují vzorcem (B)t[AB]oO4 (obsazení oktaedrických poloh může být jak uspořádané, tak i náhodné). O tvorbě normální nebo inverzní struktury rozhoduje kombinace řady faktorů. V NiAl2O4 je rozdíl ve stabilitě tak malý, že dochází k statistickému uspořádání kationtů v tetraedrických i oktaedrických mezerách ((Al0,75Ni0,25)t[Ni0,75Al1,25]oO4). Inverzní a neuspořádané spinely mají vždy defektní struktury, protože krystalograficky identické polohy v mřížce nejsou obsazovány stejným kationtem. Příbuzný typ struktury je charakteristický i pro valenčně neuspořádané spinely, v nichž dvojice kationtů AII mohou být nahrazeny kombinací AI a AIII (při náhradě osmi kationtů MgII ve spinelu Mg8 Al16O32 čtyřmi kationty LiI a čtyřmi kationty AlIII dostaneme sloučeninu sumárního vzorce LiAl5O8 – (AlII)t[LiIAlII]oO8). Podrobné studium těchto látek bylo motivováno jejich využitím v elektrotechnice založeném na citlivé závislosti jejich elektrických a magnetických vlastností na složení, teplotě a uspořádání kationtů (ferrity včetně magnetitu Fe3O4 s inverzní spinelovou strukturou). Defektní spinelovou strukturu, v níž nejsou všechna místa obsazena, má i γ-Al2O3, který se spinelem tvoří tuhé roztoky.
Strukturně patří do stejné skupiny sloučenin jako spinely také Na-β-alumina NaAl11O17 (Na2O.11Al2O3), která se dostala do popředí zájmu, když byla objevena (1967) její vysoká elektrická vodivost a ukázala se možnost využít jí jako tuhý elektrolyt. Původně byla považována za modifikaci oxidu hlinitého a přítomnost sodíku v její struktuře unikala pozornosti. Je blízce příbuzná spinelu (z 58 atomů v elementární buňce je 50 umístěno analogicky jako ve spinelu).

Lze ji připravit zahříváním (1500 °C) uhličitanu (i hydroxidu nebo dusičnanu) sodného s libovolnou modifikací oxidu hlinitého v uzavřené (pro zamezení ztrát sodíku těkáním oxidu sodného) platinové nádobě. Možnost nahrazení sodíku jinými kovovými kationty MI a hliníku jinými MIII je příčinou prakticky neomezených možností modifikace této struktury. Na-β-aluminu lze využít k výrobě semipermeabilních blan pro Na/S-články.

Sulfid hlinitý Al2S3 vzniká reakcí prvků za zvýšené teploty (1 000 °C) nebo žíháním hliníku v proudu sulfánu. Je to bílá krystalická látka s tetraedrickou koordinací hliníku, která se vodou rychle a úplně hydrolyzuje na hydroxid hlinitý a sulfán. Šedý selenid Al2Se3 a tmavošedý tellurid hlinitý Al2Te3 jsou stabilní sloučeniny s podobnými vlastnostmi.
Monohalogenidy AlX (X = F, Cl, Br, I) jsou známy pouze v plynné fázi. Jejich labilita není způsobena malou pevností vazeb Al-X, nýbrž snadnou disproporcionací na sloučeniny hlinité a hliník (ΔHdispr = -105 až -59 kJ.mol-1)
AlX (s) → 2/3 Al (s) + 1/3 AlX3 (s)
Dihalogenidy AlX2 jsou z téhož důvodu ještě méně stálé (ΔHdispr = -230 až -200 kJ.mol-1)
AlX2 (s) → 1/3 Al (s) + 2/3 AlX3 (s)
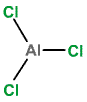
Trihalogenidy AlX3 jsou nejstabilnější a pro praxi nejvýznamnější sloučeniny halogenů s hliníkem. Všechny lze připravit přímou reakcí prvků, jsou hygroskopické a na vlhkém vzduchu dýmají. Jejich vodné roztoky se nejsnáze připravují reakcí hydroxidu hlinitého s příslušnou halogenovodíkovou kyselinou. Z roztoku krystalují jako hexahydráty (mimo nerozpustného AlF3), které nelze termicky dehydratovat (probíhá přitom hydrolýza za tvorby halogenovodíku, vodní páry a oxidu hlinitého). S organickými i anorganickými donory tvoří tetraedrické DA-komplexy. Tato schopnost podmiňuje využití chloridu hlinitého jako katalyzátoru při organických syntézách (Friedel-Craftsovy reakce).
Fluorid hlinitý AlF3 je bílá látka, která se připravuje žíháním hliníku nebo oxidu hlinitého v proudu fluorovodíku. Od ostatních halogenidů se liší svou netěkavostí (sublimuje při 1272 °C), nerozpustností ve vodě, malou reaktivitou a vysokou hodnotou slučovací enthalpie. Odlišnost je způsobena rozdílnými koordinačními čísly (šest v AlF3 a AlCl3 (s) resp. čtyři v AlCl3 (g) a ostatních; srovnej rozdíly ve dvojici CO2/SiO2 s koordinačními čísly dvě resp. čtyři) a změnami v charakteru vazby.

Mřížka fluoridu hlinitého je otevřená, může do ní vstupovat voda, a tvoří proto několik hydrátů (AlF3.xH2O, x = 1, 3, 9; není znám hexahydrát).
 α-AlF3 |  β-AlF3 |
S fluoridy kovů poskytuje fluorid hlinitý fluorohlinitany MAlF4, M2AlF5 a M3AlF6 (i složitější jako Na5Al3F14). Ve všech je hliník koordinován oktaedricky (sdílení dvou protilehlých vrcholů v AlF− resp. všech čtyř ekvatoriální ch poloh v AlF; sdílení hran nebo ploch nebylo ve fluorohlinitanech pozorováno).
Hexafluorohlinitan sodný Na3AlF6 se vyskytuje v přírodě jako minerál kryolit. Lze ho připravit reakcí
Al2O3 + 3 Na2CO3 + 12 HF → 2 Na3(AlF6) + 3 CO2 + 6 H2O
Struktura kryolitu je příbuzná perowskitu (ABO3; jedna třetina kationtů sodných a kationty hlinité obsazují oktaedrické polohy, zbývající dvě třetiny kationtů sodných mají koordinační číslo 12). Používá se při výrobě hliníku, mléčného skla a smaltů.
Chlorid hlinitý AlCl3 (b. t. 192 °C, b. s. 180 °C) se tvoří zahříváním směsi oxidu hlinitého a uhlíku v proudu chloru
Al2O3 + 3 C + 3 Cl2 → 2 AlCl3 + 3 CO
Je to bezbarvá, krystalická, snadno sublimující látka s vrstevnatou strukturu a koordinačním číslem hliníku šest.
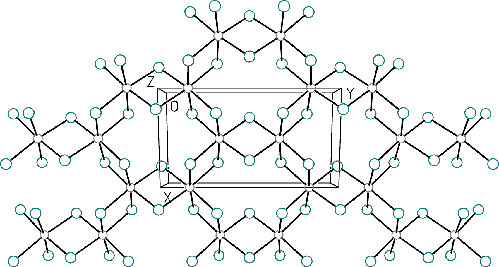
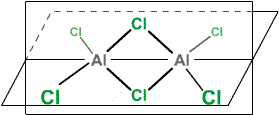
V parách nad bodem sublimace a v organických rozpouštědlech existuje ve formě dimeru Al2Cl6 (koordinační číslo hliníku se změní na čtyři). Změna u taveniny se projevuje vzrůstem objemu o 85 % a poklesem elektrické vodivosti téměř na nulu. Dochází rovněž k významné změně charakteru vazeb. Trigonálně planární molekuly AlCl3 (izostrukturní s BX3) existují v parách až při teplotách nad 2 000 °C.
 |  |
Chlorid hlinitý je výchozí látkou pro syntézu mnoha sloučenin hliníku a používá se často k převodu fluoridů kovů na odpovídající chloridy. Snadno tvoří tetraedrické adukty s dusíkatými Lewisovými bázemi AlCl3.D (D = pyridin, methylamin) a také halogenoanionty [AlCl4]−. Bromid AlBr3 (b.t. 97.5 °C) a jodid hlinitý AlI3 (b.t. 91 °C) jsou dimery i v pevném stavu a jejich přechod do kapalného skupenství probíhá bez významnějších změn vlastností).


Hydráty oxidu hlinitého mohou být buď hydrogely s proměnlivým obsahem vody nebo definované sloučeniny. Oxidhydroxid hlinitý AlO(OH) je znám ve formě diasporu α-AlO(OH) a böhmitu γ-AlO(OH), hydroxid hlinitý Al(OH)3 existuje jako bayerit α-Al(OH)3 a hydrargillit (gibbsit) γ-Al(OH)3 (uměle byl připraven nordstrandit). Gel s proměnlivým obsahem vody se získá působením vodného roztoku amoniaku na roztok hlinité soli. Stárnutím přechází hydrogel na γ-AlO(OH), který vzniká i srážením hlinitých solí amoniakem za varu. Diaspor je stabilní v teplotním intervalu 280 až 450 °C a lze jej získat hydrotermálním zpracováním böhmitu 0,4% roztokem NaOH při 380 °C a tlaku 50,66 MPa. Zaváděním oxidu uhličitého do roztoků hydroxohlinitanů se tvoří krystalický bayerit α-Al(OH)3
2 [Al(OH)4]– + CO2 → 2 α-Al(OH)3 + CO32– + H2O
Stálejší formou je hydrargillit γ-Al(OH)3, který se získá pomalým srážením teplých alkalických roztoků, stárnutím böhmitu pod zředěným roztokem alkalického hydroxidu nebo působením vody na hliníkový amalgam. Obě formy mají vrstevnatou strukturou vznikající sdílením hran oktaedrů Al(OH)6 a vzájemně se odlišují způsobem uložení vrstev (HCP v bayeritu, OH skupiny v sousedních vrstvách proti sobě v hydrargillitu) a jejich propojení vodíkovými můstky. Hydroxid hlinitý je amfoterní, jeho kyselou či zásaditou funkci vůči vodě vyjadřují rovnice
Al(OH)3 (s) + 2 H2O ⇌ [Al(OH)4]– + H3O+
Al(OH)3 (s) + 6 H2O ⇌ [Al(H2O)6]3+ + 3 OH–
Obě rovnováhy jsou posunuty prakticky zcela vlevo a kyselá nebo zásaditá funkce hydroxidu hlinitého se projevuje jen vůči silnějším kyselinám či zásadám než je voda. Anionty tetrahydroxohlinitanové [Al(OH)4]− (resp. diaquatetrahydroxohlinitanové [Al(H2O)2(OH)4]−) jsou proto stálé jen v silně zásaditém prostředí. V pevných hydroxohlinitanech byla prokázána i přítomnost iontů [Al(OH)6]3−.
Všechny hlinité soli odvozené od silných kyselin jsou dobře rozpustné ve vodě. Vodné roztoky obsahují kationty [Al(H2O)6]3+ se zřetelně kyselým charakterem. Vstupují do složitých protolytických reakcí vedoucích ke vzniku hydroxoaquahlinitých komplexů v důsledku jejichž tvorby reagují roztoky kysele. Hlinité soli slabých kyslíkatých kyselin (uhličitan, dusitan, siřičitan) jsou k hydrolýze ještě náchylnější a většinou je nelze vůbec připravit. Dusičnan hlinitý Al(NO3)3 a chloristan hlinitý Al(ClO4)3 krystalují jako nonahydráty.
Síran hlinitý Al2(SO4)3 běžně krystaluje s osmnácti (také se 6, 10 a 27) molekulami vody, jeho termickou dehydratací (340 °C) lze získat bezvodou sůl, která se dalším zahříváním rozkládá na oxid hlinitý a oxid sírový. Se sírany kovů v oxidačním stupni +I tvoří síran hlinitý kamence MIMIII(SO4)2.12H2O, v nichž kation hlinitý může být nahrazen jinými kovovými kationty MIII (Cr3+, Fe3+, Ga3+, In3+, Ti3+, V3+). Všechny kamence krystalují v kubické soustavě a jsou vzájemně izomorfní (jsou známy i kamence selenanové a směsné kamence síranoselenanové). Síran hlinitý má rozsáhlé použití v papírenském a textilním průmyslu.
Dihlinitan trivápenatý Ca3Al2O6 je významnou složkou portlandského cementu. Jeho základní stavební jednotkou je dvanáctičlenný kruh [Al6O18]18− ze spojených tetraedrů {AlO4} (jeho struktura byla stanovena v roce 1975).

Struktura aniontu [Al 6O18 ]18−
Elementární buňku tvoří osm takových kruhů, které v ní vytvářejí dutinu (o průměru 147 pm). Ta spolu s určitým napětím v mřížce napomáhá rychlé reakci s vodou. Složení produktů hydratace závisí na teplotě (při teplotě nad 21 °C se tvoří Ca3Al2O6 .6H2O, při nižších teplotách 2CaO.Al2O3.5-9H2O a 4CaO.Al2O3..12-14H2O). Předčasnému tuhnutí způsobenému vznikem těchto sloučenin se zabraňuje přídavkem sádry (2–5 %), která v přítomnosti hydroxidu vápenatého s rozpustnými hlinitany reaguje za tvorby mnohem méně rozpustného 3CaO.Al2O3.3CaSO4.31H2O (ten se přednostně sráží a rychlost tuhnutí zpomalí na potřebnou úroveň).
Druhým významným systémem s hlinitanem vápenatým je cement s vysokým obsahem oxidu hlinitého, který se vyrábí tavením (1425–1500 °C) bauxitu a vápence s příměsí oxidů křemičitého a titaničitého. Tuhnutí tohoto cementu je způsobeno tvorbou gelu hlinitanů vápenatých CaO.Al2O3.10H2O, 2CaO.Al2O3 .8H2O, 3CaO.Al2O3.6H2O a 4CaO.Al2O3.13H2O. V krátké době (24 hod.) je velice pevný, odolává korozi slanou mořskou vodou a slabými minerálními kyselinami a používá se i jako žáruvzdorný (do 1 500 °C) cement. Narušován je dlouhodobým současným působením tepla a vlhka.
Alkyl(aryl)alany jsou bezbarvé kapaliny s nízkým bodem varu, na vzduchu samozápalné. S vodou energicky reagují na hydroxid hlinitý a příslušný uhlovodík. Mají strukturu analogickou dimerním halogenidům hlinitým (menší sklon k dimerizaci mají deriváty s rozvětvenějšími alkyly). Lze je připravit reakcí hliníku s alkylrtuťnatými sloučeninami při zvýšené teplotě
2 Al + 3 Hg(CH3)2 → Al2(CH3)6 + 3 Hg
nebo účinkem Grignardových činidel na chlorid hlinitý
6 Mg(CH3)Cl + 2 AlCl3 → Al2(CH3)6 + 6 MgCl2
Preparativně výhodná je reakce mezi slitinou hořčíku s hliníkem a alkylhalogenidem
6 Mg3Al2 + 6 C2H5Cl → Al2(C2H5)6 + 3 MgCl2
Hlavní použití těchto sloučenin je v oblasti katalýzy při syntéze alkoholů a alkenů se středně dlouhými nerozvětvenými řetězci (Zieglerův katalyzátor) a při nízkotlaké stereoregulární polymeraci olefinů (Ziegler-Natta katalyzátor s účastí TiIII). Jsou známy i alkylhlinité sloučeniny částečně substituované halogeny o složení Al2R4X2 a Al2R2X4
4 Mg(CH3)Cl + 2 AlCl3 → Al2(CH3)4Cl2 + 4 MgCl2
4 Al + C2H5Cl → Al2(C2H5)2Cl4 + Al2(C2H5)4Cl2
Oproti sloučeninám alkylhlinitým nejsou samozápalné. Z komplexních sloučenin hliníku jsou významné cheláty s vícefunkčními ligandy, v nichž hliník preferuje koordinační číslo šest (komplex tris(8-hydroxychinolin)hlinitý se využívá ke gravimetrickému stanovení hliníku).