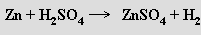
Obsah zinku v zemské kůře je 76 ppm, kadmia 0,16 ppm a rtuti 0,08 ppm. Všechny tři kovy se v přírodě vyskytují ve formě sloučenin (rtuť výjimečně i volná), jsou chalkofilní, zinek se často nachází spolu s olovem a stříbrem, kadmium doprovází zinek. Nejdůležitějšími minerály této trojice prvků jsou sfalerit (blejno zinkové) ZnS, zinkit ZnO, smithsonit (kalamín) ZnCO3, greenockit β-CdS a rumělka HgS. Zinek je významným biogenním prvkem, kadmium a rtuť jsou naopak mimořádně toxické.
Zinek a kadmium jsou stříbrolesklé měkké neušlechtilé kovy, za laboratorní teploty křehké, nad 150 °C kujné a tažné. Rtuť je ušlechtilý kov, který má ze všech kovů nejnižší body tání a varu (už při 25 °C má tenzi par 2,53 Pa) a poměrně vysoký měrný elektrický odpor. Rtuť byla využita k definici mezinárodní jednotky elektrického odporu - ohmu Ωint). Všechny tři kovy 12. skupiny krystalují v deformovaném nejtěsnějším hexagonálním uspořádání (HCP).
Důsledkem energetické nevýhodnosti vazebného využití (n-1)d-orbitalů je výrazné snížení variability vazebných možností prvků 12. skupiny oproti přechodným kovům. Dominuje u nich oxidační stupeň +II, pouze u rtuti je možná i hodnota +I, ale jen ve skupině Hg2II (není proto možné psát Hg2+ + Hg0 ↔ 2 Hg+, nýbrž jen Hg2+ + Hg ↔ Hg22+). Jsou známy i soli polykationtů Hg32+ a Hg42+. Vzhledem k úplnému zaplnění d-orbitalů jsou sloučeniny zinku, kadmia a rtuti diamagnetické a většinou bezbarvé. Podstatně větší poměr náboje jádra k poloměru atomu oproti kovům alkalických zemin je příčinou vyšších ionizačních energií a tím i menší možnosti tvořit iontové vazby. (n-1)d-elektrony nejsou využitelné k tvorbě dativních π-vazeb. Ve sloučeninách těchto prvků se uplatňují koordinační čísla dvě až šest (vzácně sedm a osm), převažuje lineární (rtuť) a tetraedrické (zinek a kadmium) uspořádání.
Zinek a kadmium se svými chemickými vlastnostmi blízce podobají (neuplatňuje se již vliv lanthanoidové kontrakce) a na rozdíl od rtuti se rozpouštějí ve zředěných kyselinách
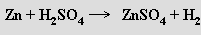
Všechny tři kovy se rozpouštějí v koncentrovaných oxidujících kyselinách

Stupeň oxidace rtuti kyselinou dusičnou lze ovlivnit i poměrně malou změnou reakčních podmínek (zředěná / koncentrovaná kyselina, nedostatek / nadbytek rtuti, teplota)
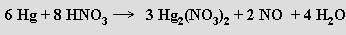
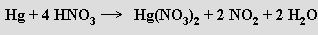
Zinek (kadmium a rtuť nikoliv) se rozpouští i ve vodných roztocích silných hydroxidů
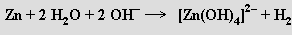
Zinek a kadmium se vzdušným kyslíkem na povrchu oxidují už za laboratorní teploty, rtuť až při 350 °C a vzniklý oxid rtuťnatý se dalším malým zvýšením teploty (400 °C) opět štěpí na své komponenty. Všechny tři prvky reagují přímo s halogeny a se sírou a jsou netečné k vodíku, uhlíku a dusíku. Hodnota (164) rovnovážné konstanty K = [Hg22+]/[Hg2+] vypočtená z redoxních potenciálů naznačuje přednostní existenci rtuťných sloučenin. Malá rozpustnost nebo ionizovatelnost sloučenin rtuťnatých je příčinou nízké koncentrace iontů Hg2+ v roztocích a proto musí být nízká i koncentrace iontů Hg22+, což vede k jejich disproporcionaci na Hg a Hg2+. Ve vodě většinou nerozpustné rtuťné sloučeniny vznikají nejčastěji reakcí rtuti se sloučeninami rtuťnatými. Jsou známy všechny halogenidy rtuťnaté i rtuťné, ale oxid a sulfid tvoří jen HgII. Rtuť má schopnost rozpouštět některé kovy (především těžké, kovy první přechodné řady jsou s výjimkou mědi a manganu ve rtuti nerozpustné) za tvorby amalgamů, u nichž v řadě případů vysoká slučovací tepla i stechiometrické složení svědčí o tvorbě intermetalických sloučenin (Hg2Na). Amalgamy sodíku a zinku jsou důležitými redukčními činidly. Stabilita alkyl- a arylderivátů roste od zinku ke rtuti. V oxidačním stavu +II tvořív všechny tři prvky velký počet komplexních sloučenin, rtuťnatých komplexů je málo.
Zinkové minerály jsou rozptýlené a před zpracováním je třeba je zkoncentrovat. Smithsonit se převede na oxid, z něhož se kov získá po rozpuštění v kyselině sírové elektrolyticky (v 99,95% čistotě) nebo se využije redukce koksem
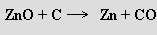
Takto připravený produkt se čistí vakuovou destilací, při níž se, vzhledem k dostatečně rozdílným bodům varu obou prvků oddělí i přítomné kadmium. V důsledku termické nestálosti oxidu rtuťnatého se pražením rumělky získá přímo na kovová rtuť

Bohaté rudy rtuti se zpracovávají pražením se železným šrotem
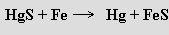
nebo s oxidem vápenatým

Snadno oxidovatelné kovy (železo, měď, zinek) se odstraňují vháněním vzduchu do horké rtuti (jejich oxidy vytvoří strusku), nejčistší rtuť se získává vakuovou destilací.
Zinek se používá jako antikorozní vrstva k ochraně železa (až 40 % z roční produkce), tvoří řadu významných slitin (s mědí mosazi, s mědí a stříbrem nové stříbro). Velké množství zinku se spotřebuje k výrobě suchých článků (Leclanchéovy, rtuťové a alkalické manganové články). Možnosti použití kadmia snižuje jeho toxicita. Slouží k výrobě elektrod pro NiCd-články a v jaderných reaktorech jako lapač neutronů. Kromě laboratorního použití (náplň do teploměrů, barometrů a difúzních vývěv, elektrody v polarografii) se rtuť používá v průmyslu při elektrochemických výrobách (Cl2, NaOH) a v elektrotechnice (usměrňovače, výbojky).