
Nejčastější vazebnou interakcí, kterou vodík uplatňuje, je kovalentní dvouelektronová σ-vazba. Jedno- a tříelektronové vazby jsou známy v částicích H2+ a H2− (v obou je vazebný řád 1/2). Iontově je vázán v solných hydridech nejelektropozitivnějších kovů. Aniont H− je značně objemný, protože na dva elektrony působí jen jeden kladný náboj protonu (vypočtený poloměr iontu H− je 208 pm, v LiH byla zjištěna hodnota 126 pm a v CsH 154 pm; nižší experimentálně nalezené hodnoty jsou důsledkem kompresibility difusního elektronového obalu hydridového aniontu a podílu kovalentní vazebné interakce). Je mimořádně silnou bazí (silnější než OH− ve vodě nebo NH2− v kapalném amoniaku). Velmi malý ion H+ (proton s rozměrem 1,5.10-3 pm, běžné rozměry atomů jsou v rozmezí 50-220 pm) neexistuje v kondenzovaných fázích nikdy samostatně, vždy je asociován s jinými částicemi (přenos H+ je základem acidobazických jevů ve vodném prostředí). Vodíkové můstky (většinou lineární útvary X-HY s energií 10-60 kJ.mol-1) jsou interakcí druhého řádu, ale pro vlastnosti sloučenin, v nichž se uplatňují, mají neobyčejný význam. Ilustrativní je vliv existence vodíkových můstků na řadu fyzikálně-chemických vlastností molekulových hydridů (jsou příčinou anomálně vysokých hodnot bodů tání, bodů varu a výparných tepel amoniaku, vody a fluorovodíku vzhledem k jejich těžším homologům). Ovlivňují elektrické vlastnosti, rozpustnost, viskozitu a citlivost chromatografického dělení mnoha sloučenin. Významnou roli hrají ve struktuře bílkovin a při přenosu dědičné informace.
Divodík není za laboratorní teploty příliš reaktivní v důsledku vysoké energie vazeb H-H. K urychlení jeho reakcí je možno využít heterogenní (nikl, palladium, platina) i homogenní katalýzu (sloučeniny kobaltu, [RhCl(P(C6H5)3)] k redukci nenasycených organických sloučenin za laboratorní teploty a tlaku v organických rozpouštědlech). Obecně má vodík redukční vlastnosti, už za laboratorní teploty redukuje z roztoku chloridu palladnatého palladium (reakce je užívána k důkazu přítomnosti vodíku v plynných směsích)

Vodík hoří, ale hoření nepodporuje. S fluorem reaguje explozívně už při -200 °C, s chlorem za laboratorní teploty při osvětlení, s bromem a jodem málo ochotně za tvorby halogenovodíků.
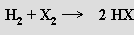
S kyslíkem tvoří výbušnou směs zvanou třaskavý plyn. Iniciovat řetězovou reakci obou prvků, jejímž produktem je voda, je možné zahřátím nebo jiskrou.

Reakce divodíku s oxidem uhelnatým (hydroformylace) poskytuje organické sloučeniny
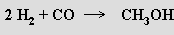
Atomární vodík je reaktivnější než molekulární, v roztocích vzniká (in statu nascendi, t.j. ve stavu zrodu) při rozpouštění neušlechtilých kovů v minerálních kyselinách (τ1/2 = 0,3 s).
Vodík se laboratorně připravuje rozpouštěním málo ušlechtilých kovů v kyselinách (nejčastěji v Kippově přístroji)
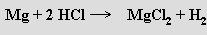
nebo alkalických hydroxidech:

Vzniká také reakcí silně elektropozitivních kovů s vodou:
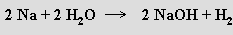
elektrolýzou vody (pro velkokapacitní výrobu vodíku je to ekonomicky nevýhodné s výjimkou přípravy těžké vody):


reakcí iontových hydridů s vodou:

nebo termickým rozkladem hydridů některých přechodných kovů:

Průmyslově se vyrábí konverzí vodního plynu:
příprava vodního plynu:

konverze:

oxidací uhlovodíků vodní parou

termickým štěpením methanu:

rozkladem sodíkového amalgamu vodou:
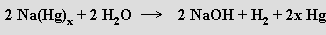
frakčním zkapalněním produktů suché destilace uhlí nebo termickým rozkladem amoniaku (běžně se ovšem využívá obrácená reakce pro syntézu amoniaku):

Vodík se využívá jako redukční činidlo při výrobě kovů a spolu s kyslíkem slouží i k jejich svařování a řezání (dosažitelná teplota plamene kyslíko-vodíkového hořáku je až 4000 K a umožňuje tavit i kovy s nejvyššími body tání jako jsou tantal a wolfram; vodík chrání současně povrch kovu před oxidací). V chemickém průmyslu je významnou surovinou pro syntézu mnoha organických (methanol) i anorganických (amoniak, chlorovodík, kyanovodík) sloučenin, v potravinářství se používá ke ztužování tuků. Slouží i jako raketové palivo a v blízké budoucnosti by se jeho spalování mohlo stát jedním ze základních zdrojů energie.