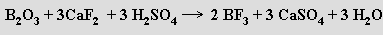
Významnou skupinou derivátů boranů jsou sloučeniny, v nichž je alespoň jedna skupina BH nahrazen uhlíkem. Nazývají se karborany a jejich studium se začalo intenzivně rozvíjet od druhé poloviny 60. let 20. století. Impulsem byl fakt, že studium těchto sloučenin překrývalo a současně spojovalo několik významných oblastí chemie - borany, komplexy přechodných kovů a organokovové sloučeniny. Nejpočetnější skupinu sloučenin tohoto typu tvoří closo-karborany. Jsou to těkavé kapaliny nebo pevné látky, které se připravují pyrolýzou (500-600 °C, používá se i elektrický výboj) směsi vhodného alkinu a boranu. Za mírnějších podmínek (200 °C) vznikají nido-karborany, které, podobně jako arachno-karborany, poskytují dalším tepelným zpracování closo-deriváty. Snadnou přípravou (reakcí acetylenu s dekaboranem(14) v přítomnosti diethylsulfidu) i vysokou stabilitou jsou pozoruhodné izomery 1,2-, 1,7- a 1,12-C2B10H12. Působením silných bazí v protických rozpouštědlech na tyto sloučeniny lze získat karboranové anionty s jedním i se dvěma zápornými náboji. Rozpoznání strukturní a elektronové podobnosti otevřené pětiúhelníkové plochy v nido-karboranech s cyklopentadienylovým aniontem vedlo k objevu metalakarboranů.
Reakce nido-C2B9H112− s chloridem železnatým v tetrahydrofuranu poskytuje růžový diamagnetický komplex FeII, který je strukturně příbuzný ferrocenu a lze ho reverzibilně oxidovat na červený komplex FeIII. V přítomnosti NaC5H5 vzniká komplex [FeIII(C5H5)(C2B9H11)]. Podařilo se připravit i dvouposchoďové sendvičové komplexy kobaltu s centrálním kruhem C2B3H4− formálně isoelektronovým s cyklopentadienylovým aniontem a další komplexy s několika ionty kovu. V elektronově bohatých komplexech NiII , PdII, CuIII a AuIII byly detekovány posunuté sendvičové struktury ([Cu(C2B9H11)2]2−), v nichž je atom kovu výrazně blíže atomům boru než atomům uhlíku.
|
nido-dimetalakarboran |
Struktura komplexu [Cu(C2 B9H11)2]2−
|
Karbid čtyřboru B4C je černá, velmi tvrdá, obtížně tavitelná a chemicky inertní látka. Vzniká žíháním boru nebo oxidu boritého s uhlím v elektrické peci (lze ho získat i ve formě vláken). V jeho krystalech existují řetězce C3 a ikosaedry B12. Používá se jako brusný materiál a k výrobě ochranných štítů letadel a neprůstřelných vest.
Nitrid boritý BN je bílý, elektricky nevodivý, termicky stálý a málo reaktivní. Jeho syntéza je provázena mimořádnými technickými obtížemi. Laboratorně se ve vyhovující čistotě připravuje tavením boraxu s chloridem amonným, technická příprava spočívá v tavení (500-950 °C) kyseliny borité s močovinou v atmosféře vodíku. Tvoří se také reakcí boru s dusíkem nebo amoniakem v žáru nebo termickou deamonací amidu boritého. Vodní parou se v červeném žáru rozkládá na oxid boritý a amoniak. Hexagonální modifikace má vrstevnatou strukturu podobnou grafitu. Vazebné vzdálenosti uvnitř vrstev ukazují na významný příspěvek π-vazeb. Atomy boru v jedné vrstvě se nacházejí nad atomy dusíku druhé vrstvy ve vzdálenosti 333 pm (velmi blízké hodnotě v grafitu). Při vysoké teplotě a tlaku ho lze převést na kubickou formu s mřížkou sfaleritu (1800 °C, tlak 8500 GPa, katalýza alkalickým kovem) nebo wurtzitu (nižší teplota). Fluor převádí nitrid boritý kvantitativně na fluorid boritý a didusík, fluorovodík na tetrafluoroboritan amonný NH4BF4.
Oxid bornatý BO vzniká dehydratací kyseliny dibornaté H4B2O4 (250 °C, nízký tlak) jako plynný dimer (BO)2, v pevném stavu má polymerní charakter (BO)n.
Oxid boritý B2O3 je bezbarvá sklovitá látka, která obtížně krystaluje (do roku 1937 byl znám jen v amorfní formě). Připravuje se opatrnou dehydratací kyseliny orthoborité, s vodou ji za silného vývoje tepla opět poskytuje. Ve sklovitém stavu sestává ze síťoví částečně uspořádaných jednotek BO3, mezi nimiž převládají šestičlenné kruhy (BO)3. V běžné krystalické formě (ρ = 2,56 g.cm-3) je tvořen sítí trigonálních skupin BO3 vzájemně spojených přes kyslíkové atomy. Vysokotlaká forma (3,5 GPa, 525 °C, ρ = 3,11 g.cm-3) je složena z deformovaných, vzájemně propojených tetraedrů BO4.
Sulfid boritý B2S3 je bezbarvá až slabě nažloutlá krystalická látka s tendencí k tvorbě skelné fáze. Vzniká přímou reakcí prvků za zvýšené teploty, vodou se rozkládá na kyselinu trihydrogenboritou a sulfán. Má zajímavou vrstevnatou strukturu (zcela odlišnou od oxidu borité ho, poněkud připomínající nitrid boritý) sestávající ze šesti- a čtyřčlenných kruhů (B3S3 resp. B2S2). Zahříváním B2S3 se sírou (300 °C) byl připraven sulfid B8S16 se strukturou připomínající porfin.
Halogenoderiváty BX3 a B2X4 (X = F, Cl, Br, I) lze považovat za první dva členy homologické řady BnXn+2, jejíž vyšší členy jsou známy pouze v kombinaci s fluorem (B3F5, B4 F6.L, B8F12). Jsou známy také elektroneutrální closo-polyedrické sloučeniny BnXn (pro chlor je n = 4, 8-12, pro brom n = 7-10 a pro jod n = 9). Prokázány (nikoliv izolovány) byly i smíšené halogenidy BX3-nYn (n = 1, 2) a BXYZ.
Trihalogenidy borité BX3 jsou těkavé reaktivní sloučeniny s trigonálně planární strukturou (významně se v ní uplatňuje delokalizovaná π-vazba) nejevící tendenci k dimerizaci. Dosud se nepodařilo kvantitativně postihnout závislost míry přenosu náboje z halogenu k boru na atomovém čísle halogenu pro komplikace způsobené paralelním účinkem několika faktorů (rozdílný rozsah překryvu a tím i energie π-vazeb). Chovají se jako Lewisovy kyseliny, jejichž síla klesá se snižující se hmotností halogenu (BI3 > BBr3 > BCl3 > BF3).
Fluorid boritý BF3 (b. t. -131 °C, b. v. -101 °C) je bezbarvý plyn, který se připravuje zahříváním směsi oxidu boritého (nebo boritanů), fluoridu vápenatého a koncentrované kyseliny sírové
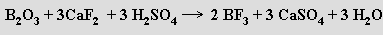
Vazba B-F ve fluoridu boritém je nejsilnější známá jednoduchá vazba (646 kJ.mol-1). S amoniakem tvoří stabilní adukt BF3.NH3, s vodou vytváří dva DA-komplexy BF3.H2O a BF3.2H2O. S nadbytkem vody poskytuje fluorid boritý kyselinu tetrafluoroboritou HBF4 (lze ji připravit také rozpouštěním kyseliny borité v kyselině fluorovodíkové)

HBF4 je silnou kyselinou schopnou existence pouze v roztoku (podobně jako kyselina fluorokřemičitá). Tetrafluoroboritany se připravují její neutralizací nebo reakcemi fluoridu boritého s fluoridy kovů. Anion BF4− má tvar tetraedru, délka vazby B-F se připojením F− k BF3 významně prodlouží (ze 130 na 145 pm). Všechny tetrafluoroboritany (s výjimkou KBF4) jsou ve vodě dobře rozpustné za současné hydrolýzy aniontu BF4−
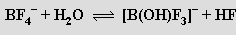
Ostatní tetrahalogenoboraty jsou méně stálé a existují jen s velkými kationty (Rb+, Cs+, NR4+). Pro své akceptorické schopnosti se fluorid boritý používá jako katalyzátor v organické syntéze (mimořádný technický význam má za spolupůsobení fluorovodíku při krakování uhlovodíků).
Chlorid boritý BCl3 (b. t. -107 °C, b. v. 12,5 °C) je bezbarvý, na vlhkém vzduchu dýmající plyn. Připravuje se žíháním oxidu boritého a uhlí v proudu chloru (redukční chlorací)
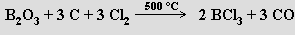
Vodou se (stejně jako bromid a jodid boritý) rozkládá na kyselinu orthoboritou a halogenovodíkovou
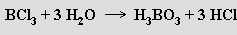
Bromid boritý BBr3 (b. t. -46 °C, b. v. 91 °C) je bezbarvá kapalina, která se připravuje vedením par bromu přes zahřátý bor. Termicky se rozkládá, stejně jako jodid boritý, za uvolnění halogenu. Jodid boritý BI3 (b. t. 43 °C, b. v. 210 °C) je pevná bezbarvá látka vznikající účinkem jodovodíku na chlorid boritý za teploty červeného žáru. Jeho reakce s vodou má explozivní charakter.
Všechny halogenidy B2X4 mají v kondenzovaných fázích planární strukturu (X2 B-BX2 s dlouhou vazbou B-B; analogickou strukturu mají anion šťavelanový C2O42− a molekula N2O4), v plynné fázi počínaje chloridem preferují neplanární konformaci. Jsou vysoce reaktivní, na vzduchu samozápalné a mnohem méně stálé než trihalogenidy. B2Cl4 (b. t. -92.6 °C, b. v. 65,5 °C) je bezbarvá kapalina, která se připravuje účinkem elektrického výboje na páry chloridu boritého. S vodou poskytuje kyselinu dibornatou H4B2O4
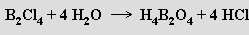
Termicky se B2Cl4 a B2Br4 už při mírných teplotách rozkládají na closo-halogenoborany BnXn. B4 Cl4 je světle žlutá snadno těkavá látka s pravidelnou closo-tetraedrickou strukturou, purpurové krystaly B8Cl8 obsahují dodekaedrické klastry closo-B8. Poměrně stálé jsou molekuly B9 X9 (X = Cl, Br, I) se strukturou trojnásobně zastřešeného trigonálního prizmatu.