
Sulfán H2S (b. t. -85,6 °C, b. v. -60,8 °C) je prudce jedovatý bezbarvý plyn nepříjemného zápachu (čichem je detekovatelný již od 0,02 ppm), který se často vyskytuje v přírodě. Vazby S-H jsou jen slabě polární, molekuly H2S mají malý dipolový moment a nevytvářejí vodíkové můstky. Rozpuštěním ve vodě (2,6 litru v 1 litru vody při 20 °C) poskytuje slabou kyselinu sirovodíkovou (sirovodíková voda, pKa'= 7,24, pKa''= 14,9) tvořící dvě řady solí – sulfidy MS a hydrogensulfidy MIHS. V superacidním prostředí (HF/SbF5) se sulfán chová jako baze a tvoří soli sulfonia H3S+. Má pouze redukční vlastnosti, oxiduje se halogeny, kyslíkem, peroxidem vodíku, železitými solemi, kyselinou dusičnou nebo koncentrovanou kyselinou sírovou na síru

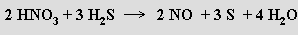
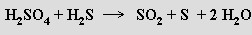

[Zobrazit video]
| Demonstrace redukčních vlastností sulfanu |
Připravuje se přímo z prvků slabě exotermickou reakcí, laboratorně nejčastěji v Kippově přístroji působením kyselin na sulfid železnatý.
Nasycením roztoků alkalických hydroxidů sulfánem vznikají hydrogensulfidy MHS, při přebytku hydroxidu pak sulfidy M2S. Sulfidy ostatních kovů vznikají přímou reakcí sulfánu s kovy
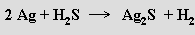
srážením nerozpustných sulfidů z roztoků rozpustných solí sulfánem nebo redukcí síranů

Ve vodě jsou rozpustné všechny iontové sulfidy a hydrogensulfidy alkalických kovů. MIIS mají strukturu typu sfaleritu nebo wurtzitu, MIVS2 mají většinou vrstevnaté, M2IIIS3 řetězové struktury. Často mají charakter berthollidů. Pražením sulfidů na vzduchu se tvoří oxidy nebo volné kovy (za vhodných podmínek sírany).
Polysulfány H2Sx jsou reaktivní olejovité kapaliny, jejichž hustota, viskozita a bod varu rostou s prodlužováním nerozvětveného řetězce Sx. V čisté formě byly izolovány nižší (x = 2-8) oligomery, vyšší existují ve směsích. Disulfán H2S2 je bezbarvý, u vyšších homologů se s prodlužováním řetězce postupně prohlubuje žluté zbarvení. Polysulfány se připravují rozkladem polysulfidů kyselinou chlorovodíkovou za chladu nebo reakcí
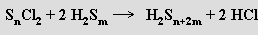
Polysulfidy obsahující řetězovité anionty Sn2− se tvoří tavením sulfidů se sírou nebo zahříváním suspenze síry v roztoku sulfidu alkalického kovu. Vodou se polysulfidy hydrolyzují obtížněji než sulfidy, neoxidují cí kyseliny je rozkládají

Disulfid železnatý (pyrit) FeS2 je důležitou surovinou pro výrobu kyseliny sírové.
Opatrnou oxidací cyklických oligomerů cyklo-Sx byly za nízkých teplot připraveny oxidy o složení SxOy jako termicky nestálé látky, v nichž cyklická struktura zůstává zachována.
Oxid sirný S2O se tvoří působením elektrického výboje na směs oxidu siřičitého a síry (dlouho byl mylně považován za oxid sirnatý SO) a v plynné fázi je tvořen lomenými molekulami SSO. Za laboratorní teploty je nestálý, snadno disproporcionuje na síru a oxid siřičitý. Při ochlazení kapalným dusíkem tuhne na oranžovou, pevnou, zřejmě polymerní látku.
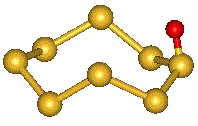
S8O
|

S7O
|
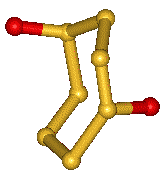
S7O2
|
Oxid siřičitý SO2 (b. t. -72,5 °C, b. v. -10 °C) je bezbarvý, jedovatý, snadno zkapalnitelný plyn s dráždivým zápachem. Jeho molekula je lomená (rSO = 143 pm, αOSO= 119,5°), dobře se rozpouští ve vodě (40 litrů v jednom litru vody při 20 °C).

[Zobrazit video]
| Oxid siřičitý vzniká přímou reakcí prvků |
Oxid siřičitý nehoří, ani hoření nepodporuje.

[Zobrazit video]
| Oxid siřičitý nehoří, ani hoření nepodporuje |
Beze změny oxidačního čísla tvoří adukty ((CH3)3N.SO2), nejtypičtější jsou pro něj redukční reakce

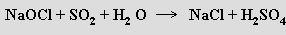
Jako oxidační činidlo se uplatňuje zřídka
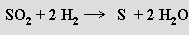

Může vystupovat jako jedno- i dvojfunkční ligand v komplexech. Průmyslově se oxid siřičitý vyrábí spalováním síry

nebo pražením pyritu na vzduchu
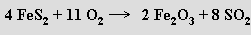
Laboratorně se získává rozkladem siřičitanů kyselinami
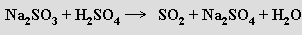

[Zobrazit video]
| Příprava oxidu siřičitého |
nebo redukcí kyseliny sírové
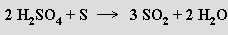
Používá se při výrobě kyseliny sírové, k odbarvování a konzervování. Kapalný oxid siřičitý se uplatňuje jako rozpouštědlo.
Oxid sírovýγ-SO3 je pevná látka podobná ledu (b. t. 16,9 °C, b. v. 44,6 °C). Je tvořena trimerními cyklickými molekulami (SO3)3, které stopami vody snadno polymerují (polymeraci lze zabránit přídavkem malých množství oxidu křemičitého nebo některých sloučenin boru) a přecházejí na lineární polymerní řetězce α- a β-SO3. Tyto dvě formy oxidu sírového je proto třeba považovat za kyseliny polysírové s vysokým stupněm polymerace. β-SO3 tvoří bílé plsťovité jehlice s vyšším bodem tání než γ-SO3 a α-SO3 má ještě vyšší bod tání (62 °C) než β-SO3. Komerčně dodávaný oxid sírový je směsí α- a β-formy. V kapalné a plynné fázi i v roztocích se ustavuje rovnováha mezi monomerními a cyklickými trimerními molekulami.
Oxid sírový je silně hygroskopický, odnímáním vody zuhelňuje organické sloučeniny. S vodou poskytuje kyselinu sírovou, s halogenovodíky kyseliny halogenosírové HSO3X. Je Lewisovou kyselinou tvořící s bázemi adukty ((CH3)3N.SO3), vůči silným akceptorům elektronového páru však může vystupovat i jako donor. S oxidy některých kovů snadno tvoří sírany a této reakce se průmyslově využívá k odstraňování oxidu sírového z kouřových plynů. Vyrábí se katalytickou oxidací oxidu siřičitého. V současnosti dominuje kontaktní způsob jeho přípravy s oxidem vanadičným jako katalyzátorem umožňujícím oxidaci oxidu siřičitého vzdušným kyslíkem. Komorová metoda (proces býval realizován v olověných komorách) využívající oxidu dusičitého jako přenašeče kyslíku je již historickou záležitostí. Laboratorně se obvykle získává vydestilováním z olea (označuje se tak 25-65 % roztok oxidu sírového v kyselině sírové) nebo termickým rozkladem některých síranů
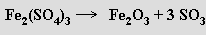
Síra tvoří několik typů halogenidů se stechiometrií S2X2 (X = F, Cl, Br), SnX2 (X = Cl, Br, I), SX2, SX4 (X = F, Cl), SF6 a S2F10. Většinou jde o reaktivní, vodou se rozkládající látky, které se nejčastěji připravují přímou syntézou z prvků.
Difluorsulfán SF2 se získává fluorací dichlorsulfánu fluorosiřičitanem draselným. Snadno dimerizuje na F3SSF. Difluordisulfán S2F2 se připravuje reakcí síry s fluoridem stříbrným za zvýšené teploty (125 °C). Existuje ve formě dvou izomerů, z nichž jeden je strukturně analogický peroxidu vodíku a druhý je tvořen nesymetrickými molekulami S=SF2 (difluorid thiothionylu). Fluorid siřičitý SF4 se tvoří reakcí dichlorsulfánu s fluoridem sodným v prostředí acetonitrilu
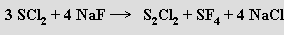
Je Lewisovým amfolytem, který s donory tvoří adukty a s fluoridy alkalických kovů pentafluorosiřičitany MISIVF5. Katalytickou oxidací poskytuje tetrafluorid thionylu SOF4. Využívá se jako selektivní fluorační činidlo. Fluorid sírový SF6 je chemicky inertní, netoxický, termicky stabilní (do 500 °C) plyn, který nereaguje s vodou, chlorovodíkem, kyslíkem ani s roztavenými alkalickými hydroxidy. Vzniká reakcí prvků již za laboratorní teploty. Dekafluorid disírový S2F10 je extrémně jedovatý a chemicky jen mírně reaktivnější než SF6. Vzniká jako vedlejší produkt při přípravě SF6, vhodněji se získává reakcí

Dichlordisulfán S2Cl2, jehož molekula je strukturním analogem peroxidu vodíku, se připravuje chlorací síry. Toxická žlutá kapalina na vlhkém vzduchu dýmá
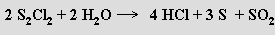
Dichlorsulfan SCl2 se tvoří další chlorací dichlordisulfánu jako červená kapalina. Jeho molekula je lomená, už za laboratorní teploty se rozkládá

Obě sloučeniny se značným průmyslovým významem (výroba chlorhydrínů z S2Cl2 a yperitu S(CH2CH2Cl)2 z ethylenu a SCl2) lze považovat za první dva členy homologické řady dichlorpolysulfánů SnCl2, jejíž vyšší členy vznikají rozpouštěním síry v S2Cl2 (obsahují až 100 atomů síry v řetězcích). Chlorid siřičitý SCl4 se tvoří působením kapalného chloru na S2Cl2. Je stálý jen za nízkých teplot, v pevném stavu má charakter soli SCl3+ Cl− (kation SCl3+ lze lépe stabilizovat většími anionty typu AlCl4−). Vyšší chloridy síry než SCl4 nejsou známy.
Z bromidů je nejlépe charakterizován dibromdisulfan S2Br2, který je isostrukturní s difluordisulfanem S2F2 a známy jsou i vyšší homology SnBr2 (n = 3-8).
Kyselina siřičitá H2SO3 je v nepatrné koncentraci (jednoznačný experimentální důkaz její existence však dosud chybí) přítomna ve vodném roztoku oxidu siřičitého obsahujícím převážně jeho hydratovanou formu SO2.xH2O, která v malé míře disociuje
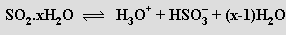
Tvoří dvě řady solí (pKa'= 1,89, pKa''= 7,00). Siřičitany a hydrogensiřičitany alkalických kovů jsou dobře rozpustné ve vodě, ostatní málo. Hydrogensiřičitany vznikají sycením vodných roztoků (nebo suspenzí) hydroxidů nebo uhličitanů oxidem siřičitým (v pevném stavu byly připraveny pouze hydrogensiřičitany velkých kationtů), siřičitany reakcí roztoků hydrogensiřičitanů s hydroxidy. Siřičitany i hydrogensiřičitany jsou středně silná redukční činidla, která se snadno oxidují na sírany

Vůči silným redukovadlům mohou vykazovat i oxidační schopnosti (redukce sodíkovým amalgamem poskytuje dithioničitany S2O62−, mravenčany jsou oxidovány na šťavelany za vzniku thiosíranu). Termicky se některé siřičitany rozkládají na oxidy
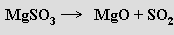
jiné disproporcionují (600°C, analogicky jako chlorečnany)
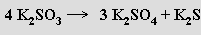
Termickou dehydratací hydrogensiřičitanů vznikají disiřičitany
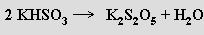
Krystalizují i z koncentrovaných roztoků hydrogensiřičitanů. Jsou to rovněž redukční činidla s nesymetrickými anionty (O2SIII-SVO3)2− obsahující síru ve dvou oxidačních stupních. V roztoku se chovají jako směs siřičitanu a hydrogensiřičitanu a jejich mateřskou kyselinu není možno izolovat.
Redukcí vodných roztoků hydrogensiřičitanů vznikají soli kyseliny dithioničité H2S2O4 (volná kyselina není známa ani v roztoku)
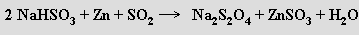
V aniontu dithioničitanovém S2O22− se zákrytovou konfigurací skupin -SO2 je neobvykle dlouhá vazba S-S (239 pm). Kyselou hydrolýzou dithioničitanů vzniká směs thiosíranu a hydrogensiřičitanu, v alkalickém prostředí jsou hydrolytickými produkty siřičitan a sulfid. Průmyslově se dithioničitan sodný Na2S2O4.2H2O využívá jako redukční činidlo (redukuje ve vodě rozpuštěný kyslík, peroxid vodíku a kationty těžkých kovů na příslušný kov, a uplatňuje se proto při čištění vody).
Halogenidy oxokyselin síry formálně vznikají nahrazením jedné nebo několika skupin -OH atomem halogenu. Nejznámějšími sloučeninami tohoto typu odvozenými od kyseliny siřičité jsou dihalogenidy thionylu SOX2. Fluorid SOF2 a chlorid thionylu SOCl2 jsou bezbarvé těkavé kapaliny, bromid thionylu SOBr2 je oranžový a méně těkavý. Nejvýznamnějším z nich je chlorid thionylu, který se připravuje reakcí oxidu siřičitého s chloridem fosforečným
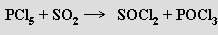
Průmyslově se vyrábí reakcí oxidu sírového s dichlorsulfánem nebo dichlordisulfánem
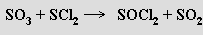
Má vlastnosti Lewisova amfolytu a pro svou afinitu k vodě se používá při přípravě bezvodých halogenidů kovů z jejich hydrátů.

Často se využívá jako chlorační a oxidační činidlo v organické syntéze, protože se nad teplotou varu rozkládá na dichlordisulfán, oxid siřičitý a chlor. Podobně jako kapalný oxid siřičitý nachází chlorid thionylu uplatnění jako nevodné ionizující rozpouštědlo. Difluorid thionylu SOF2 a chlorid-fluorid thionylu SOClF se získávají fluorací chloridu thionylu fluoridem sodným v acetonitrilu.
Kyselina sírová H2 SO4 (b. t. 10,36 °C) je bezbarvá olejovitá kapalina. Její azeotropická směs s vodou o koncentraci 98,3 % vře při 338 °C. Má vysokou permitivitu i elektrickou vodivost, která je spojena s autoprotolytickou rovnováhou

S vodou se kyselina sírová neomezeně mísí za objemové kontrakce a silného vývinu tepla a tvoří s ní krystalické hydráty s jednou až čtyřmi molekulami vody. V bezvodé kyselině sírové vedle autoprotolýzy dochází i ke kondenzaci

a v kapalné fázi je v dynamické rovnováze nejméně sedm dobře definovaných částic. Kyselina sírová má silné oxidační schopnosti a vysokou afinitu k vodě (zuhelňuje organické látky). Za horka oxiduje i některé ušlechtilé kovy. Zředěná rozpouští pouze kovy se záporným standardním potenciálem. Některé kovy (železo) jsou koncentrovanou kyselinou sírovou pasivovány. Je silnou dvojsytnou kyselinou, ve zředěných vodných roztocích plně ionizovanou, tvořící dvě řady solí. Připravuje se reakcí oxidu sírového s vodou, technologická realizace této jednoduché reakce je však komplikována snadnou tvorbou aerosolu, který z absorbéru může snadno unikat do ovzduší. V praxi se proto oxid sírový rozpouští v kyselině sírové na oleum a kyselina požadované koncentrace se získá ředěním. Kyselina sírová je vyráběna v absolutně největším objemu ze všech chemikálií a používá se především při výrobě průmyslových hnojiv, v petrochemii, papírenském a textilním průmyslu. V laboratoři slouží i jako vysoušedlo.

[Zobrazit video]
| Kontaktní způsob výroby kyseliny sírové |

[Zobrazit video]
| Komorový způsob výroby kyseliny sírové |
Sírany se připravují neutralizací, působením kyseliny sírové na kovy, jejich oxidy nebo uhličitany. Lze použít i oxidace sulfidů nebo siřičitanů. Většina síranů je ve vodě dobře rozpustná, málo rozpustné jsou sírany kovů alkalických zemin. Hydrogensírany v pevném stavu jsou známy pouze u alkalických kovů a připravují se reakcí kyseliny sírové s hydroxidy, sírany nebo chloridy těchto kovů. Jejich termickou kondenzací vznikají disírany MI2S2O7

Atomy síry jsou v disíranovém aniontu spojeny kyslíkovým můstkem O3SOSO32−. Disíran draselný K2S2O7 se používá k rozkladu těžce rozpustných oxidů, které se tavením s ním převedou na rozpustné sírany. Anion hydrogensíranový HSO4− se chová jako středně silná kyselina (pKa < 2). Izolovat je možno i trisírany MI2S3O10.
Halogenoderiváty kyseliny sírové jsou kyseliny halogenosírové HSO3X a halogenidy sulfurylu SO2 X2. Větší význam mají pouze fluoro- a chloroderiváty. Kyseliny fluorosírová HSO3F a chlorosírová HSO3Cl se připravují reakcí oxidu sírového s příslušným halogenovodíkem. S vodou reaguje kyselina chlorosírová až explozívně, zatímco kyselina fluorosírová jen zvolna. Směs kyseliny fluorosírové s fluoridem antimoničným a oxidem sírovým patří mezi nejsilnější známé kyseliny (superacidní prostředí). Kyselina chlorosírová se využívá se jako chlorační činidlo při organických syntézách a jako dýmotvorná látka.
Chlorid sulfurylu SO2 Cl2 se připravuje z oxidu siřičitého a chloru (za katalýzy aktivním uhlím) nebo termickým rozkladem kyseliny chlorosírové
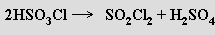
Jeho fluorací nebo přímou reakcí fluoru s oxidem siřičitým lze získat nepříliš reaktivní fluorid sulfurylu SO2F2. Vodou je chlorid sulfurylu, na rozdíl od fluoridu sulfurylu, snadno hydrolyzován, na vlhkém vzduchu dýmá. Používá se jako průmyslové chlorační činidlo. Známy jsou i dihalogenidy oligosírových kyselin.
Kyselina thiosírová H2S2O3 je stálá jen za velmi nízkých teplot (je znám i adukt H2S.SO3, který je jejím izomerem). Připravuje se reakcí
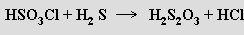
Tvoří poměrně stálé soli MI2S2O3, které se získávají oxidací polysulfidů vzdušným kyslíkem
zaváděním sulfánu a oxidu siřičitého ve vhodném poměru do roztoku alkalických hydroxidů

nebo zahříváním suspenze síry v roztoku siřičitanu
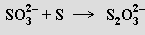
Působením kyselin se thiosírany rozkládají za uvolnění elementární síry
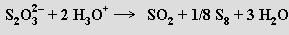
Silná oxidační činidla je převádějí na sírany
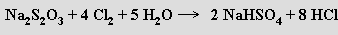
slabší na tetrathionany M2S4O6

První z těchto reakcí přisoudila thiosíranu sodnému název antichlor, druhá je základem jodometrie, důležité metody odměrné analýzy. Thiosíran sodný se používá ve fotografii jako ustalovač, protože tvorbou rozpustného bis(thiosulfáto)stříbrnanu sodného umožňuje odstranit z fotografické emulze nezreagovaný bromid stříbrný

Kyseliny polythionové mají obecný vzorec H2SnO6. Manganatá nebo železnatá sůl kyseliny dithionové se získá zaváděním oxidu siřičitého do suspenze oxidu manganičitého nebo železitého, ostatní soli lze získat podvojnými záměnami. Dithionany jsou dobře rozpustné ve vodě, odolávají oxidaci i redukci. Kyseliny tri- až hexathionová jsou součástí Wackenroderova roztoku vznikajícího zaváděním sulfánu do roztoku oxidu siřičitého. Při zahušťování roztoku dochází k jejich rozkladu na oxid siřičitý, kyselinu sírovou a síru. Soli těchto kyselin jsou podstatně stálejší a lze je připravit oxidací thiosíranů za vhodně zvolených podmínek (peroxidem vodíku lze za chlazení oxidovat thiosíran sodný na trithionan, oxidací jodem vzniká tetrathionan, pentathionan se obvykle získává z Wackenroderova roztoku přidáním octanu a působením dusitanů na thiosíran draselný v silně ochlazené koncentrované kyselině chlorovodíkové se tvoří hexathionan).
Kyselina peroxosírová H2SO5 (N. Caro, 1898) je pevná krystalická látka (b. t. 45 °C). Chová se jako silná jednosytná kyselina (soli M2SO5 nejsou známy) působící i jako razantní oxidační činidlo. Připravuje se parciální hydrolýzou kyseliny peroxodisírové nebo reakcí peroxidu vodíku s kyselinou sírovou nebo chlorosírovou
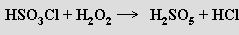
Její hydrogensoli MHSO5 s aniontem SO3(OOH)− nejsou příliš stálé.
Kyselina peroxodisírová H2S2O8 je hygroskopická pevná látka s inkongruentním bodem tání 65 °C, v jejíž molekule jsou atomy síry spojeny peroxidickým můstkem (HO3SOOSO3H). Je silným oxidovadlem převádějícím soli manganaté až na manganistany

Dříve technicky používaná reakce pro přípravu peroxidu vodíku je založena na jejím rozkladu vodou

Připravuje se elektrolýzou koncentrované kyseliny sírové za chladu
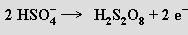
nebo reakcí kyseliny chlorosírové s kyselinou peroxosírovou
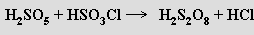
Je silnou dvojsytnou kyselinou poskytující soli MI2S2O8. Volná kyselina i peroxodisírany (připravují se anodickou oxidací síranů) jsou velmi dobře rozpustné ve vodě. Soli se používají jako oxidační a bělicí činidla.
Vazba S-N je velmi pevná, a existuje proto mnoho rozmanitých dusíkosírových sloučenin, které ji obsahují. K dobře charakterizovaným sloučeninám tohoto typu patří tetranitrid tetrasíry S4N4 s neobvyklou klecovitou strukturou s atomy dusíku uspořádanými do čtverce a bisfenoidem čtyř atomů síry. Ve struktuře se uplatňuje vazebná interakce mezi dvěma dvojicemi atomů síry. S4N4 tvoří oranžové, nárazem nebo zahřátím explodující krystaly, které jsou ve vodě nerozpustné, v řadě organických rozpouštědel naopak dobře rozpustné. Hydroxidy alkalických kovů se rozkládá za tvorby oxokyselin síry a amoniaku. Byly připraveny i další nitridy síry o složení S4N2, S2 N2, (SN)4, S5N6 a S11N2, v jejichž molekulách se uplatňují zcela rozdílné strukturní motivy. Největší pozornost byla věnována studiu lineárního polymeru (SN)∞, který se při teplotě 0,26 K chová jako supravodivý kov. Existuje i řada nabitých částic (kationtů i aniontů) obsahující pouze síru a dusík (za nejstabilnější je považován cyklický kation S4N3+). Thioanaloga dusitanů a dusičnanů známa nejsou.
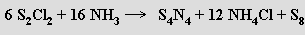
|
Struktura S4N4
|
Struktura As4S4
|
Náhradou atomu síry v cyklo-S8 skupinou NH vznikají imidy síry Sn(NH)8-n (připravují se z dichlordisulfánu a amoniaku v polárních organických rozpouštědlech).
Mezi důležité SN-sloučeniny obsahující halogen patří halogenidy thiazylu N≡S–X (X = F, Cl) známé i ve formě cyklických oligomerů (NSX)n (n = 3, 4 pro F, n = 3 pro Cl), jejichž oxidací lze dospět k rovněž cyklickým halogenooxoderivátům (sulfanurhalogenidům) (NSXO)3. Trojnou vazbu S≡N obsahuje trifluorid thiazylu NSF3. Je známa řada ternárních sloučenin obsahujících vedle síry a dusíku také kyslík. Molekuly některých z nich jsou řetězovité (S3N2O2), jiných (S3N2O5, S4N4O2) cyklické.
Do skupiny dusíkosírových sloučenin patří také amido-, imido- a nitridoderiváty kyseliny sírové a od ní odvozených izopolykyselin. Jsou také známy deriváty hydrazinu a hydroxylaminu obsahující skupinu -SO3H. Většinou jsou to bezbarvé krystalické látky se zřetelně kyselými vlastnostmi. Připravují se působením SO3 (olea), SO2Cl2, H2SO4 nebo HSO3Cl na amoniak nebo močovinu. Vodou se rozkládají na NH4+ a HSO4−.
Kyselina amidosírová HSO3NH2 (v pevném stavu vystihuje její strukturu přesněji vzorec H3N.SO3) je průmyslově vyráběna z močoviny v tisícitunových množstvích
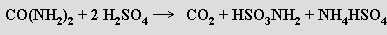
Volná kyselina i její soli mají různorodé praktické využití (detergenty, herbicidy, stabilizátor chlorové vody). Kyselina imido-bis(sírová) HN(SO3H)2 je známa jen v roztoku a její amonnou sůl lze připravit z močoviny a kyseliny sírové
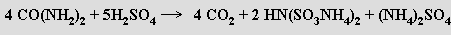
Soli nepříliš stálé kyseliny nitrido-tris(sírové) N(SO3H)3 jsou poměrně stabilní v alkalickém prostředí. V kyselých roztocích se postupně rozkládají až na kyselinu amidosírovou. Připravují se reakcí dusitanů s hydrogensiřičitany
Cyklické polykationty síry vznikají při rozpouštění elementární síry v oleu a jejich tvorba se projeví žlutým, modrým nebo červeným zbarvením vzniklého roztoku. Jejich soli s rozměrnějšími anionty se podařilo připravit ve formě monokrystalů a rentgenograficky stanovit jejich strukturu. Žlutý kation S42+ je čtvercově planární, tmavě modrý S82+ tvoří zvlněný kruh. V červených roztocích byl původně předpokládán kation S162+ a teprve strukturní analýza soli s aniontem [AsF6]− překvapivě ukázala, že se jedná o S192+, v němž jsou dva sedmičetné kruhy spojeny pětičlenným řetězem atomů S.
V komplexech se velmi často ve funkci ligandu s pestrými možnostmi koordinace setkáváme s aniontem disulfidovým S22−, polysulfidy často tvoří chelátové kruhy. Anion tris(pentasulfido)platičitanový [Pt(S5)3]2− se třemi pětičlennými cyklickými dvojfunkčními ligandy (připraven 1903, struktura 1969) je vzácným příkladem čistě anorganické opticky aktivní molekuly. Sulfán se od vody schopností tvořit komplexy významně liší a jednoduché adukty ekvivalentní aquakomplexům jsou málo početné (v důsledku snadné oxidace a deprotonizace sulfánu). Síra může své donorické vlastnosti uplatnit i v řadě ligandů obsahujících kromě ní i jiné prvky s donorickými vlastnostmi (thiokyanatany SCN−, dithiouhličitany OCS22−, thiokarbamáty R2NCS−, xantháty ROCS2−).