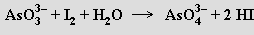
Arsen a bismut mají po jednom stabilním izotopu, antimon dva téměř ekvivalentně zastoupené. 209Bi je nejtěžším stabilním nuklidem vůbec. Arsen a antimon jsou polokovy s velkým měrným elektrickým odporem. Bismut je typický (nejdiamagnetičtější vůbec) kov podobný cínu a olovu.
Arsen existuje v několika alotropních modifikacích. Nejstálejší z nich je ocelově šedá, křehká, (rhomboedrická) α-forma s vrstevnatou strukturou. Za normálního tlaku sublimuje (615 °C), taví se jen pod tlakem (816 °C při 3,91 MPa). Žluté páry arsenu jsou tvořeny molekulami As4 (strukturně ekvivalentními molekulám P4), které nad 800 °C přecházejí na biatomické částice As2 stálé až do 1700 °C. Rychlým ochlazením par vzniká metastabilní žlutá (kubická) modifikace tvořená molekulami As4, která se zahřátím nebo ozářením přeměňuje na α-formu. Antimon je znám v šesti alotropických modifikacích. Jeho α-forma (b. t. 631 °C, b. v. 1587 °C) je strukturně analogická šedému arsenu, žlutý metastabilní alotrop je ještě méně stálý (do -90 °C) než analogická modifikace arsenu. Bismut je křehký kov s nádechem do červena, jeho α-forma (b. t. 271 °C, b. v. 1564 °C) je rovněž strukturním analogem šedého arsenu. Při tání bismutu anomálně vzrůstá (dvojnásobně) elektrická vodivost, zřejmě v souvislosti se změnou charakteru vazebné interakce z kovalentní na kovovou. Molekuly Bi2 jsou stálé až do 2000 °C.
V předposlední vrstvě mají všechny tři prvky po 18 elektronech, struktura valenční vrstvy je analogická jako u dusíku a fosforu. Maximální kladné oxidační číslo +V uplatňují pouze vůči kyslíku, fluoru a chloru. Tvorba aniontů M3− je energeticky nevýhodná, poměrně vysoké ionizační energie (8,0 až 9,8 eV) neumožňují vznik jednoduchých kationtů. Vazby ve sloučeninách arsenu, antimonu a bismutu mají proto převážně kovalentní charakter a obecně nejsou příliš polární s výjimkou vazeb s fluorem a kyslíkem. Koordinační čísla se pohybují v intervalu nula až šest (známa jsou i 10 a 12). S růstem atomové hmotnosti klesá tendence prvků k tvorbě π-vazeb a vzhledem k jejich nízké elektronegativitě nemá žádný z nich schopnost podílet se na tvorbě vodíkových můstků.
Arsen, antimon i bismut mají amfoterní vlastnosti a jejich chemické chování je na rozhraní mezi kovy a nekovy. Stabilita jejich hydridů klesá od arsenu k bismutu. Arsen se dikyslíkem pomalu oxiduje už za laboratorní teploty, antimon a bismut jsou za těchto podmínek stálé. Spalováním na vzduchu poskytují všechny tři prvky oxidy MIII2O3, v případě arsenu a antimonu je reakční produkt znečištěn i vyššími oxidy (As2O5 resp. Sb2O4 a Sb2O5). Všechny tři prvky mají pozitivnější standardní oxidačně-redukční potenciály než vodík a ve vodě ani zředěných kyselinách se proto nerozpouštějí (rozpustit je lze v oxidujících kyselinách). Přímo se slučují s halogeny, chalkogeny a s některými elektropozitivnějšími kovy.
Oxidy arsenu a antimonu jsou kyselinotvorné, oxid bismutitý je již zřetelně bazický. Zajímavá je podobnost chemie bismutu a lanthanu (analogická krystalová struktura oxid-chloridů, izomorfie síranů a podvojných dusičnanů) daná blízkými hodnotami jejich iontových poloměrů. Arsenidy, antimonidy a bismutidy kovů mají charakter intermetalických sloučenin (jsou mezi nimi důležité polovodiče s MIII (M = Al, Ga, In, Tl)). Schopnost tvorby stabilních solí oxokyselin roste v řadě As << Sb < Bi (malá bazicita AsIII umožňuje očekávat existenci sloučenin typu As2(SO4)3 pouze v superacidních prostředích). Soli arsenité a antimonité jsou ve vodném roztoku silně hydrolyzoványm soli antimonité a bismutité lze izolovat z roztoků v koncentrovaných kyselinách (zředění roztoků vede ke srážení zásaditých solí). Sloučeniny arseničné jsou v kyselém prostředí silnými oxidačními činidly, v neutrálních a zásaditých roztocích jsou soli arsenité a antimonité dobrými redukovadly, v kyselém prostředí je oxidují jen silná oxidovadla
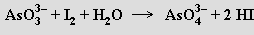
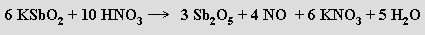
Stabilita organoprvkových sloučenin klesá v řadě As > Sb > Bi, koordinační čísla se v nich pohybují mezi dvěma a šesti.
Arsen se vyrábí pražením arsenopyritu bez přístupu vzduchu
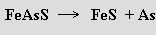
Antimon se získává tavením antimonitu se železem
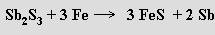
nebo jeho pražením na vzduchu a redukcí vzniklého oxidu antimonitoantimoničného uhlíkem
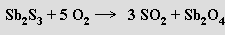
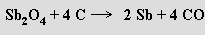
Podobně se vyrábí i bismut z bismutinu.
Arsen se používá jako přísada do olova při výrobě střeliva, antimon ve slitinách s cínem a olovem (ložiskový kov, liteřina, desky olověných akumulátorů) a bismut je součástí lehkotavitelných slitin (Woodův kov o složení Bi:Pb:Sn:Cd 4:2:1:1 má b. t. 70 °C) používaných v protipožárních zařízeních a signálních přístrojích. Oxid bismutitý je součástí optických skel s vysokým indexem lomu, některé další sloučeniny bismutu jsou používány při výrobě kosmetických a lékařských přípravků.