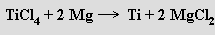
Titan je sedmým nejrozšířenějším kovem v zemské kůře (0,63 %; po hliníku, železu, vápníku, sodíku, draslíku a hořčíku). V malých množstvích je přitomen téměř ve všech typech nerostů, jeho běžnými minerály jsou rutil TiO2 a ilmenit FeTiO3. Nejdůležitějšími minerály zirkonia (162 ppm) jsou zirkon ZrSiO4 a baddeleyit ZrO2, hafnium (2,8 ppm)je v nich pří měsí (0,1-7 %, průměrně 2 %). Počet přírodních izotopů všech tří provků je pět až šest, některé z nich jsou radioaktivní s extrémně dlouhými poločasy rozpadu (96Zr, 2,76 %, τ½; = 4.1017 let).
Titan, zirkonium i hafnium jsou stříbrolesklé kovy (za laboratorní teploty krystalují v hexagonálních, při teplotách nad 900 °C v kubických prostorově centrovaných mřížkách) s lepší tepelnou a elektrickou vodivostí než prvky 3. skupiny. Jejich mechanické vlastnosti (zvyšuje se křehkost) významně ovlivňuje obsah malých množství kyslíku, dusíku nebo uhlíku.
Nejvyšší kladný oxidační stupeň prvků 4. skupiny je +IV. Možnost existence iontů M4+ nelze ovšem z energetických důvodů předpokládat a vazby ve sloučeninách všech tří prvků jsou proto více či méně polárními kovalentními vazbami. V důsledku menších ionizačních energií a většího objemu hypotetických iontů Zr4+ a Hf4+ jsou vazby těchto prvků polárnější než odpovídající vazby titanu, co6 se projevuje významnými rozdíly ve vlastnostech analogických sloučenin (chlorid titaničitý je těkavá kapalina snadno hydrolyzující až na oxid titaničitý, chloridy zirkoničitý a hafničitý jsou pevné látky, které ve vodě jen částečně hydrolyzují na oxidchloridy MOCl2). Lanthanoidovou kontrakcí daná podobnost iontových poloměrů zirkonia a hafnia způsobuje blízkou příbuznost jejich sloučenin, jejichž rozlišení a dělení je velmi obtížné.
Sloučeniny titaničité jsou podobné sloučeninám prvků 14. skupiny v témže oxidačním stavu (bílé oxidy titaničitý a cíničitý mají podobnou krystalovou strukturu a jsou ve vodě a zředěných kyselinách nerozpustné, chloridy titaničitý, křemičitý, germaničitý a cíničitý jsou bezbarvé, na vlhkém vzduchu, v důsledku hydrolýzy na dioxidy MO2 dýmající kapaliny s tetraedrickou strukturou molekul). V nižších oxidačních stupních se taková podobnost neprojevuje vzhledem k odlišným elektronovým strukturám. V bezbarvých a diamagnetických sloučeninách titaničitých preferuje titan nejčastěji tetraedrickou koordinaci, možné je i oktaedrické uspořádání ([TiCl6]2−). Pro zirkonium a hafnium jsou v oxidačním stavu +IV typická vyšší koordinační čísla šest až osm (Li2[ZrF6], Na3[ZrF7], K4 [Zr(C2O4)4]).
V paramagnetických, obvykle barevných (modrofialové, zelené) sloučeninách titanitých se převážně uplatňuje oktaedrická koordinace kovu. Nejdůležitějšími z nich jsou barevné krystalické halogenidy TiX3, které jsou ve vodném roztoku stálé pouze bez přítomnosti kyslíku (ve vodě rozpuštěný kyslík oxidují na vodu a přecházejí na sloučeniny titaničité), a uchovávají se proto v inertní atmosféře argonu nebo dusíku. Sloučeniny titanaté, kterých je známo jen málo (z halogenidů titanatých není znám TiF2), nejsou ve vodném roztoku schopny existence a okamžitě se oxidují na sloučeniny titanité a vyvíjí se vodík. Nízké oxidační stupně titanu (0, -I, -II) jsou schopny stabilizovat pouze π-akceptorové ligandy.
Reaktivita všech tří kovů je závislá na charakteru jejich povrchu (jemně práškovité kovy jsou pyroforické, kompaktní a vysoce vyleštěné nereagují s kyselinami; termodynamicky možná reakce rozkladu vody titanem za laboratorní teploty prakticky neprobíhá), při zvýšené teplotě se slučují s většinou nekovů. Titan s kyslíkem poskytuje podle reakčních podmínek řadu oxidů o složení Ti6 O až TiO2 (v oxidech bohatých titanem existují vazby kov-kov), s vodíkem tvoří hydridy (TiH, TiH2), s dusíkem, uhlíkem a borem (při ≈800 °C) intersticiální nitridy (Ti2N, TiN), karbidy (TiC, TiC2) a boridy (Ti2 B, TiB, TiB2). Většinou jde o tvrdé žáruvzdorné materiály s kovovou vodivostí.
Problémy při přípravě titanu způsobuje jeho velká afinita vůči uhlíku, kyslíku, vodíku a dusíku při vysokých teplotách. Nejčastěji se vyrábí Krollovým procesem, při němž se ilmenit nebo rutil zahřívá s uhlíkem v proudu chloru a vzniklý chlorid titaničitý se redukuje sodíkem nebo hořčíkem (≈ 900 °C) v argonové atmosféře
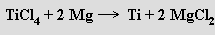
Kov se tak získá jako porézní pevná látka (reakční teplota je pod jeho bodem tání), která se zbaví hořčíku a chloridu hořečnatého postupným vyluhováním vodou, kyselinou chlorovodíkovou a lučavkou královskou. Méně se využívá redukce oxidu titaničitého hydridem vápenatým (900 °C)

nebo chloridu titaničitého vodíkem (2000 °C)
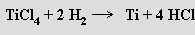
V obou případech se ze získaného kovu obtížně odstraňuje vodík. Rafinace titanu se provádí van Arkel - de Boerovou metodou (převedením na jodid titaničitý a následným rozkladem par této látky při 1300 °C). Zirkonium a hafnium lze připravit v principu stejnými metodami jako titan.
Titan se pro svou chemickou odolnost, nízkou měrnou hmotnost, vysoký bod tání, kujnost, vysokou pevnost a tvrdost používá jako konstrukční materiál v letectví, raketové technice a chemickém průmyslu. V hutnictví oceli se titan využívá k odstraňování kyslíku a dusíku. Zirkonium a hafnium nachází omezené uplatnění při konstrukci chemických zařízení a jaderných reaktorů (zirkonium absorbuje neutrony málo, hafnium ≈ 600× více).