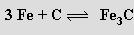
Železo rozpouští značné množství vodíku, ale definované sloučeniny s ním netvoří, stejně jako kobalt a nikl. Karbid železa Fe3C (cementit) vznikající rozpouštěním uhlíku v roztaveném železe
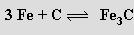
je významnou složkou ocelí. Karbidy se stejnou stechiometrií tvoří i kobalt a nikl (u železa a kobaltu jsou známy i karbidy o složení M2C).
Oxid železnatý FeO (se strukturou chloridu sodného) vzniká termickým rozkladem šťavelanu železnatého za nepřístupu vzduchu jako černý pyroforický prášek. Při pomalém ochlazování disproporcionuje, při rychlém nikoliv

Jeho stechiometrické složení kolísá v rozmezí 0,815:1 až 0,946:1 při zachování krystalové struktury. Nejlépe ho popisuje vzorec FeII1-3xFeIIIO. Zelené oxidy kobaltnatý CoO a nikelnatý NiO mají rovněž složení odpovídající vzorci MII1-3xMIIIIIIO a lze je připravit termickou dehydratací hydroxidů. Působením silných oxidačních činidel na ně vznikají nestálé hydratované dioxidy MIVO2.xH2O (M = = Co, Ni), které se termicky rozkládají za vzniku Co3O4 resp. NiO.
Oxid železitý Fe2O3 tvoří několik polymorfních modifikací. α-Fe2O3 (hematit) vzniká termickým rozkladem (200 °C) hydratovaného oxidu, dusičnanu nebo síranu železitého (krystaluje v hexagonální soustavě a je izomorfní s korundem, železo obsazuje 2/3 oktaedrických mezer v mřížce oxidových aniontů). Metastabilní ferrimagnetický γ-Fe2O3 vzniká opatrnou oxidací Fe3O4 (železo obsazuje část oktaedrických i tetraedrických mezer). Zahříváním ve vakuu přechází na Fe3O4, je-li přítomen vzduch, mění se na hematit. Je nejčastěji používaným materiálem na výrobu magnetických záznamových pásků. Existence oxidů M2O3 u kobaltu a niklu nebyla potvrzena.
Oxid železnatoželezitý Fe3O4 (magnetit), který vzniká žíháním FeO i Fe2O3, má strukturu inverzního spinelu (FeII v oktaedrických, polovina FeIII v oktaedrických a druhá polovina v tetraedrických dutinách oxidové mřížky). Strukturu normálních nebo inverzních spinelů mají i podvojné oxidy MIIFeIII2O4 (ferrity, M = Mg, Zn, Ni, Co) a MIII3Fe5O12 (granáty). Ferrity nacházejí použití v elektrotechnice (jádra vysokofrekvenčních transformátorů, paměťové prvky počítačů), z granátů se Y3Fe5O12 (označovaný zkratkou YIG odvozenou z anglického názvu yttrium iron garnet) používá jako mikrovlnný filtr v radarech.
Sulfid železnatý FeS vzniká jako černá sraženina reakcí roztoků železnaté soli a sulfidu amonného. Jeho rozklad minerálními kyselinami se používá k laboratorní přípravě sulfánu. Disulfid železnatý FeS2 (pyrit, markazit) slouží jako surovina při výrobě kyseliny sírové (nikoliv železa). Sulfid železitý Fe2S3 není za běžných podmínek schopen existence. Sulfidy kobaltnatý CoS a nikelnatý NiS vznikají srážením roztoků solí kobaltnatých resp. nikelnatých roztokem sulfidu amonného. Jsou známy i disulfidy MS2 typu pyritu, sulfidy M3S4 se strukturou spinelu a řada kovových fází o složení M1-xS.
Halogenidy železnaté FeX2 vznikají vedením par halogenovodíků přes zahřáté železo (pouze FeI2 se připravuje reakcí prvků) a ve vodě jsou dobře rozpustné. Byly připraveny i kompletní řady halogenidů kobaltnatých CoX2 a nikelnatých NiX2 (popsány byly i halogenid-hydroxidy obou prvků). Zbarvení halogenidů kobaltnatých se mění od růžové (fluorid) přes modrou (chlorid), zelenou (bromid) až po šedozelenou (jodid). Možnosti sledovat stupeň hydratace hygroskopického chloridu kobaltnatého na základě jeho zbarvení (bezvodý je modrý, hemi- a monohydrát tmavofialové, dihydrát růžově fialový, tetrahydrát červený a hexahydrát jasně růžový) se využívá k indikaci stupně hydratace silikagelu používaného jako sušidlo.
Bezvodé halogenidy železité FeX3 (X = F, Cl, Br) se získávají reakcí prvků za zvýšené teploty. Fluorid železitý FeF3 je ve vodě málo rozpustný, chlorid FeCl3 a bromid železitý FeBr3 velmi dobře. Z vodných roztoků všechny krystalují jako hydráty. Chlorid železitý FeCl3 sublimuje (při ≈ 300 °C) a v parách existuje ve formě dimerních molekul. Rozpouštěním železa v kyselině chlorovodíkové za přítomnosti chloru a následnou krystalizací vzniká jeho hexahydrát, který nelze termicky dehydratovat na bezvodou sůl. Jodid železitý FeI3 není znám. Jediným známým halogenidem CoIII je fluorid kobaltitý CoF3 vznikající působením fluoru (250 °C) na chlorid kobaltnatý.
Bílá sraženina hydroxidu železnatého Fe(OH)2 vzniká působením alkalických hydroxidů na roztoky železnatých solí. Je slabě amfoterní (s koncentrovanými hydroxidy alkalických kovů tvoří tetrahydroxoželeznatany M[Fe(OH)4]) a snadno se oxiduje vzdušným kyslíkem. Hydroxid kobaltnatý Co(OH)2 (modrý, delším stáním se jeho barva mění na růžovou) je amfoterní, hydroxid nikelnatý Ni(OH)2 (jasně zelený) nikoliv. Oba lze získat srážením vodných roztoků kobaltnatých resp. nikelnatých solí hydroxidy alkalických kovů.
Z roztoků obsahujících kationty hexaaquaželezité [Fe(H2O)6]3+ se hydroxidy alkalických kovů sráží hydrát oxidu železitého Fe2O3.xH2O, který je snadno rozpustný v kyselinách. V horkých roztocích hydroxidů se rozpouští za tvorby železitanů, které lze připravit i tavením obou komponent.
Z železnatých solí oxokyselin jsou nejznámější heptahydrát síranu železnatého (zelená skalice) FeSO4.7H2O, bezbarvý bezvodý síran železnatý FeSO4 a hexahydrát síranu ammonoželeznatého (NH4)2Fe(SO4)2.6H2O (Mohrova sůl), která je vůči oxidaci vzdušným kyslíkem nejstálejší železnatou solí. Heptahydráty síranů kobaltnatého CoSO4.7H2O a nikelnatého NiSO4.7H2O jsou nazývány kobaltnatou resp. nikelnatou skalice. Nestálý dusičnan železnatý Fe(NO3)2 vzniká při rozpouštění železa ve studené zředěné kyselině dusičné
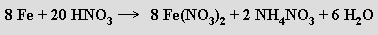
Stejně se připravuje i hexahydrát dusičnanu kobaltnatého Co(NO3)2,který se zahříváním nejprve dehydratuje a potom se rozkládá na oxidy dusíku a kobaltu. Uhličitan železnatý FeCO3 se rozpouští ve vodě obsahující oxid uhličitý za vzniku hydrogenuhličitanu železnatého Fe(HCO3)2 (v této formě je železo přítomno v minerálních vodách). Uhličitan kobaltnatý CoCO3 a hydratovaný dihydroxid-uhličitan kobaltnatý Co(OH)2.CoCO3.xH2O jsou vhodnými surovinami pro přípravu rozpustných solí kobaltnatých.
Světle fialový kationt hexaaquaželezitý [Fe(H2O)6]3+je v roztoku stálý pouze v silně kyselém prostředí (pH ≈ 0). Již malým zvýšením pH dochází k jeho hydrolýze za tvorby [Fe(H2O)5(OH)]2+, [Fe(H2O)4(OH)2]+ a [Fe2 (H2O)8(µ-OH)2]4+. Při dalším zvýšení pH (na 2 až 3) dochází k rozsáhlejší kondenzaci za tvorby koloidního gelu, z něhož se nakonec se vyloučí hydratovaný oxid železitý.
Dusičnan železitý Fe(NO3)3 (krystaluje jako hexa- nebo nonahydrát) se získává analogicky jako Fe(NO3)2, potřebná je jen malá změna podmínek při rozpouštění (zvýšená teplota nebo vyšší koncentrace HNO3). Dobře rozpustný síran železitý Fe2(SO4)3 lze připravit rozpouštěním oxidu železitého v koncentrované kyselině sírové. Je známo šest jeho hydrátů a rovněž podvojné soli MIFeIII(SO4)2.12H2O (železité kamence). Nepříliš stálý síran kobaltitý Co2(SO4)3.18H2O se připravuje anodickou oxidací síranu kobaltnatého.
Základní strukturní motivem v oxoaniontech železa jsou tetraedry FeO4. Byly připraveny jednoduché (Na5FeIIIO4) i kondenzované (K6FeIII2O6, Na14FeIII6O16) železitany, železičitany (MI4FeIVO4) (vznikají zahříváním oxidu železitého s hydroxidy alkalických kovů v kyslíkové atmosféře) mají charakter směsných oxidů. Nejlépe prostudované železany MI2FeVIO4 lze připravit oxidací železitých sloučenin v silně zásaditém prostředí (nejčastěji v tavenině)
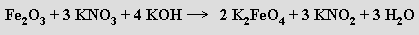
Jsou silnými oxidovadly (silnějšími než manganistany), schopnými oxidovat za laboratorní teploty amoniak na dusík. V kyselém prostředí se rozkládají za vývoje kyslíku, kyselina železová H2FeO4 ani její anhydrid oxid železový FeO3 nejsou známy.
Extrémně stabilní (Kc = 1037) je nízkospinový diamagnetický anion hexakyanoželeznatanový [Fe(CN)6]4− s elektronovou konfigurací železa t62g (v roztoku nelze prokázat ani CN− ani FeII, soli nejsou toxické, kyanid železnatý nelze v čistém stavu připravit). Působením kyseliny chlorovodíkové na vodný roztok (obsahující také diethylether) hexakyanoželeznatanu draselného K4[Fe(CN)6] (žlutá krevní sůl) se vylučuje etherát kyseliny hexakyanoželeznaté H4 [Fe(CN)6], z něhož lze volnou kyselinu snadno získat. Nízkospinový paramagnetický hexakyanoželezitan draselný K3[Fe(CN)6] (červená krevní sůl) je ve vodném roztoku rovněž nepatrně ionizován, ale je vysoce toxický, zřejmě v důsledku oxidačních vlastností FeIII (oxiduje sulfán na síru) v aniontu [Fe(CN)6]3−. Anionty [Fe(CN)6]4− i [Fe(CN)6]3− reagují s některými kationty těžkých kovů za tvorby nerozpustných barevných sraženin. Nerozpustná berlínská (resp. Turnbullova) modř Fe4[FeII(CN)6]3.14-16H2O se tvoří jak z FeIII a K4[Fe(CN)6], tak i z FeII a K3[Fe(CN)6]. Rozpustná berlínská modř má složení KFeIII [FeII(CN)6]. Struktura obou komplexů je složitá (kyanidové anionty ve funkci můstků v ní spojují atomy železa), byly využívány jako pigmenty při výrobě inkoustu a jejich tvorbě na papíře byl založen modrotisk. Voda a zředěné kyseliny s berlínskou modří nereagují, alkalické hydroxidy vylučují z jejího roztoku rezavou sraženinu hydroxidu železitého.
Řada komplexů železitých vzniká náhradou jedné kyanidové skupiny jiným ligandem (NO, NO2, H2O, CO). Nitroprussid sodný Na2[Fe(CN)5(NO)] (tmavočervený) se připravuje působením kyseliny dusičné na Na4[Fe(CN)6] nebo Na3[Fe(CN)6] a používá se ke kvalitativnímu důkaz sulfidů (reakce mění červenohnědou barvu roztoku nitroprussidu na červenofialovou; červené zbarvení poskytují siřičitany a to je umožňuje rozlišit od thiosíranů, které tímto způsobem nereagují).
Obrovský počet a různorodost komplexů kobaltitých ilustruje příklad oxidace roztoku obsahujícího chlorid amonný, amoniak a chlorid kobaltnatý dikyslíkem, z něhož se po okyselení vylučují CoCl3.6NH3 (oranžově žlutý), CoCl3.5NH3 (purpurově červený) a dva izomery CoCl3.4NH3 (zelený a fialový). Ve všech případech jde o oktaedricky koordinovaný CoIII s různým rozložením ligandů ve vnější a vnitřní koordinační sféře (oktaedrická koordinace je pro CoIII typická). V komplexech s vícefunkčními ligandy počet strukturních variant vzrůstá a vedle cis/trans a fac/mer izomerie se uplatňuje i izomerie optická. CoIII tvoří také řadu typů polyjaderných komplexů. Jen o málo méně početné jsou halogeno- i pseudohalogenokomplexy kobaltnaté (K2[CoCl4], (NH4)2[Co(SCN)4]) a hydráty kobaltnatých solí. Pro CoII je typický malý rozdíl ve stabilitě tetraedricky a oktaedricky koordinovaného centrálního atomu, takže se často oba typy vyskytují u téhož ligandu. Za vývoje vodíku reaguje s vodou anion hexakyanokobaltnatanový [Co(CN)6]4−

U komplexů NiII je rozmanitost koordinačních polyedrů nejvýraznější (oktaedr, tetraedr, trigonální bipyramida, čtverec a tetragonální pyramida). Přestože teoreticky přicházejí v úvahu různé typy izomerie včetně optické, v praxi nejsou různé izomerní formy pro nikelnaté komplexy typické.

Kyanid nikelnatý Ni(CN)2 (jablkově zelený) se sráží přídavkem kyanidových iontů k roztoku rozpustné nikelnaté soli. V nadbytku kyanidu se rozpouští na čtvercový komplexní anion tetrakyanonikelnatanový [Ni(CN)4]2−, který při větším nadbytku kyanidových iontů přechází na pentakyanonikelnatan [Ni(CN)5]3− s tetragonálně pyramidální strukturou. Redukcí K2[Ni(CN)4] sodíkovým amalgamem v atmosféře vodíku vzniká komplex K4[NiI2(CN)6], jehož další redukcí alkalickým kovem lze dospět k K4[Ni0(CN)4]. S Čugajevovým činidlem (dimethylglyoxim) vzniká komplex bis-(dimethylglyoximáto)nikelnatý (NiII je v něm čtvercově koordinován čtyřmi atomy dusíku) jako jasně červená, málo rozpustná látka sloužící k důkazu i kvantitativnímu stanovení nikelnatých iontů.
Jednoduché alkyl- a arylderiváty železa nejsou známy, protože σ-vazby Fe-C vyžadují dodatečnou stabilizaci π-vazebnou interakcí s ligandy. Proto z organoželeznatých sloučenin jsou nejvýznamnější karbonylové a cyklopentadienylové komplexy.
Obecně vystihuje složení karbonylových komplexů vzorec Mn(CO)m. Karbonylová skupina může vystupovat jako jedno- až trojfunkční ligand a je považována za prototyp π-akceptorových ligandů, v nichž je donorovým i π-akceptorovým atomem vždy uhlík. Vůči Lewisovým kyselinám typu fluoridu boritého je slabým σ-donorem, ale s kovy ze středu přechodných řad (vanad, kovy 6. až 9. skupiny a nikl), které mají k dispozici d-elektrony pro tvorbu π-vazeb, tvoří velmi pevné neutrální komplexy s homogenní koordinační sférou. Jednoduché binární karbonyly s tetraedrickým, trigonálně-bipyramidálním nebo oktaedrickým uspořádáním se tvoří s kovy majícími k dispozici sudý počet valenčních elektronů (chrom, molybden, wolfram, železo, ruthenium, osmium, nikl). Tvorba klastrů s vazbami kov-kov je možná bez ohledu na počet valenčních elektronů. Známo je i mnoho nabitých komplexních částic a komplexů s nehomogenní koordinační sférou.
|
|
|
|
|
|
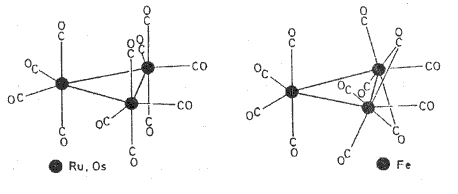

S výjimkou [V(CO)6] jsou všechny karbonyly včetně vícejaderných diamagnetické. Obvykle jsou to snadno zápalné kapalné nebo tuhé látky dobře rozpustné v nepolárních rozpouštědlech. Většina z nich je na vzduchu stálá (s výjimkou karbonylů vanadu a kobaltu), v nepřítomnosti kyslíku je lze destilovat nebo sublimovat. Vysoce toxické karbonyly niklu [Ni(CO)4] a železa [Fe(CO)5] tvoří se vzduchem výbušné směsi. Karbonyly se připravují reakcí jemně práškových kovů, jejich halogenidů, sulfidů nebo oxidů s oxidem uhelnatým za zvýšeného tlaku. Vznikají také při disproporcionačních reakcích, fotochemickými přeměnami jednoduchých karbonylů na vícejaderné i při reakcích Grignardových činidel. Podléhají řadě typů chemických přeměn a uplatňují se i v technologických procesech při přípravě vysoce čistých kovů (železo, nikl).
Pentakarbonyl železa [Fe(CO)5] (1891) s trigonálně bipyramidální strukturou se tvoří reakcí zahřátého kovu s oxidem uhelnatým. Působením UV záření na jeho roztok v organickém rozpouštědle vzniká [Fe2(CO)9], jehož molekula je složena ze dvou oktaedrů sdílejících společnou stěnu. Diamagnetismus této látky prokazuje, že mimo třemi můstkovými karbonylovými skupinami jsou oba atomy železa vázány i přímou vazbou kov-kov. Trojjaderný komplex [Fe3(CO)12] vzniká oxidací aniontu [FeH(CO)4]−. Kobalt tvoří tři karbonyly ([Co2(CO)8], [Co4(CO)12] a [Co6(CO)16]), z nichž nejlépe charakterizovaný [Co2(CO)8] vzniká reakcí oxidu uhelnatého se sulfidem kobaltnatým (200 °C, vysoký tlak; oxid kobaltnatý k tomuto účelu použít nelze) a v praxi se uplatňuje jako katalyzátor (při hydroformylačním procesu). Prvním připraveným karbonylovým komplexem kovu byl ve všech skupenstvích monomerní tetrakarbonyl niklu [Ni(CO)4] (1888, C. Langer), který snadno podléhá oxidaci vzdušným kyslíkem. V kapalném amoniaku jej lze alkalickými kovy redukovat na amoniakát dimerní ho hydridokarbonylu [NiH(CO)3]2.4NH3, případně až na aniontové klastry [Ni5(CO)12]2− a [Ni6(CO)12]2−). Halogenokarbonylové komplexy ([MX2(CO)4], vznikají působením halogenů na karbonyly nebo naopak oxidu uhelnatého na halogenidy kovů), se podařilo připravit i s kovy, které binární karbonyly netvoří. Hydridokarbonyly a karbonylátové anionty lze připravit i ve vodných roztocích působením hydroxidů alkalických kovů na karbonyly

Struktura komplexu bis(cyklopentadienyl)železnatého (ferrocenu) [Fe(η5-C5H5)2] byla zjištěna již rok po jeho objevu (1951, E. O. Fischer a G. Wilkinson, Nobelova cena 1973). Pro látky tohoto typu byl zaveden název sendvičové komplexy, který dobře vystihuje uložení kovového iontu mezi dvěma vzájemně paralelními cyklickými ligandy. Ferrocen je termicky, na vzduchu i ve vodném roztoku stabilní. Nelze ho přímo nitrovat nebo halogenovat, protože se přitom oxiduje na ferriciniový kationt [FeIII(η5-C5H5)2]+. Snadno podléhá Friedel-Craftsově acylaci a alkylačním reakcím. Ve srovnání s benzenem je u ferrocenu mimořádně snadná elektrofilní substituce, na jejíž první fázi se podílí kovový ion. Jsou známy i sloučeniny obsahující v molekule jak cyklopentadienylové kruhy, tak i karbonylové skupiny. Purpurově zbarvený dimer [Fe(η5-C5H5)(CO)2]2 byl získán reakcí [Fe(CO)5] s dicyklopentadienylem (135 °C, autokláv), prodloužením reakční doby vzniká zelený tetramerní klastr [Fe(η5-C5H5)(CO)]4 obsahující tridentátní karbonylové skupiny. Nestálý kobaltocen [Co(η5-C5 H5)2] (růžový, paramagnetický) se velmi snadno oxiduje na [CoIII(η5-C5H5)2]+. Analogický kationt poskytuje i zelený nikelocen [Ni(η5-C5H5)2], který působením Lewisových kyselin tvoří třívrstvový sendvičový kation [Ni2(η5 -C5H5)3]+.