
Obsah mědi v zemské kůře je 68 ppm, stříbra 0,08 ppm a zlata 0,004 ppm. Zlato je monoizotopické, stříbro a měď mají po dvou izotopech. Měď se nachází převážně ve sloučeninách se sírou (kovelin CuS, chalkosin Cu2S, chalkopyrit CuFeS2) nebo ve formě oxidů a hydroxid-uhličitanů (kuprit Cu2O, malachit CuCO3.Cu(OH)2, azurit 2CuCO3.Cu(OH)2). Stříbro se vyskytuje ryzí i ve sloučeninách (argentit Ag2S, proustit Ag3AsS3, pyrargyrit Ag3SbS3), zlato převážně ryzí a jen výjimečně ve sloučeninách (calaverit AuTe2, sylvanit AgAuTe4). V současné době dosahuje produkce zlata 2300 tun ročně (do roku 1830 to bylo pouze 12 tun ročně, v roce 1890 už 150 tun).
Měď, stříbro a zlato jsou ušlechtilé kovy. Hustoty a body tání i varu mají řádově větší než alkalické kovy i prvky podskupiny zinku. Mají velmi dobrou elektrickou i tepelnou vodivost (zvláště stříbro) a výbornou tažnost a kujnost. Ze zlata je možno vyrobit folie o tloušťce 230 atomů nebo drát o průměru 20 µm a tento prvek lze získat i ve formě červeně, modře nebo fialově zbarvených koloidních roztoků (redukcí silně zředěných roztoků chloridu zlatitého; Cassiův purpur vzniká použitím chloridu cínatého jako redukčního činidla). Všechny tři kovy krystalují v kubických plošně centrovaných mřížkách.
Ve srovnání s alkalickými kovy mají měď, stříbro a zlato menší iontové poloměry, vyšší první a naopak nižší druhé a třetí ionizační energie. Neúplně obsazený systém nd-orbitalů mají pouze jako kationty. Nápadná je vysoká elektronegativita zlata (2,4), která je u kovů nejvyšší vůbec (CsAu se proto chová jako sůl zlatid cesný Cs+Au−, nikoliv jako slitina). Typickými oxidačními stupni jsou AgI, CuII a AuIII, všechny tři prvky se řidčeji vyskytují i ve zbývajících dvou oxidačních stavech mezi I a III (zlato i jako AuV). V roztocích jsou z kationtů MI schopny existence pouze ionty stříbrné Ag+, CuI a AuI pouze ve formě komplexů. Pro sloučeniny měďné jsou typická koordinační čísla dvě (lineární řetězce) a čtyři (tetraedrická koordinace). Vazby ve sloučeninách měďnatých mají převážně kovalentní charakter, uplatňují se σ- i π-vazby. Většina těchto látek je modrá nebo zelená, bezbarvé (bezvodý síran měďnatý) jsou pouze tehdy, posune-li se absorpce spojená s d-d-přechody z viditelné do blízké infračervené oblasti. Při výskytu pásů přenosu náboje (přenos elektronů z ligandů na centrální kovový kation nebo obráceně) ve viditelné oblasti se barva mění na hnědou až červenou. Koordinace kovu může být oktaedrická, čtvercová (limitní případ axiální deformace oktaedru v tetragonální bipyramidu), trigonálně bipyramidální nebo deformovaně tetraedrická. Existují izomery lišící se pouze rozdílnou deformací koordinačního polyedru (tzv. distorzní izomerie). Měďnaté komplexy mohou být para- i diamagnetické (vysvětlení magnetických vlastností je někdy obtížné, protože v dimerních měďnatých komplexech může docházet k párování elektronů i prostřednictvím můstkových ligandů tzv. supervýměnou). Převážně čtvercové komplexy mědité jsou elektronovou analogií nikelnatých. V diamagnetických a bezbarvých sloučeninách stříbrných se uplatňuje iontová i kovalentní vazebná interakce (v dusičnanu, chloristanu a octanu převažuje iontová, v halogenidech kovalentní vazba), tvorba hydrátů je atypická. Vazby ve sloučeninách zlatných i zlatitých jsou převážně kovalentní, koordinační číslo pro AuI je obvykle dvě, pro AuIII čtyři až šest.
Chemická podobnost mědi, stříbra a zlata je malá, reaktivita prvků klesá od mědi ke zlatu. Na rozdíl od stříbra a zlata má měď malou tendenci rozpouštět se ve rtuti na amalgam, všechny tři kovy snadno tvoří intermetalické sloučeniny. S vodíkem měď, stříbro ani zlato přímo nereagují, na vlhkém vzduchu se pouze měď potahuje zelenou vrstvičkou hydroxid-uhličitanu (měděnkou) a při zvýšené teplotě reaguje s kyslíkem. Stříbro a zlato mají ke kyslíku menší afinitu než měď (jejich oxidy jsou proto méně stálé) a nejsnáze reagují s halogeny (i zlato se rozpouští v chlorové vodě a lučavce královské). Tri- a pentahalogenidy (jen AuF5) tvoří pouze zlato a dihalogenidy (s výjimkou AgF2) poskytuje pouze měď. Měď a stříbro (nikoliv zlato) poměrně ochotně reagují se sulfánem

Nejstálejší sulfidy tvoří všechny tři prvky v oxidačním stavu +I.
Výjimečná komplexotvornost mědi, stříbra a zlata se výrazně projevuje v chemii roztoků jejich sloučenin. Měď se rozpouští v roztocích alkalických kyanidů za tvorby dikyanoměďnanů a vývoje vodíku

Zlato reaguje podobně jen v přítomnosti kyslíku
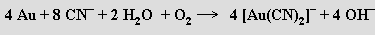
Měďnatých komplexů (především chelátů) je znám obrovský počet, naproti tomu π-komplexy, sendvičové komplexy ani jednoduché alkyl- nebo arylderiváty měďnaté nejsou schopny existence (alkyl- i arylderiváty měďné existují). Z hodnot oxidačně-redukčních potenciálů plyne, že v roztoku převládají hydratované kationty měďnaté a koncentrace hydratovaných iontů měďných musí být nepatrná (pro reakci 2 CuI (aq) ↔ Cu2+ (aq) + Cu je Kc≈ 106 mol-1). Nestálé měďnaté sloučeniny se proto snadno redukují na měďné pouze tehdy, jsou-li vzniklé komplexy CuI stabilní a nerozpustné (typický jev u ligandů s redukčními vlastnostmi jako jsou I−, CN−, SCN−, thiomočovina, fosfan). Komplexy stříbrnaté (paramagnetické látky se silnými oxidačními vlastnostmi) obsahují obvykle dusíkaté ligandy. Charakter komplexů má i převážná většina sloučenin zlata.
Při výrobě mědi se chalkosin pražením na vzduchu částečně převede na oxid měďný

který reakcí se zbývajícím sulfidem měďným poskytne kovovou měď
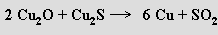
Surový kov se rafinuje elektrochemicky. Na mokré cestě se měď připravuje elektrolýzou extraktů chudých rud kyselinou sírovou. Stříbro se nejčastěji získává z rud obsahujících olovo, které se odstraňuje buď odlučováním (vháněním kyslíku do roztavené slitiny, oxid olovnatý se hromadí na povrchu), přerušovanou krystalizací (pattisonování, první krystaluje olovo) nebo přidáním zinku (parkesování, stříbro se dostane do zinkové vrstvy a zinek se pak odstraní destilací). Jeho zdrojem jsou i anodové kaly vznikající při rafinaci mědi. Pro získávání zlata z rud se využívá vznik amalgamu nebo dikyanozlatného komplexu, z nichž se zlato vyredukuje zinkem

Měď se používá v elektrotechnice a jako katalyzátor, stříbro ve fotografii a spolu se zlatem k výrobě šperků a mincí. Ze zlata se zhotovují dentální náhrady a jeho koloidní roztoky slouží k barvení skla a keramiky. Nejvýznamnější použití mají slitiny mědi - bronz (Cu:Sn ≈ 9:1), mosaz (Cu:Zn ≈ 7:3), konstantan (Cu:Ni:Mn ≈ 59:40:1) a Dewarova slitina (Cu:Al:Zn ≈ 10:9:1).