Periodicita je v anorganické chemii ústřední m principem. Týká se chemických (vazebné schopnosti, oxidační stavy) i fyzikálních (atomové objemy, ionizační energie, hustoty) vlastností prvků.
Současný výklad periodického zákona je umožněn detailní znalostí struktury elektronového obalu atomů. Historicky byly nejprve sledovány periodické změny chemických vlastností (od konce 18. stol.), periodicita fyzikálních vlastností se stala předmětem zájmu až v druhé polovině 19. století.
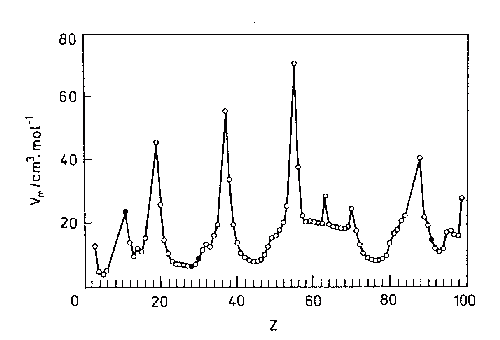
Typickým příkladem je závislost molárních objemů prvků na protonovém čísle. Maximálni hodnoty náležejí alkalickým kovům s jediným elektronem zajišťujícím vazbu k sousedním atomům, v sedlech křivky se nacházejí prvky ze středu period, které mají pro tento účel k dispozici maximální počet elektronů. Anomálie pozorované u europia a ytterbia jsou důsledkem specifiky výstavby elektronových obalů.
Obrácený diagram získáme pro hustoty prvků v pevném stavu.

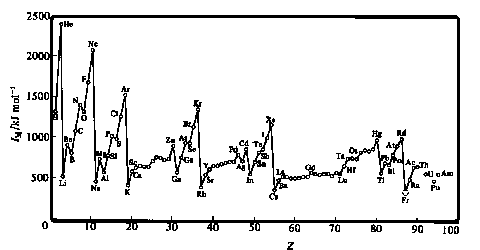
Velmi instruktivní je diagram závislosti prvních ionizačních energií na atomovém čísle, na níž lze dobře sledovat obsazování jednotlivých energetických hladin a podhladin charakterizovaných konkrétní kombinací kvantových čísel.
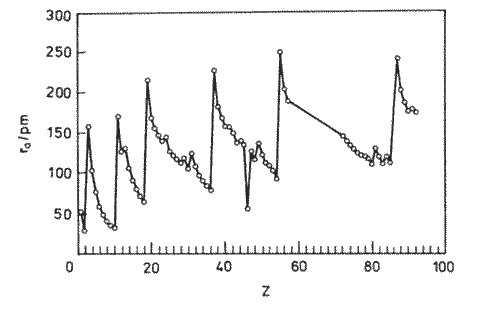
Periodický charakter mají i závislosti dalších fyzikálních konstant prvků (body tání a varu, tepla tání a vypařování, atomizační energie, atomové poloměry, elektronegativity) a periodické trendy se projevují i ve vlastnostech (body tání a varu, slučovací tepla) jednoduchých binárních sloučenin (hydridy, halogenidy, chalkogenidy). Jejich využití k předpovědi vlastností neznámých sloučenin nebo hodnot experimentálně obtížně dostupných konstant může však být ně kdy značně zavádějící (pro disociační energii molekuly F2 dostaneme extrapolací z dat pro ostatní halogeny hodnotu 256 kJ.mol-1, experimentálně stanovená činí 154 kJ.mol-1).
V současnosti je známo více než 700 forem periodické tabulky, ale žádnou z nich nelze považovat za univerzální. Dnes nejběžnější je tzv. dlouhá forma s osmnácti sloupci. Horizontální řádky se nazývají periodami, svislé sloupce grupami (skupinami, podskupinami).
Tabulka se dělí na čtyři bloky – s, p, d a f. Prvky s- a p-bloku se nazývají prvky hlavních grup. Podle svých vlastností se prvky dělí na kovy, polokovy a nekovy. Současná teorie vysvětluje i periodické trendy, které se dříve zdály být anomáliemi:
Příčiny odlšnosti prvků druhé periody (lithium až fluor) od ostatních prvků skupin lze shrnout do tří základních kategorií – jejich atomy jsou malé, valenční elektrony jsou poutány v těsné blízkosti jádra a obtížně se proto ionizují a tyto prvky nemají schopnost tvořit více než čtyři σ-vazby.
Chování prvků následujících za přechodnými kovy ovlivňuje zaplnění d-orbitalů v předposlední vrstvě.
Lanthanoidová kontrakce souvisí s neúplným odstíněním náboje jádra elektrony postupně doplňovanými do f-orbitalů ve vrstvě s hlavním kvantovým číslem o dvě nižším než má valenční sféra. Na valenční elektrony tak působí efektivně větší kladný náboj jádra a výsledkem je postupné zmenšování atomových a iontových poloměrů lanthanoidů s růstem jejich atomového čísla.
Diagonální vztahy mezi nejlehčími prvky v 1., 2., 13. a 14. skupině jsou spojeny s podobnými hodnotami iontových poloměrů příslušných kationtů.
Preferovaný sudý krok změny oxidačních stavů prvků hlavních podskupin je dán obecnou nestabilitou radikálů obsahujících nepárový elektron v s- nebo p-orbitalu valenční sféry. Mepárové elektrony v d-orbitalech přechodných prvků takovou nestabilitu nezpůsobují a variabilita oxidačních stavů je proto u nich větší. Pro prvky lichých skupin periodického systému je typický malý počet stabilních izotopů, prvky v sudých skupinách jich mají obvykle více.