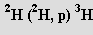
Postupné poznávání vodíku jako prvku v průběhu 16. a 17. století je těsně spjato s přeměnou středověké alchymie v moderní chemii jako exaktní vědní obor. Až do konce 18. století byl tento prvek komplikovaně spojován s pojmem flogistonu. Vznik hořlavého plynu při reakci kyseliny sírové se železem pozoroval už R. Boyle (1671). Plynný vodík identifikoval jako první H. Cavendish (1766), který současně dokázal, že voda je sloučenina vodíku s kyslíkem (počátkem roku 1784 sdělil svůj objev členům anglické Královské chemické společnosti slovy: Je rozumné se domnívat, že deflogistonovaný vzduch je pouze voda zbavená svého flogistonu. a Voda se skládá z deflogistonovaného vzduchu spojeného s flogistonem.). V letech 1810-1815 zjistil H. Davy, že vodík je nezbytnou součásti kyselin. Napravil tak omyl A. L. Lavoisiera, který za takový prvek pokládal kyslík (omyl dal kyslíku dodnes užívané jméno znamenající kyselinu tvořící). S vodíkem souvisela i řada dalších významných mezníků ve vývoje chemie - vznik elektrolytické disociační teorie (S. A. Arrhenius, W. Ostwald, 80. léta 19. století), zavedení pojmu pH (S. P. L. Sörensen, 1909), zjištění významu vazby vodíkovými můstky (1920), formulace Brönstedovy teorie kyselin a zásad (1923) a objev protonové jaderné magnetické rezonance (1H-NMR, 1946).
Vodík je nejrozšířenějším prvkem ve vesmíru (89 %) a třetím (po kyslíku a křemíku) nejrozšířenějším prvkem na Zemi (15,4 % atomů). Uvažuje-li se hmotnostní zastoupení, je s 0,88 % na devátém místě v pořadí, v povrchových horninách je jeho obsah 0,15 % (10. místo). Volný je jen v nepatrném množství. Je významným biogenním prvkem a tvoří více sloučenin, než kterýkoliv jiný prvek včetně uhlíku.
Atom vodíku 1H je nejjednodušším atomem periodického systému tvořený jedním protonem a jedním elektronem. Je prvkem s-bloku, kde spolu s heliem představují jediné dva nekovové prvky. Vedle 1H má dva další izotopy - deuterium 2H resp. D a tritium 3H resp. T. V přírodě je zastoupení deuteria velmi malé (156 ppm) a tritia nepatrné (10-12 ppm). Všechny izotopy vodíku tvoří za běžných podmínek stabilní biatomické molekuly. Celkem je známo přes čtyřicet forem (částic) existence tohoto prvku.
Divodík H2 (b. v. -252,8 °C, b. t. -259,2 °C) je nejlehčím existujícím plynem bez barvy, chuti a zápachu, nerozpustný ve vodě. Biatomické molekuly H2 jsou termicky vysoce stabilní (disociační energie 434,1 kJ.mol -1, při 2000 K je disociováno 0,08 %, při 3000 K 7,85 % a až při 5000 K 95,5 % molekul) a jsou schopny difundovat pevnými porézními materiály. Byly identifikovány (1924) dva jaderné izomery divodíku dané existencí spinu vodíkových jader - ortho- (paralelní spin jader) a para-vodík (opačný spin jader). Rovnovážný poměr obou forem je za normálních podmínek 3:1. Ochlazením lze připravit prakticky čistý para-vodík (99,7 % , proces přeměny katalyticky urychluje aktivní uhlí) , nejvyšší dosažitelný obsah ortho-vodíku je pouze 75 %. Přeměna ortho- na para-formu je exotermická a zkapalněný vodík je proto nutno chladit, aby nedocházelo k jeho ztrátám odpařováním. Pro 99% para-vodík při dokonalé tepelné izolaci již chlazení není nutné.
Dideuterium D2 má o několik stupňů vyšší body tání a varu než divodík, jaderný spin má hodnotu jedna, existuje rovněž v ortho- a para-formě. Za laboratorní teploty je poměr obou forem 2:1 a v blízkosti 0 K existuje výlučně v ortho-formě. V přírodě se vyskytuje v hydrosféře ve formě D2O, která se získává frakční destilací nebo elektrolýzou (1932) mořské vody. H2O se rozkládá snáze než D2O, obohacování charakterizuje separační faktor s = (H/D)(g)/(H/D)(l) závisející na alkalitě prostředí a materiálu elektrod; při s = 5 vyžaduje 10% obohacení těžkou vodou snížení objemu kapalné fáze elektrolýzou 2400×, 99% obohacení 130000×, při s 10 vyžaduje 99% obohacení snížení objemu 22000×.
Radioaktivní ditritium T2 (rozpad na He emisí elektronu, τ1/2 = 12,4 roku) bylo připraveno (1934) jadernou reakcí
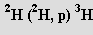
V přírodě se vyskytuje se v horních vrstvách atmosféry, kde vzniká reakcí

Po zahájení pokusných jaderných výbuchů v atmosféře (1954) vzrostla jeho koncentrace v ovzduší 100×, po zákazu takových experimentů se přirozeným rozpadem vrátila na původní úroveň. Molekuly T2 a H2 mají stejný jaderný spin (1/2) a chování jejich jaderných izomerů je proto shodné. Tritium se připravuje v reaktorech reakcí 6Li (n, α) 3H, uchovávat je ho možno jako UT3, z něhož se snadno získá zpět termickým rozkladem. Práce s ním je poměrně bezpečná, protože při rozpadu neemituje záření γ (záření β− zastaví vrstva vzduchu o tloušťce 6 mm nebo vody o síle 6 µm). S čistou T2O nelze běžně pro její vysokou aktivitu způsobující radiolýzu rozpuštěných částic pracovat (běžně se užívá 1% roztok T2O v H2O). Používá se jako sledovač (tracer) při studiu reakčních mechanismů. Substituce vodíku tritiem je snazší než deuteriem pro výrazně rychlejší ustavení rovnováhy. Lze použít přímý styk látky s T2 (g) nebo (cca 1000× účinněji) reakce v roztocích s využitím platiny nebo palladia jako přenašečů vodíku.