Beryllium bylo objeveno v roce 1798, kov získal F. Wöhler (1828), technická příprava beryllia byla uskutečněna až po sto letech (H. Goldschmidt, A. Stock). Beryllium je poměrně vzácným prvkem (2 ppm podobně jako cín, europium nebo arsen), z jeho minerálů má průmyslový význam pouze ostrůvkový křemičitan beryl Be3Al2Si6O18. Ten tvoří povrchová ložiska v pegmatitových horninách (byly nalezeny krystaly o hmotnosti až 60 t), takže beryllium je poměrně snadno dostupné. Ceněna je jeho chromem (2 %) zeleně zbarvená odrůda smaragd.
Beryllium (b. t. 1287 °C, nejvyšší hodnota ve 2. skupině) je tvrdý a křehký kov s malou měrnou hmotností (ρ = 1,85 g.cm-3), který krystaluje v nejtěsnějším hexagonálním uspořádání. Hodnota jeho redoxního potenciálu (-1,82 V) je v absolutní hodnotě značně menší než u ostatních prvků této skupiny (hořčík -2,37 V, ostatní zápornější)
Beryllium preferuje oxidační stav +II v tetraedrické hybridizaci sp3. V beryllnatých solích neexistují (v důsledku poměrně vysokých ionizačních energií, střední hodnoty elektronegativity a velmi malého poloměru hypotetického iontu Be2+) jednoduché ionty Be2+ (v roztocích ani v pevném stavu), nýbrž pouze komplexní částice jedno- ([Be(H2O)4]2+) i vícejaderné. Bezvodé soli beryllnaté mají proto odlišnou strukturu než jejich hydratované formy. Beryllium má (podobně jako bor) sklon k tvorbě elektronově deficitních polycenterních vazeb ((BeH2)n, (Be(CH3)2)n).
Na vzduchu je beryllium stálé (podobně jako hliník), protože se rychle pokrývá vrstvičkou oxidu, která další korozi zabraňuje. Pasivuje se účinkem studené koncentrované kyseliny dusičné. S vodní parou nereaguje kompaktní kov ani za červeného žáru (jemně práškové nebo amalgované beryllium reaguje), s halogeny dochází k reakci až při 600 °C a s chalkogeny, amoniakem a uhlíkem při ještě vyšších teplotách. Nereaguje s divodíkem (hydrid beryllnatý se připravuje nepřímo), rozpouští se ve zředěných silných kyselinách i alkalických hydroxidech a je jediným amfoterním prvkem ve 2. skupině. Beryllium se rozpouští i ve vodném roztoku hydrogendifluoridu amonného za tvorby tetrafluoroberyllnatanu amonného (NH4)2BeF4 a vývoje vodíku
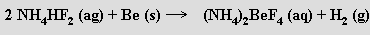
Sloučeniny beryllia jsou jedovaté, velmi nebezpečné jsou ve formě prachu nebo dýmů.
Při výrobě beryllia se beryl nejprve praží s hexafluorokřemičitanem sodným Na2SiF6, z produktu se pak vodou vylouží rozpustný fluorid beryllnatý a z jeho roztoku se vysráží hydroxid beryllnatý při pH 12. Kov se obvykle získává elektrolýzou taveniny chloridu beryllnatého nebo redukcí fluoridu beryllnatého hořčíkem.
Beryllium se používá prakticky pouze ve slitinách, do roztavených kovů se přidává jako antioxidační přísada. Tvrdé a jako oceli elastické (ale nemagnetické) berylliové bronzy jsou slitinami beryllia s mědí. Při zachování chemické odolnosti bronzů (slitin mědi a cínu) je zvláště významná jejich odolnost proti otěru a neelastickému chování (hystereze, tlumení). Kovové beryllium se používá v jaderných reaktorech (moderátor nebo reflektor neutronů) a k výrobě okének rentgenových lamp (pro minimální absorpci rentgenového záření při dostatečné odolnosti vůči korozi).