
Hydrid hořečnatý MgH2 je pevná látka (světle šedá, krystaluje v rutilové mřížce, hořčík v ní má koordinační číslo šest, vodík tři) vznikající za vyššího tlaku přímou reakcí prvků. Předpokládá se v něm přechodný typ vazeb mezi elektronově deficitními a iontovými.
Acetylid hořečnatý MgC2 se připravuje působením acetylenu na hořčík při 500 °C. Vodou se rozkládá na acetylen a hydroxid hořečnatý. Karbid hořečnatý Mg2C3 vzniká při vyšších teplotách působením acetylenu nebo methanu na kov. Reakcí s vodou poskytuje propin (allylen) C3H4.
Borid MgB2 a nitrid hořečnatý Mg3N2 (také sulfid hořečnatý MgS), které vznikají přímou reakcí prvků při vyšších teplotách, jsou pevnými, vodou se rozkládajícími látkami.
Oxid hořečnatý MgO (b. t. 2800 °C, nejvyšší ve 2. skupině) je pevná bílá látka se strukturou chloridu sodného (koordinační číslo hořčíku i kyslíku je šest).

[Zobrazit video]
|
Oxid hořečnatý lze připravit i spalováním hořčíku na vzduchu. Při hoření však vzniká i jisté množství nitridu hořečnatého. |
Efektivní náboje na iontech hořčíku a kyslíku jsou pouze +1 a -1 a vazebné poměry proto nelze popsat v rámci teorie polárních kovalentních vazeb (vysvětlují se obvykle v rámci teorie polarizace iontů), protože hořčík má ve valenční sféře k dispozici pouze čtyři orbitaly s vhodnou energií. Oxid hořečnatý připravený rozkladem jiných sloučenin při nižších teplotách (300-600 °C) je jemný prášek pomalu reagující s vodou za tvorby hydroxidu hořečnatého. Krystalický oxid hořečnatý s vodou nereaguje. S řadou oxidů kovů v oxidačním stupni +III tvoří podvojné oxidy (spinely) MgM2IIIO4. Používá se jako žáruvzdorný vyzdívkový materiál do metalurgických pecí (je výborný vodič tepla a současně dobrý elektrický isolátor). Peroxid hořečnatý MgO2 se strukturou pyritu lze připravit v kapalném amoniaku, ve vodném prostředí vznikají jeho peroxohydráty.
Halogenidy hořečnaté existují v bezvodé i hydratované formě a podobají se halogenidům prvků alkalických zemin. Fluorid hořečnatý MgF2 (se strukturou rutilu) je ve vodě nerozpustný, ostatní halogenidy (mající vrstevnatou strukturou chloridu nebo jodidu kademnatého) jsou ve vodě dobře rozpustné a krystalují z ní jako hydráty (chlorid jako doddeka-, okta-, hexa- nebo tetrahydrát, bromid jako nona-, hexa nebo tetrahydrát a jodid jako deka-, okta- nebo hexahydrát). Sklon k tvorbě fluorokomplexů je u hořčíku menší než u beryllia (v pevném stavu je znám K2MgF4 se strukturou perowskitu, ale v roztoku nejsou anionty [MgF4]2− schopny existence; jde tedy o podvojný fluorid didraselno-hořečnatý a nikoliv o sůl komplexního aniontu). Podvojné soli typů MI2MgX4 a MIMgX3 jsou známy i s ostatními halogenidy. Účinkem vodní páry na chlorid hořečnatý vzniká Mg(OH)Cl s vrstevnatou strukturou (analogickou MgCl2). Smísením práškového oxidu hořečnatého s roztokem chloridu hořečnatého se tvoří Mg2(OH)3Cl.4H2O(tzv. Sorelova maltovina, která tuhne na tvrdou leštitelnou látku a s náplní dřevěných pilin se používá ve stavebnictví pod názvem xylolit).
Slabý neamfoterní hydroxid hořečnatý Mg(OH)2 je bílá, ve vodě nerozpustná látka s vrstevnatou strukturou (typ jodidu kademnatého s koordinačním číslem hořčíku šest). Připravuje se srážením roztoků hořečnatých solí hydroxidy alkalických kovů, v přírodě se nachází jako minerál brucit.

[Zobrazit video]
| Hořící hořčík reaguje s vodní parou za vzniku hydroxidu hořečnatého. |
Uhličitan hořečnatý MgCO3 je znám bezvodý (magnezit) i jako tri- a pentahydrát (existují i hydroxidouhličitany hořečnaté). Hydrogenuhličitan hořečnatý Mg(HCO3)2 existuje, podobně jako hydrogenuhličitan vápenatý, jen ve vodném roztoku v přítomnosti nadbytku oxidu uhličitého. Dusičnan hořečnatý Mg(NO3)2 (krystaluje jako di- nebo nonahydrát) je ve vodě rozpustný, na vzduchu rozplývavý. Z fosforečnanů hořečnatých je analyticky významný nepatrně rozpustný fosforečnan hořečnatoamonný NH4MgPO4.6H2O, který lze termicky převést na difosforečnan hořečnatý Mg2P2O7 (ten je vhodný pro vážkové kvantitativní stanovení hořčíku nebo fosforečnanů). Síran hořečnatý MgSO4 je dobře rozpustný ve vodě a tvoří řadu hydrátů (dodeka-, hepta-, hexa-, penta-, tetra-, di- a monohydrát), z nichž je nejběžnější heptahydrát (hořká sůl, podle jejíž chuti dostal prvek svůj český název). Chloristan hořečnatý Mg(ClO4)2 krystaluje jako hexa-, tetra- nebo dihydrát. Bezvodá sůl, kterou lze připravit termickou dehydratací hydrátů za sníženého tlaku, je stejně účinný sušící prostředek jako oxid fosforečný (navíc je regenerovatelný).
Hořčík tvoří stechiometricky i strukturně analogické dialkylderiváty jako beryllium. Průmyslově se získávají reakcí alkenů s hydridem hořečnatým nebo hořčíkem za přítomnosti vodíku

Za nejvýznamnější organokovové sloučeniny hořčíku jsou považována Grignardova činidla RMgX (X = halogen) tvořící se působením alkyl- nebo arylhalogenidů na jodem aktivovaný (indukce jodem rozrušuje ochranou vrstvičku oxidu na povrchu kovu) kovový hořčík v prostředí bezvodého diethyletheru. V pevných Grignardových sloučeninách je hořčík koordinován tetraedricky (dvě koordinační místa v tetraedru zaujímají molekuly diethyletheru). V roztoku se předpokládá existence rovnováh typu

Grignardova činidla se používají k syntéze sloučenin s novými vazbami C-C

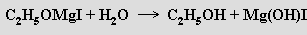
Analogicky lze připravit i sekundární a terciární alkoholy. Významná je rovněž možnost přípravy karboxylových kyselin z oxidu uhličitého

Z komplexů hořčíku mají největší význam chlorofyly (obsahují ligandy porfyrinového typu), které jsou v zelených rostlinách nezbytné pro fotosyntézu. Reakcí hořčíku s cyklopentadienem (500 °C) lze získat reaktivní komplex bis(cyklopentadienyl)hořečnatý [Mg(η5-C5H5)2] strukturně analogický ferrocenu.