
Hydridy MIIH2 jsou bílé netěkavé pevné látky solného typu s komplikovanou krystalovou strukturou. Vznikají přímou reakcí prvků za zvýšené teploty (400 °C; v atmosféře vodíku jsou stálé až do 1000 °C). V kyslíku při zahřátí hoří na oxid kovu a vodní páru, s vodou bouřlivě reagují za vývoje vodíku. Hydrid vápenatý CaH2 se používá jako silné redukovadlo a sušící prostředek pro organická rozpouštědla. Zahříváním CaH2 s CaX2 (X = halogen) ve vodíkové atmosféře se tvoří pevné, slídě podobné látky o složení CaHX.
Acetylidy MC2 vznikají z prvků při vysoké teplotě, při styku s vodou poskytují pří slušný hydroxid a acetylen. Acetylid (karbid) vápenatý CaC2 se vyrábí v makromnožstvích v elektrických pecích ze směsi oxidu vápenatého a koksu

Při vyšších teplotách reaguje s dusíkem za tvorby kyanamidu vápenatého CaCN2
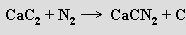
Kyanamid vápenatý se pod názvem dusíkaté vápno používá v zemědělství jako hnojivo, které působením vody pomalu uvolňuje amoniak

Nitridy o složení M3 N2 lze připravit reakcí kovů s dusíkem při zvýšené teplotě. Jsou to tvrdé těžkotavitelné látky, které s vodou snadno reagují za vývoje amoniaku (laboratorně se toho využívá při přípravě ND3 reakcí nitridu vápenatého s D2O)
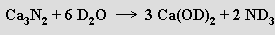
Oxidy kovů alkalických zemin MO jsou bílé látky s krystalovou strukturou chloridu sodného, vyskými body tání (CaO 2613 °C, SrO 2430 °C a BaO 1923 °C) a převážně iontovým charakterem vazeb. Jejich reaktivita výrazně závisí na velikosti částic, s vodou ochotně poskytují hydroxidy M(OH)2.
Oxid vápenatý CaO (pálené vápno) se připravuje termickým rozkladem uhličitanu vápenatého a v celosvětovém měřítku se ve větším měřítku produkuje jen kyselina sírová. Používá se ve stavebnictví k přípravě hydroxidu vápenatého Ca(OH)2 (hašené vápno), v metalurgii jako struskotvorná látka k odstranění fosforu, síry a křemíku, při úpravě pitné a užitkové vody, v dřevařském průmyslu jako kaustifikační činidlo, ve sklářství a při výrobě karbidu a chlornanu vápenatého. Velká množství vápna se spotřebují i v mlékárenství a cukrovarnictví (na výrobu 1 tuny cukru z cukrové řepy je třeba 250 kg vápna).
Stabilita peroxidů kovů alkalických zemin MO2, které lze připravit účinkem peroxidu vodíku na příslušný hydroxid, roste od vápníku k baryu. Nejvýznamnější z nich je peroxid barnatý BaO2, který vzniká i při zahřívání oxidu barnatého v atmosféře kyslíku. Byly popsány i ozonidy vápníku a barya.
Sulfidy kovů alkalických zemin MS jsou ve vodě málo rozpustné látky, které se připravují redukcí síranů uhlíkem. Působením síry na sulfidy nebo vodné roztoky hydroxidů kovů alkalických zemin vznikají polysulfidy MSx.
Fluoridy kovů alkalických zemin jsou ve vodě nerozpustné, málo reaktivní látky. Ostatní halogenidy jsou ve vodě dobře rozpustné. CaX2 a SrX2 (X = Cl, Br, I) krystalují většinou jako hexahydráty, BaX2 (X = Cl, Br, I) jako dihydráty. Chlorid a bromid vápenatý mají strukturu rutilu, jodid vápenatý vrstevnatou strukturu CdI2, což svědčí o větším uplatnění kovalentní interakce než v halogenidech alkalických kovů. Halogenidy barnaté (mimo BaF2) mají strukturu jodidu olovnatého s koordinačním číslem barya devět. Stejné koordinační číslo se uplatňuje v SrCl2.6H2O, v němž molekuly vody mají funkci můstků. Dihydráty SrCl2.2H2 O a BaCl2.2H2O mají vrstevnatou strukturu s koordinačním číslem osm. Bezvodý chlorid vápenatý CaCl2 se v laboratoři používá jako sušidlo, hexahydrát CaCl2.6H2O pro přípravu chladících směsí (dosažitelná teplota až -50 °C, využívá se toho i při zimní údržbě komunikací).
Hydroxidy vápenatý Ca(OH)2 a strontnatý Sr(OH)2 (oba krystalují jako oktahydráty) jsou středně silnými zásadami, hydroxid barnatý Ba(OH)2 se svou bazicitou blíží hydroxidům alkalických kovů. Termicky jsou poměrně stálé (Ca(OH)2 se rozkládá při 450 °C, Sr(OH)2 nad 700 °C a Ba(OH)2 taje bez rozkladu při 408 °C). Ve vodě jsou jen omezeně rozpustné (rozpustnost Ca(OH)2 klesá s teplotou, u Sr(OH)2 a Ba(OH)2 roste). Ca(OH)2 získaný hydratací oxidu je amorfní, lze ho však připravit i v krystalické formě se strukturou CdI2). V Sr(OH)2 se uplatňuje koordinační číslo sedm, struktura Ba(OH)2 není dosud spolehlivě určena. Všechny hydroxidy kovů alkalických zemin reagují s kyselinami (a také oxidem uhličitým) za vzniku solí.
Polymorfní uhličitan vápenatý CaCO3 (vápenec) se v přírodě nachází jako kalcit a aragonit (uměle byl připraven vaterit). Kalcit má základní buňku analogickou chloridu sodnému, koordinačním polyedrem je deformovaný oktaedr. Aragonit tvoří trojboké hranoly, v nichž je koordinační číslo kationtu i aniontu šest. Termickým rozkladem uhličitanů MCO3 (M = Ca, Sr, Ba) se tvoří příslušné oxidy
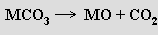
Rozpouštěním uhličitanu vápenatého ve vodě obsahující oxid uhličitý se tvoří hydrogenuhličitan vápenatý Ca(HCO3)2. Je příčinou přechodné tvrdosti vody, protože zahřátím roztoku se rozkládá
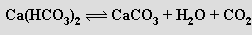
Rozpouštění vápence ve vodě s obsahem oxidu uhličitého a jeho opětovné vylučování při poklesu koncentrace CO2 v roztoku je podstatou krasových jevů.
Dusičnany M(NO3)2 (M = Ca, Sr, Ba) jsou známy jako bezvodé soli i jako hydráty (Ca(NO3)2 a Sr(NO3)2 tvoří tetrahydráty, Ba(NO3)2 dihydrát). Při zahřívání nejprve dehydratují a pak se rozkládají za uvolňování kyslíku a vzniku dusitanů. Konečným produktem jejich termického rozkladu jsou oxidy MO. Fosforečnany M3(PO4)2 (M = Ca, Sr, Ba) jsou ve vodě nerozpustné, významné jsou pouze vápenaté soli. Hydrogenfosforečnan vápenatý CaHPO4 se rozpouští v kyselých roztocích, v nichž přechází na rozpustný dihydrogenfosforečnan vápenatý Ca(H2 PO4)2. Oba se používají v zemědělství jako hnojiva. Sírany MIISO4 jsou ve vodě velmi málo rozpustné (ve 100 g vody se rozpustí 202 mg CaSO4). Síran vápenatý CaSO4 je příčinou trvalé tvrdosti vody, kterou nelze varem odstranit. Krystaluje jako dihydrát CaSO4.2 H2 O (sádrovec), zahřátím nad 100 °C přechází na hemihydrát CaSO4. H2O (sádru). Sádra se při smísení s vodou hydratuje a přitom tuhne. Bezvodý síran vápenatý tuto vlastnost nemá, protože se hydratuje pomalu a nevzniká přitom spleť jehličkovitých krystalů podmiňující mechanické vlastnosti sádry.
Z organokovových sloučenin jsou známy alkylderiváty typu M(CH3)2 (M = Ca, Sr, Ba), na vzduchu samozápalné tuhé látky. Vazby v nich mají významný podíl iontovosti. U všech tří kovů jsou známy cyklopentadienylové komplexy, ale s podstatně komplikovanější strukturou než má ferrocen (tři typy různě vázaných cyklopentadienylových kruhů).
Komplexních sloučenin není velký výběr. Vznik nestálých amminkomplexů byl pozorován pouze u vápníku, který v roztocích tvoří stabilnější chelátové komplexy s polyfunkčními ligandy typu kyseliny ethylendiamintetraoctové ((HOOCCH2)2NCH2CH2N(CH2COOH)2) nebo crownetherů. Známy jsou i kryptáty s posloupností stability Ca < Sr < Ba.