
Název aluminum (navržený H. Davym) pochází z latinského alumen (hořká sůl, označuje kamenec hlinitodraselný používaný už ve starém Řecku a Římě v lékařství jako adstringentní (stahující) prostředek) byl později modifikován na aluminium (jen v USA se od roku 1925 užívá původně navržený název). Nepříliš čistý kov získal H. C. Oersted (1827) redukcí chloridu hlinitého draslíkovým amalgamem. První průmyslový postup (1854, H. Sainte-Claire Deville) využíval k redukci AlCl3 sodík (cena hliníku byla tehdy tak vysoká, že na pařížské výstavě v roce 1855 byl vystavován vedle korunovačních klenotů a Napoleon III používal při recepcích hliníkové příbory). Až do současné doby používaná elektrolytická metoda přípravy hliníku byla zavedena v roce 1886 (P. L. T. Heroult ve Francii a nezávisle i C. M. Hall v USA).
V přírodě je hliník třetím nejrozšířenějším prvkem (8,3 %). Nejčastěji se vyskytuje ve formě hlinitokřemičitanů (živce, slídy, zeolity). Produktem větrání živců jsou jíly, které s příměsí písku, oxidu železitého a dalších látek tvoří hlíny. Pro výrobu hliníku nejdůležitější minerál bauxit je směsí hydratovaných forem oxidu hlinitého (převažuje böhmit γ-AlO(OH)), významné použití mají také kryolit Na3[AlF6] a korundα-Al2O3 (jeho zbarvenými odrůdami jsou drahokamy safír, rubín, topas a orientální smaragd).
Hliník je stříbrobílý, silně elektropozitivní kov, dobře kujný a tažný s velmi dobrou tepelnou i elektrickou (60 % vodivosti mědi) vodivostí. Krystaluje v kubické plošně centrované mřížce (CCP).
Hliník přednostně uplatňuje oxidační číslo +III. Je známo jen málo sloučenin, v nichž má oxidační stupeň +I (AlF, AlCl, AlBr, Al2O, Al2S) nebo +II (AlO) a jejich existence je omezena na plynný stav a vysoké teploty. Ionizační energie jsou menší než u boru a vznik kationtu Al3+ je proto pravděpodobnější. Přesto se v binárních sloučeninách ani v bezvodých solích kationty Al3+ nevyskytují (s výjimkou fluoridu, chloristanu a fluorosíranu hlinitého).
Ve vodných roztocích jsou na rozdíl od boru běžné hydratované kationty [Al(H2O)6]3+, které jsou také součástí krystalové struktury hydratovaných solí hlinitých. Hliník má malou elektronegativitu (1,5) a jím vytvářené kovalentní vazby jsou proto silně polární (často na hranici konvenčního rozmezí mezi iontovostí a kovalencí). Jeho atomy mohou tvořit až šest σ-vazeb (oktaedrické komplexy, korund α-Al2O3, hydrargillit Al(OH)3), tendence k uplatnění hybridizace sp2 je oproti boru nízká a souvisí s neschopností hliníku vytvářet π-vazby s využitím pz-orbitalu. . Halogenidy hlinité jsou polymery, pouze AlF3 převažuje v pevném stavu iontový charakter. Řada dalších látek se stechiometrií AlX3 tvoří dimery, v nichž se uplatňují buď koordinační (Al2Cl6) nebo polycenterní elektronově deficitní vazby (Al2(CH3)6). Hliník netvoří těkavé hydridy analogické boranům.
Vůči vzduchu a vodě je hliník mimořádně stálý, protože se snadno pokrývá vrstvičkou oxidačních produktů, která ho před další korozí chrání (amalgamováním nebo působením roztoků některých solí elektropozitivnějších kovů se ochrana ztrácí).

[Zobrazit video]
| Vznik hliníkového květu amalgamováním povrchu hliníkového plechu roztokem rtuťnaté soli |
S kovy všech skupin periodického systému tvoří slitiny. Za vývoje vodíku se rozpouští ve zředěných silných kyselinách na soli hlinité
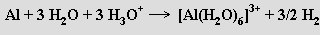
a v alkalických hydroxidech na tetrahydroxohlinitany
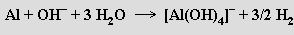
Koncentrovanou kyselinou dusičnou se hliník pasivuje (ztrácí schopnost reagovat se zředěnými kyselinami). Při zahřívání na vzduchu shoří intenzivním svítivým plamenem na oxid hlinitý (práškový hliník s kapalným kyslíkem exploduje)
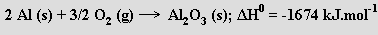
Na velké afinitě hliníku ke kyslíku je založena aluminotermie, jedna z významných metod přípravy kovů (byla známá už v minulém století). Směs oxidu kovu a hliníkové krupice se v žáruvzdorné nádobě zapálí (pomocí zápalné směsi z peroxidu barnatého a práškového hliníku) a hliník se energickou reakcí oxiduje na oxid hlinitý a redukuje se příslušný kov (na stejném principu se používá směs hliníku a oxidu železitého zvaná termit ke svařování kolejnic)
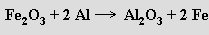

[Zobrazit video]
| Bouřlivý průběh aluminotermické reakce |
Hlinité soli slabých kyselin podléhají snadno hydrolýze až na hydratovaný hydroxid hlinitý [Al(OH)3(H2O)3], u solí silných kyselin (halogenidů, dusičnanu, síranu) není tato reakce kvantitativní. Roztoky obsahující kation [Al(H2O)6]3+ reagují kysele v důsledku jeho schopnosti působit jako donor protonů
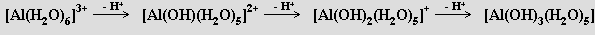
Hydrolýza hlinitých solí je velmi důležitá při čištění vody, protože hydroxid hlinitý vzniká na rozptýlených jemných pevných částicích, které pak lze snáze odstranit. Snadný průběh hydrolýzy znemožňuje přípravu bezvodých hlinitých solí termickou dehydratací odpovídajících hydrátů (síla interakce Al-O zabraňuje tvorbě vazeb Al-Cl)
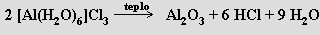
Prakticky jedinou surovinou pro výrobu hliníku je bauxit. Z něho se žíháním s uhličitanem sodným nebo zahříváním pod tlakem s koncentrovaným roztokem hydroxidu sodného (Bayerova metoda) a následným loužením vodou připraví roztok hlinitanu sodného (nerozpustné nečistoty nazývané červený kal se odstraní). Z něho se zaváděním oxidu uhličitého vyloučí hydroxid hlinitý, který se kalcinací při 1200 °C převede na oxid hlinitý. Ten se rozpustí v roztaveném kryolitu při teplotě cca 950 °C a podrobí se elektrolýze v železných vanách vyložených uhlíkem, který slouží jako katoda. Anodou jsou uhlíkové bloky zavěšené v tavenině . Hliník se vylučuje na katodě a jako těžší složka se hromadí na dně van, na anodě se vyvíjí kyslík, který s uhlíkem anod částečně reaguje na oxidy uhličitý a uhelnatý (vzniká i malé množství fluoridu uhličitého). Současný rozsah výroby hliníku (1950 1,52 mil. tun, 1988, 17,3 mil. tun) převyšuje jen výroba železa a oceli.
Hliník má vedle aluminotermie řadu dalších možností praktické použití. Slouží jako materiál na výrobu cisteren, konví, sudů i kuchyňského nádobí. Povrch hliníku se pro tento účel upravuje anodickou oxidací (eloxováním), aby se zvýšila jeho odolnost proti korozi. Ve slitinách je konstrukčním materiálem s malou měrnou hmotností (zvlášť důležité je legování mědí), nahrazuje dražší měď v rozvodech elektřiny, ve formě fólií (alobal) slouží jako obalový materiál a používá se k úpravě povrchu zrcadel pro dalekohledy.