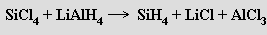
Silany, stejně jako alkany, tvoří řadu obecného vzorce SinH2n+2 (n = 1-8). Silan a disilan jsou plyny, vyšší homology kapaliny. Působením kyseliny chlorovodíkové na silicid hořečnatý Mg2Si vzniká jejich směs (lze ji rozdělit frakční vakuovou destilací), v níž je obsah jednotlivých homologů nepřímo úměrný jejich molekulovým hmotnostem. Příprava silanů je možná i reakcí halogenidů křemičitých s tetrahydridohlinitanem lithným v diethyletheru
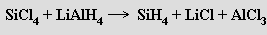
Termicky jsou silany mnohem méně stálé než alkany (stabilita klesá s rostoucí molekulovou hmotností), jsou samozápalné a velmi reaktivní . S vodou reagují za vývoje vodíku
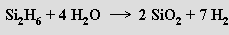
Jejich reakce s halogeny je za laboratorní teploty explozívní. S halogenovodíky, s výjimkou fluorovodíku, vznikají (za přítomnosti odpovídajících halogenidů hlinitých) halogenoderiváty silanů
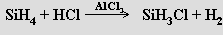
Silicidy jsou sloučeniny křemíku s kovy, které jsou strukturně bližší spíše boridům než karbidům. Většina z nich má charakter intersticiálních sloučenin se stechiometrií M6Si až MSi6 (Li3Si, Mg2Si, FeSi, CaSi2, BaSi3). Vazebná interakce se v nich, v závislosti na charakteru kovu, může měnit od kovové přes iontovou až k polárně kovalentní. Vznikají buď tavením obou složek nebo redukcí oxidu křemičitého nadbytkem příslušného kovu. Nejreaktivnější jsou silicidy prvků s-bloku.
Karbid křemičitý SiC (karborundum) je v čistém stavu bezbarvá krystalická látka, termicky (do 2200 °C) stálá a chemicky inertní (koncentrované kyseliny na ni nepůsobí). Pro mimořádnou tvrdost (je tvrdší než korund) se používá jako brusný materiál. Připravuje se v elektrických pecích reakcí
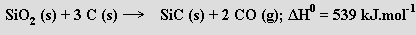
Nitrid křemičitý Si3N4 je chemicky inertní látka vznikající z prvků za vyšší teploty (1300 °C).
Oxid křemnatý SiO vzniká ve formě par zahříváním oxidu křemičitého nebo křemičitanů s křemíkem na vysokou teplotu ve vakuu. Kondenzací par vzniká pevný hnědý amorfní a na vzduchu samozápalný produkt se silnými redukčními vlastnostmi. Dlouhodobým zahříváním ve vakuu disproporcionuje oxid křemnatý na křemík a W-modifikaci oxidu křemičitého, která rychle reaguje s vodou za tvorby kyseliny křemičité a strukturně je blízce příbuzná sulfidu křemičitému.
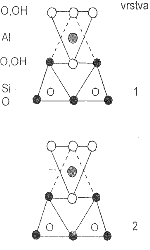
Oxid křemičitý SiO2 je pevná, obtížně tavitelná látka s prostorovou strukturou. Každý atom kyslíku je v ní vázán ke dvěma atomům křemíku a každý atom křemíku ke čtyřem tetraedricky uspořádaným atomům kyslíku. Jednotlivé polymorfní modifikace se liší způsobem spojení tetraedrů SiO4. Nejdůležitějšími z nich (každá modifikace existuje ve dvou formách α- a β- náležejících do různých krystalografických soustav) jsou křemen (trigonální/hexagonální), tridymit (orthorhombický/hexagonální) a cristobalit (čtverečný/krychlový). Rozdíly mezi strukturou tridymitu a cristobalitu jsou podobné jako rozdíly mezi wurtzitem a sfaleritem. Jsou známy ještě další modifikace oxidu křemičitého vznikající při extrémních teplotních a tlakových podmínkách. Coesit se nachází v meteoritických kráterech a nereaguje s kyselinou fluorovodíkovou, stišovit má stejný původ a keatit se strukturou rutilu a koordinačním číslem křemíku šest vzniká v přítomnosti vodní páry.
Ve struktuře α- i β-křemene existují dvě vzájemně skloubené šroubovice tetraedrů SiO4, které mohou být buď pravotočivé nebo levotočivé. Křemen je proto opticky aktivní látkou (jev optické aktivity byl právě u křemene objeven, dobře vyvinuté krystaly obou optických izomerů lze rozlišit i podle vnějšího vzhledu). Krystaly křemene vykazují piezoelektrické vlastnosti (vznik elektrického náboje v důsledku působení tahu nebo tlaku a naopak), které jsou využívány v měřící technice, elektroakustice a radiotechnice. Ze všech modifikací oxidu křemičitého vzniká totožná tavenina, jejímž rychlým ochlazením se získá amorfní křemenné sklo (obtížně se zpracovává, ale má řadu výhodných vlastností umožňujících jeho využití v chemických laboratořích).
V přírodě se oxid křemičitý nachází nejčastěji jako drobně krystalický znečištěný křemen (písek) a je součásti některých hornin (pískovec, granit). Čiré velké krystaly (křišťál) se používají na výrobu optických přístrojů, zbarvené odrůdy (záhněda, ametyst, citrín) slouží při výrobě šperků jako polodrahokamy. Částečně vykrystalovaný hydratovaný oxid křemičitý se nachází v přírodě jako opál, jeho stárnutím vzniká méně vody obsahující chalcedon a řada jeho variací (achát, jaspis, onyx). Chemické vlastnosti všech nízkotlakých forem oxidu křemičitého jsou shodné, typická je jejich malá reaktivita. Jsou odolné vůči kyselinám s výjimkou kyseliny fluorovodíkové, roztoky silných zásad na ně působí pomalu až při zvýšené teplotě.
Sulfid křemičitý SiS2 je bezbarvá krystalická látka, která se připravuje přímou reakcí prvků (600 °C) a je tvořena nekonečnými řetězci hranou spojených tetraedrů SiS4. Vodou se rozkládá
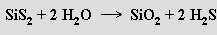
Halogenidy křemičité lze považovat za deriváty silanů obecného vzorce SinX2n+2. Nejvyššími známými homology jsou Si14F30, Si6Cl14, Si2Br6 a Si2I6. Na rozdíl od halogenoalkanů reagují energicky s vodou
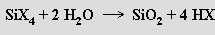
Všechny lze připravit přímou reakcí křemíku s halogenem. Jsou známy i halogeny neúplně substituované deriváty silanů (silikochloroform SiHCl3) a alkylhalogensilany (trimethylchlorsilan Si(CH3)3Cl).
Fluorid křemičitý SiF4 (b. v. - 95.5 °C) je bezbarvý plyn, který se připravuje zahříváním směsi fluoridu vápenatého a oxidu křemičitého s koncentrovanou kyselinou sírovou, která současně váže při reakci vznikající vodu
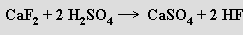
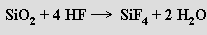
S vodou nebo kyselinou fluorovodíkovou fluorid křemičitý ochotně reaguje za vzniku kyseliny hexafluorokřemičité H2SiF6
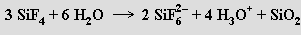
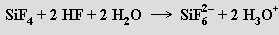
Molekulová forma kyseliny hexafluorokřemičité není schopna existence, protože by v ní musely existovat dvojvazné atomy fluoru s formálním kladným nábojem. Je proto buď zcela ionizována nebo se rozkládá na své složky (lze ji izolovat jako krystalický dihydrát (H3O+)2 [SiF6]2− s bodem tání 19 °C). Aniont hexafluorokřemičitanový SiF62− je pravidelným oktaedrem. Hexafluorokřemičitany vznikají působením roztoku kyseliny hexafluorokřemičité na hydroxidy či uhličitany nebo reakcemi fluoridu křemičitého s fluoridy kovů. S výjimkou draselné a barnaté soli jsou dobře rozpustné ve vodě, zahříváním se rozkládají
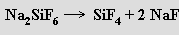
Chlorid křemičitý SiCl4 (b. t. -68 °C, b. v. 57 °C) je bezbarvá kapalina vznikající působením chloru na zahřátou směs oxidu křemičitého a uhlí
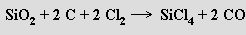
Bromid křemičitý SiBr4 (b. t. 5,2 °C, b. v. 152,8 °C) je bezbarvá kapalina, jodid křemičitý SiI4 (b. t. 120,5 °C) tvoří bezbarvé krystaly.
Kyseliny křemičité vznikají hydrolýzou halogenidů křemičitých nebo okyselením vodných roztoků alkalických křemičitanů. Ve vodných roztocích se předpokládá existence nestálé, ve vodě rozpustné kyseliny orthokřemičité H4SiO4, která má sklon ke kondenzačním reakcím vedoucím ke koloidním roztokům polymerních produktů (solům). Delším stáním, zahřátím nebo přídavkem elektrolytu dochází k vylučování rosolovitých gelů s velkým obsahem vody (H2O :SiO2≈ 330:1).

[Zobrazit video]
| Vylučování gelu kyseliny křemičité |
Vysušením se získá amorfní tvrdý gel (silikagel), který má v důsledku neuspořádanosti své struktury velmi dobré adsorpční vlastnosti. Několik dalších forem kyseliny křemičité s definovanou molekulovou hmotností je možno připravit v nevodném prostředí.
Při tavení křemene s hydroxidy nebo uhličitany alkalických kovů vznikají ve vodě rozpustné křemičitany
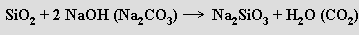
Rozpustná tavenina oxidu křemičitého a oxidu alkalického kovu (v molárním poměru 3 až 5:1) se nazývá vodní sklo. Používá se na impregnaci různých materiálů, konzervování vajec a jako lepidlo na skleněné a porcelánové předměty. Běžná skla (skla jsou amorfní ztuhnuté taveniny, které nemají ostrý bod tání, ale postupně měknou a plynule přecházejí do kapalného skupenství; dlouhé zahřívání na teplotu měknutí způsobuje rozesklení vznikem krystalických zárodečných center) nejsou rozpustná ve vodě a získávají se tavením oxidu křemičitého s uhličitany alkalických kovů a kovů alkalických zemin v poměru 6:1:1
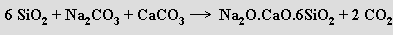

[Zobrazit video]
| Demonstrace vlastností různých druhů skla |
Jako přísady modifikující fyzikální i chemické vlastnosti skel se používají oxidy hlinitý, olovnatý, boritý a fosforečný. Index lomu se může korigovat přídavkem oxidu olovnatého, koeficient tepelné roztažnosti se snižuje přídavkem oxidu hlinitého, oxid fosforečný a oxid boritý zvyšují odolnost vůči kyselinám. K barvení skel se používají oxidy kobaltnatý (modrá), železitý (hnědá) a železnatý (zelená).
Křemičitany vyskytující se v přírodě lze jen zřídka považovat za soli kyselin křemičitých. Jejich základními stavebními jednotkami jsou tetraedry SiO4 spojené do větších celků můstkovými atomy kyslíku (vazbami Si-O-Si). Vlastnosti těchto látek významně závisejí nejen na složení, ale především na geometrické stavbě křemičitanové kostry. Chemická elementární analýza není proto spolehlivým prostředkem pro zařazení studovaných vzorků do určité strukturní skupiny, k tomu jsou nezbytné krystalografické údaje.

[Zobrazit video]
| Keříkovité krystaly vyloučené z roztoku křemičitanů |
Část atomů křemíku může být nahrazena hliníkem za vzniku hlinitokřemičitanů (prvkem nahrazujícím křemík může být také beryllium, bor nebo fosfor). Tetraedr SiO4 může být spojen s ostatními prostřednictvím jednoho až čtyř kyslíkových atomů, dva tetraedry jsou vzájemně vázány vždy jen jedním můstkovým atomem kyslíku. Všechny křemičitany a hlinitokřemičitany si svoji individualitu zachovávají pouze v pevném stavu. Z tavenin minerálů mohou krystalizací vznikat (podle použitých podmínek a katalyzátorů) jiné minerály. Jejich běžně uváděné vzorce jsou idealizované, v přírodě je často část některých kationtů nahrazena jinými. Některé z křemičitanů se rozkládají minerálními kyselinami (HCl) za vzniku kyselin křemičitých, jiné nikoliv. Všechny podléhají působení kyseliny fluorovodíkové za vzniku fluoridu křemičitého nebo hexafluorokřemičitanů. Jsou rozrušovány roztoky alkalických hydroxidů a bez výjimek se rozkládají alkalickým tavením s hydroxidy nebo uhličitany alkalických kovů. Prakticky jsou široce využívány především ve sklářském, keramickém a cementářském průmyslu. Podle stupně pospojování tetraedrů SiO4 se dělí na čtyři skupiny.
Křemičitany s ostrůvkovou strukturou obsahují izolované anionty SiO44−, Si2O76−, cyklo-Si3O96− nebo cyklo-Si6O1812−. Do této skupiny náležejí i α-Ca2SiO4 (složka cementu), olivín (Mg,Fe)2SiO4, granáty M3M'2(SiO4)3, (M = CaII , MgII, FeII; M' = AlIII, CrIII, FeIII), benitoit BaTiSi3O9, beryl Be3Al2 Si6O18hemimorfit Zn4(OH)2Si2O7.H2O, a turmalín (Na,Ca)(Li,Al)3Al6(OH)4(BO3)3 Si6O18. Vlastnosti podvojného oxidu má forsterit Mg2SiO4.

Anion SiO44−
|
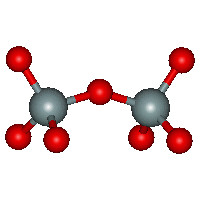
Anion Si2O76−
|
|
Anion Si3O96−
|
Anion Si6O1812−
|
Křemičitany s řetězovou strukturou se dělí se na pyroxeny, v nichž jsou tetraedry SiO4 spojeny do řetězců (diopsid CaMg(SiO3)2 a spodumen LiAl(SiO3)2) a amfiboly, které mají dvojité řetězce (tremolit Ca2Mg5 (OH)2(Si4O11)2). Všechny mají vláknitou strukturu a označují se jako asbesty.
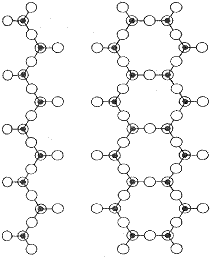
Pyroxeny a amfiboly
|
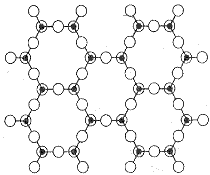
Vrstva o složení [Si2O5]2−
|
Křemičitany a hlinitokřemičitany s vrstevnatou strukturou jsou podstatou řady minerálů (jílů, serpentinů, slíd). V každém tetraedru SiO4 jsou při tvorbě vrstev tři atomy kyslíku využity jako můstkové, v rámci vrstvy se stechiometrickým složením Si2O52− mohou existovat vedle šestičlenných i čtyř- a osmičlenné cykly. Při spojení dvou takových vrstev přes můstkově nevyužité kyslíkové atomy by vznikla dvojitá vrstva bez náboje o sumárním složení SiO2 (dosud neznámá modifikace oxidu křemičitého). Na vrstvu o složení {Si2O5} se může vázat vrstva brucitu Mg(OH)2 nebo hydrargillitu Al(OH)3, jejichž základním strukturním motivem je oktaedrická koordinace kovu šesti skupinami OH−. Příklady minerálů tohoto typu mohou být chryzotil (technický azbest) Mg3(OH)4(Si2O5) a kaolinit Al2(OH)4(Si2O5). Vrstvy jsou bez náboje a vzájemně na sebe působí pouze disperzními silami. To je příčinou měkkosti kaolinitu a vláknitého vzhledu chryzotilu, v němž jsou vrstvy stočeny do spirál. V dalších měkkých minerálech pyrofilitu Al2(OH)2(Si4O10) a mastku Mg3(OH)2(Si4O10) obklopují vrstvy {Si2O5} brucitovou nebo hydrargillitovou vrstvu z obou stran.
Kaolinit Al2(OH)4(Si2O5)
|
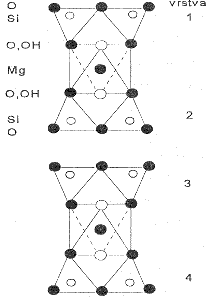
Mastek Mg3(OH)2(Si4O10)
|
Zamění-li se v křemičitanové vrstvě {Si2O5} část atomů křemíku hliníkem, dostane vrstva záporný náboj, který je ve slídách (muskovit KAl2(OH)2(Si3AlO10), flogopit KMg3(OH)2(Si3AlO10), margarit CaAl2(OH)2(Si2Al2O10)) kompenzován kationty uloženými mezi vrstvami. S růstem poloměru a snižováním náboje těchto kationtů roste štípatelnost těchto minerálů.
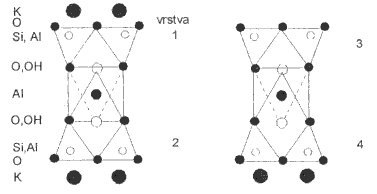
Hlinitokřemičitany s prostorovou strukturou jsou tvořeny trojrozměrnou sítí tetraedrů SiO2 pospojovaných přes všechny čtyři kyslíkové atomy, přičemž část atomů křemíku je nahrazena hliníkem. Stechiometrické složení je vždy (Si, Al):O = 1:2, hliníku může být nejvýše 50 %. Dělí se do tří skupin.
Živce (ortoklas KAlSi3O8, anorthit CaAl2Si2O8) mají kompaktní strukturu (s hustotou 2,6-2,7 g.cm-3) příbuznou tridymitu nebo cristobalitu. Oproti vrstevnatým strukturám, v nichž můstkově nevyužité atomy kyslíku směřují na jednu stranu vrstvy, jsou tyto kyslíkové atomy směrovány na obě strany, což umožňuje prostorové zesíťování. Kationty jsou uloženy uvnitř hlinitokřemičitanové kostry a tím izolovány proti vnějším vlivům. Živce se těžko rozkládají a ve struktuře nikdy neobsahují vodu. Tvoří dvě třetiny vulkanických hornin zemské kůry.
Zeolity (analcin NaAlSi2O6.H2O, chabazit (Ca, Na2)Al2Si4O12.6H2O) na rozdíl od živců obsahují vodu, kterou lze reverzibilně odstranit. Z rentgenografických údajů plyne, že základem jejich hlinitokřemičitanové kostry jsou kouli podobné útvary složené z tetraedrů SiO4, vzájemně spojené prostřednictvím pouze některých tetraedrů SiO4. V jejich krystalové mřížce tak vznikají kanálky pospojované dutiny, v nichž jsou uloženy kationty a voda. Mohou fungovat jako měniče kationtů (katexy) a používají se proto při změkčování vody. Syntetické zeolity s definovanou velikostí dutin se nazývají molekulová síta a používají se k sušení organických rozpouštědel a k selektivní adsorpci při rozdělování směsí kapalin nebo plynů.
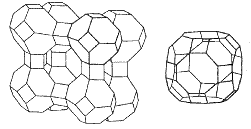
Zeolit A Na12(Al12Si12O48).27H2O
|
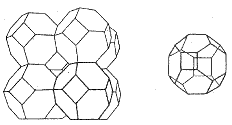
Sodalit Na8(Al6Si6O24)Cl2
|
Ultramaríny (ultramarín Na8(Al6Si6O24)S2, sodalit Na8(Al6Si6O24)Cl2, nosean Na8(Al6Si6O24)SO4) jsou často výrazně zbarvené. Mají podobné složení jako zeolity, v dutinách obsahují kromě kationtů i anionty (S22−, Cl−, SO42−), ale nikoliv vodu.
Během posledních několika desetiletí bylo připraveno obrovské množství organokřemičitých sloučenin, z nichž některé vynikají vysokou termickou stabilitou (Si(C6H5)4 vře bez rozkladu při 428 °C) a chemickou inertností. Omezujícím faktorem oproti chemii uhlíku je neochota křemíku k řetězení a jeho malý sklon k tvorbě násobných vazeb. K přípravě sloučenin obsahujících vazbu Si-C jsou využívány reakce halogensilanů s Grignardovými činidly nebo organolithnými (pří padně organohlinitými) sloučeninami. Průmyslově nejvýznamnější jsou siloxany (silikony) vznikající kondenzačními reakcemi silanolů, silandiolů a silantriolů, které se tvoří rozkladem alkylhalogensilanů vodou. Nejjednodušším derivátem tohoto typu je hexamethyldisiloxan (CH3)3Si-O-Si(CH3)3. Oligomerní siloxany tvoří lineární i cyklické molekuly z jednotek -R2SiO-, přičemž vyšší počet jednotek vede spíše k tvorbě řetězovitých než cyklických polymerů. Podle délky řetězců mohou být silikony olejovité kapaliny, živičné hmoty až kaučukovité látky (silikonový kaučuk). V praxi jsou významné methyl- a fenylderiváty, které se používají jako hydraulické kapaliny a mazadla. Jsou-li můstkové atomy kyslíku v siloxanech nahrazeny skupinami NH, hovoříme o silazanech (nejjednodušší z nich je hexamethyldisilazan (CH3)3 Si-NH-Si(CH3)3), které mají značný význam v chemické syntéze.