Některé malé molekuly (dikyslík, didusík, oxid uhelnatý, oxid siřičitý) tvoří s vodou a některými organickými sloučeninami krystalické látky proměnlivého složení nazývané klathráty. V krystalové struktuře hostitele jsou dutiny, do nichž se mohou umístit molekuly hosta pouze určité velikosti a tvaru. Hostitelskou a hostující molekulu poutají pouze slabé van der Waalsovy síly, po úniku hosta se struktura zbortí. Ze vzácných plynů tvoří tyto sloučeniny pouze argon, krypton a xenon (helium a neon jsou příliš malé a málo polarizovatelné). Jsou známy klathráty s limitním složením 8Y.46H2O, Y.3R a 2Y.R'.17H2O (Y = Ar, Kr, Xe; R = hydrochinon, fenol, p-kresol; R' = aceton, chloroform, chlorid uhličitý). Lze je využít pro skladování vzácných plynů (k tomu mohou sloužit i zeolity) a při práci s radioaktivními izotopy kryptonu a xenonu vznikajícími v jaderných reaktorech. Radioaktivní izotop 85Kr (β-zářič, τ1/2 = 10,3 roku) snadno difunduje do různých tuhých látek za tvorby fází s proměnlivým složením. Při reakcích (oxidaci) takových kryptonátů kovů se rozruší jejich povrch a uvolní se úměrné množství radioaktivního kryptonu (lze tak sledovat rychlost koroze).
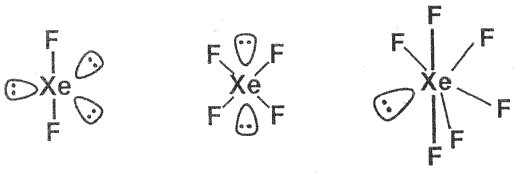
Všechny tři známé fluoridy xenonu XeFn (n = 2, 4, 6) vznikají přímou reakcí prvků za přesně definovaných podmínek (teplota, tlak, stechiometrické složení směsi).

Fluorid xenonatý XeF2 (b. t. 129 °C)lze připravit ozařováním směsi fluoru s xenonem slunečním světlem. Ve všech skupenstvích tvoří lineární molekuly. Ve vodě se rozpouští na 0,15 M roztok, jeho hydrolýza probíhá v alkalickém prostředí rychle, v kyselém pomalu (τ1/2 = 7 hodin při 0 °C). Je silným oxidovadlem (převádí bromičnany na bromistany) a jemným fluoračním činidlem používaným v organické syntéze (benzen převádí na fluorobenzen).
Podvojnou záměnou mezi fluoridem xenonatým a bezvodými oxokyselinami vznikají oxofluorosloučeniny (FXe(OSO2F), Xe(OSO2F)2, FXeOClO3). Tak byl také připraven derivát difluoridu kyseliny imido-bis(fluorosírové) FXeN(SO2F)2 obsahující vazbu Xe-N. První nestálou a dosud nedostatečně charakterizovanou sloučeninou obsahující vazby Xe-C byl Xe(CF3)2 (vzniká reakcí radikálů CF3• s XeF2. Dnes je známo několik dalších, lépe charakterizovaných sloučenin tohoto typu (ButC≡C–Xe+BF4−). Kation Xe2+ s nejdelší dosud známou vazbou prvek-prvek (308,7 pm) byl identifikován ve sloučenině Xe2+Sb4F21−.
Fluorid xenoničitý XeF4 vzniká rovněž reakcí xenonu a fluoru (niklový reaktor, teplota 400 °C, tlak 0,6 MPa, objemový poměr komponent 1:5). Je silnějším fluoračním činidlem než fluorid xenonatý, specificky fluoruje aromatický kruh. Vodou se rychle hydrolyzuje a mezi vznikajícími produkty je i explozívní oxid xenonový.
Pro přípravu fluoridu xenonového XeF6 (b. t. 49,5 °C) je třeba ještě vyšší tlak a velký přebytek fluoru v reakční směsi (tlak ≈5 MPa, teplota 300 °C, objemový poměr komponent 1:20). Molekula nemá podle očekávání přesně oktaedrickou symetrii. Struktura pevné fáze (jsou známy nejméně čtyři polymorfní modifikace) je neočekávaně složitá a obsahuje tetramerní a hexamerní jednotky.
V O(SF5)2 se XeF6 rozpouští na žlutý roztok obsahující monomerní molekuly. S vodou fluorid xenonový prudce reaguje
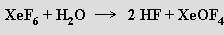
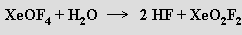
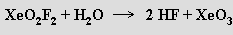
Nelze s ním pracovat ve skleněných aparaturách, protože analogické reakce produkující analogické oxid-fluoridy xenonu probíhají i s oxidem křemičitým. Reakcemi XeF6 s donory fluoridových iontů byly připraveny i anionty XeF7− a XeF82− stabilizovatelné kationty těžších alkalických kovů.
Oxid xenonový XeO3, který se získává úplnou hydrolýzou XeF6, je v suchém stavu extrémně explozívní. Má silné oxidační účinky, v roztoku nevede elektrický proud a není tedy anhydridem kyseliny xenonové. Její soli lze získat reakcí oxidu xenonového s roztoky silných zásad
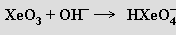
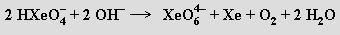
Při nadbytku hydroxidu snadno dochází k disproporcionaci hydrogenxenonanu na xenon a xenoničelan za současného uvolnění dikyslíku
Z xenoničelanu barnatého lze účinkem studené koncentrované kyseliny sírové připravit oxid xenoničelý XeO4 jako explozívní plyn
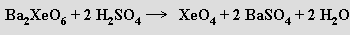
Chlorid xenonatý XeCl2 byl připraven v inertní matrici při teplotě 20 K, o existenci XeBr2 a XeCl4 (produkty β-rozpadu analogických sloučenin 129I) byl získán důkaz Mössbauerovou spektroskopií, ale izolovat se je nepodařilo.
Fluorid kryptonatý KrF2 vzniká účinkem elektrického výboje nebo rentgenového záření na směs kryptonu a fluoru při nízké teplotě (-196 °C) a již za laboratorní teploty je nestabilní. Podobně jako fluorid xenonatý je schopen tvořit kationty KrF+ a [Kr2F3]+. Je nejsilnějším známým oxidačním činidlem.