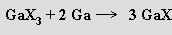
Hydridy gallia, india a thallia nejsou za laboratorní teploty schopny existence. Gallan GaH3 je při bodu tání (-15 °C) viskózní kapalina, která se při zahřátí na laboratorní teplotu kvantitativně rozkládá na své komponenty. Indan InH3 a thallan TlH3 existují jen v etherických roztocích při nízkých teplotách. Obdobný pokles stability od gallia k thalliu lze pozorovat i u tetrahydridokomplexů MH4−, stabilnější jsou DA-komplexy MH3.D (D = trimethylamin, pyridin).
Oxid gallitý Ga2O3, oxidhydroxid gallitý GaO(OH) a hydroxid gallitý Ga(OH)3 tvoří analogický systém jako u hliníku, řady α- a γ- mají i stejnou strukturu. Nejstabilnější modifikací je β-Ga2O3 se zvláštní krystalovou strukturou, v níž ionty kyslíku tvoří kubickou mřížku (CCP) a GaIII se nacházejí v deformované síti tetraedrických a oktaedrických mezer. Analogická situace s menším počtem známých modifikací je u india, pouze thallium se chová odlišně. Hygroskopický oxid thallný Tl2O vzniká ve formě černých destičkovitých krystalů termickým rozkladem uhličitanu thallného při 700 °C v atmosféře dusíku. Reakcí s vodou poskytuje hydroxid thallný TlOH, který se bazicitou blíží hydroxidům alkalických kovů. Červenohnědý oxid thallitý Tl2O3 se připravuje oxidací vodného roztoku dusičnanu thallného chlorem nebo bromem, vysrážením hydratovaného oxidu Tl2O3.3/2H2 O a jeho následnou termickou dehydratací. Je znám i fialový peroxid thallný Tl2O2 vznikající při elektrolýze roztoku síranu thallného obsahujícího kyselinu šťavelovou.
Fluoridy gallný GaF a indný¨InF jsou nestálé (podobně jako AlF), ostatní monohalogenidy obou kovů jsou stabilnější (stabilita roste s velikostí aniontu) a lze je získat jako reaktivní sublimáty reakcemi
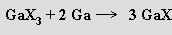
Halogenidy thallné TlX svými vlastnostmi připomínají halogenidy stříbrné (rozpustnost fluoridu, nerozpustnost a citlivost k osvětlení u chloridu, bromidu a jodidu). Působením vysokého tlaku (16 GPa) na metastabilní červenou (kubickou) modifikaci jodidu thallného TlI se z izolátoru stává kovový vodič. Zajímavou sloučeninou je TlI3 vznikající v podobě červených krystalů odpařením roztoku obsahujícího TlI a I2 v ekvimolárním poměru v koncentrované kyselině jodovodíkové. Nejde o jodid thallitý, nýbrž o trijodid thallný. Velmi stálé jsou dihalogenidy GaX2 , které je třeba formulovat jako tetrahalogenogallitany gallné GaI[GaIIIX4]. Analogická je i situace u poměrně početné skupiny nižších halogenidů india (InX2, In2Cl3, In4 X7, In5X7 a In7Br9) a thallia (TlX2, Tl2X3). Známy jsou i smíšené halogenidy typu TlI[InIIICl4].
Halogenidy gallité GaX3 a indité InX3 se podobají halogenidům hlinitým. Koordinační číslo kovu se mění v závislosti na skupenství a atomu halogenu, s halogenidy alkalických kovů tvoří komplexní anionty. Trifluoridy jsou netěkavé a mají mnohem vyšší body tání než ostatní trihalogenidy. Poměrně značná pozornost byla věnována studiu DA-komplexů MX3L, MX3L2 a MX3L3 v souvislosti se sledováním vlivu elektronové konfigurace d10 na jejich strukturu a stabilitu. Halogenidy thallité TlX3 jsou méně stálé než analogické sloučeniny gallité a indité a odlišují se od nich i chemickým chováním.
Organokovové sloučenina gallia, india a thallia byly studovány mnohem méně, než analogické sloučeniny hliníku. Trialkylderiváty MR3 (M = Ga, In, Tl) jsou nízkotající pohyblivé hořlavé kapaliny nemající sklon k dimerizaci. Jejich termická stabilita a těkavost se snižují s rostoucí atomovou hmotností kovu. Ve stejném smě ru klesá reaktivita vazby M-C, což je zvláště nápadné u sloučenin typu R2MX. Na vzduchu stabilní TlR2+X− má iontový charakter, kation TlR2+ je lineární podobně jako (i ve vodném roztoku stabilní částice) HgMe2. U india a thallia jsou známy cyklopentadienylové komplexy [M(η5-C5H5)], stabilnější je [Tl(η5-C5H5)].