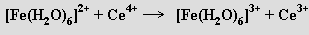
Lanthanoidy jsou stříbrobílé měkké neušlechtilé kovy (krystalují nejčastěji v nejtěsnějším hexagonálním uspořádání). Jejich nejdůležitějšími minerály jsou fosforečnan monazit (Ce,La)PO4 (obsahuje i jiné lanthanoidy než cer a také thorium) a křemičitany cerit a gadolinit. Nevyskytují se v rudných ložiscích, ale rozptýleně, takže jejich zkoncentrování a příprava v čistém stavu jsou obtížnější než u jiných kovů. Označení vzácné zeminy je dnes již neaktuální, protože moderní metody přípravy je umožňují získat v množstvích převyšujících praktickou potřebu. Ani z hlediska obsahu v zemské kůře nejsou (s výjimkou promethia) nijak vzácné (nejhojnější je cer). Výskyt lanthanoidů v přírodě klesá s rostoucím atomovým číslem a prvky s lichými atomovými čísly jsou vzácnější než se sudými. Promethium, které nemá žádný stabilní izotop (147Pm, τ1/2 = 2,6 roku), bylo nalezeno v produktech štěpení 235U (J. A. Marinsky, 1947).
Lanthanoidy jsou silně elektropozitivní kovy, v jejichž sloučeninách převažuje iontová vazebná interakce. Elektrony jsou v nich postupně doplňovány do 4f-orbitalů bez podstatnějších změn v obsazení vnějších orbitalů. V 5d-orbitalech má po jednom elektronu lanthan, gadolinium a lutecium v důsledku zvýšené stability (kulově symetrických) konfigurací f0, f7 a f14. Změna počtu elektronů v 4f-orbitalech má minimální vliv na vlastnosti těchto prvků a jejich sloučenin, protože 4f-elektrony se neuplatňují při tvorbě kovalentních vazeb a jen omezeně mohou být odštěpovány při vzniku iontů. 4f-orbitaly nejsou schopny se podílet ani na tvorbě zpětných dativních π-vazeb. Vlastnosti lanthanoidů určuje obsazení orbitalů 6s a 5d. Všechny tyto prvky tvoří poměrně objemné kationty M3+ odevzdáním dvou elektronů z orbitalu 6s a jednoho z 5d nebo 4f. Může-li vzniknout některá ze stabilních elektronových konfigurací f0, f7 nebo f14, tvoří se i ionty LnII (EuII, YbII) a LnIV (CeIV a TbIV se silnými oxidačními schopnostmi). S výjimkou Lu3+ obsahují kationty lanthanoidů nespárované elektrony a jsou proto paramagnetické a většinou rozmanitě zbarvené. Vstup elektronů do 4f-orbitalů podmiňuje lanthanoidovou kontrakci (s růstem atomového čísla se iontové poloměry snižují od La3+ k Lu3+ o 22 %). Důsledkem tohoto jevu je i značná podobnost odpovídajících si prvků na počátku druhé a třetí přechodné řady (a jejich odlišnost od prvků první přechodné řady) daná podobností iontových poloměrů. Větší variabilitu vykazují v uplatňovaných koordinačních čísel (šest až devět). Běžně se vyskytují koordinační polyedry (trigonální prizma, tetragonální antiprizma, dodekaedr), které jsou u komplexů prvků d-bloku řídké. Vazby kov-ligand jsou převážně iontové, komplexy jsou málo stabilní a ve vodných roztocích podléhají disociaci nebo rychlé výměně ligandů.
Chemické vlastnosti lanthanoidů jsou výrazně jednotvárnější než u kterékoliv jiné skupiny příbuzných prvků v periodickém systému. Podobnost sloučenin lanthanoidů je způsobena shodnými oxidačními stupni, téměř stejnými hodnotami elektronegativit a blízkými kovovými a iontovými poloměry těchto prvků. Lanthanoidy reagují s vodou za uvolňování vodíku a vzdušným kyslíkem se snadno se oxidují na bazické oxidy Ln2O3 (pouze cer tvoří oxid ceričitý CeO2 a neodym, samarium, europium a ytterbium monooxidy LnO). S vodíkem se (při 300 °C) tvoří hydridy LnH2 složené z kationtu LnIII, dvou aniontů H− a elektronu delokalizovaného ve vodivostním pásu. Při vyšším tlaku vodíku lze dosáhnout mezního složení LnH3. Halogenidy mohou mít stechiometrii LnX4 (pouze CeF4 a PrF4), LnX3 a LnX2 (získávají se redukcí LnX3 příslušným kovem). Body tání nerozpustných fluoridů LnF3 se snižují s klesajícím iontovým poloměrem lanthanoidu. Hydroxidy Ln(OH)3 nejsou amfoterní, ve vodě se velmi málo rozpouštějí a jejich součiny rozpustnosti i zásaditost klesají ve stejném směru jako body tání fluoridů. Všechny lanthanoidy tvoří rozpustné chloridy, dusičnany a sírany, prakticky nerozpustné fluoridy, oxidy, uhličitany, fosforečnany a šťavelany. Sloučeniny ceričité jsou silná oxidovadla, redoxní potenciály jsou významně ovlivněny komplexotvornými reakcemi ceričitých iontů. Oxidačních vlastností ceričitých solí v kyselém prostředí se využívá v odměrné analýze (cerimetrie) pro stanovení sloučenin železnatých, chromitých a uraničitých
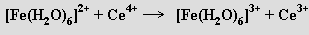
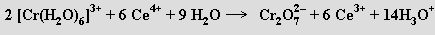

Organokovové sloučeniny nejsou příliš početné. Cyklopentadienylové komplexy jsou převážně iontové, v alkyl- a arylderivátech se uplatňují σ-vazby. Termicky jsou tyto látky poměrně stabilní, citlivé jsou vůči působení vody.
Příprava čistých lanthanoidů je náročná pro obtíže s přípravou čistých výchozích sloučenin, vysokou reaktivitu prvků i pro jejich poměrně vysoké body tání (cer 799 °C až lutecium 1663 °C). Při oddělování lanthanoidů se využívá malých rozdílů ve vlastnostech některých jejich sloučenin jako je rozpustnost (frakční krystalizace, frakční srážení, extrakce) nebo schopnost tvořit komplexy. Ionexová chromatografie využívá faktu, že těžší lanthanoidy s menším iontovým poloměrem tvoří objemnější hydratované kationty, které jsou katexy poutány slaběji než méně hydratované kationty s větším iontovým poloměrem. Nejčastěji se připravují slitiny obsahujících více lanthanoidů (většinou v nich převažuje cer) elektrolýzou roztavených solí nebo metalotermicky

Použití lanthanoidů je poměrně omezené. Asi čtvrtina produkce se spotřebuje na odstraňování kyslíku a síry z kovů a zlepšení mechanických vlastností slitin hliníku, niklu, mědi a vanadu. Slitina obsahující 50 % ceru, 25 % lanthanu a 25 % ostatních lehčích lanthanoidů se uplatňuje nejen k produkci speciálních ocelí, ale i k výrobě kamínků do zapalovačů slouží . Oxid ceričitý (1 %) se spolu s oxidem thoričitým (99 %) používal k výrobě žárových tělísek pro plynové lampy (Auerovy punčošky). Některé oxidy lanthanoidů se používají jako barvící příměsi do keramiky a skla, fosforeskující materiály pro výrobu televizních obrazovek, katalyzátory v organické chemii a aktivátory při konstrukci iontových laserů (Eu3+ umožňuje produkci viditelného, Gd3+ ultrafialového a Pr3+, Nd3+, Ho3+, Er3+, Tu3+ a Yb3+ infračerveného záření).