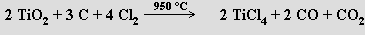
Nejběžnější titaničitou sloučeninou je oxid titaničitý TiO2. Existuje ve třech polymorfních modifikacích (ve všech má titan koordinační číslo šest), z nichž nejstabilnější je rutil (tetragonální). Brookit (orthorhombický) a anatas (tetragonální) v něj zahříváním přecházejí. Krystalová struktura rutilu je typická pro mnoho sloučenin obecného vzorce MX2 (M = kov, X = O, F), je-li poměr poloměrů kationtu a aniontu rk/ra v intervalu 0,41–0,73 (při vyšších hodnotách tohoto poměru vzniká mřížka typu fluoridu vápenatého s koordinačním číslem osm). Rutil i anatas se používají jako stabilní nerozpustné bílé pigmenty, které se připravují hydrolýzou oxid-síranu nebo chloridu titaničitého
Titan tvoří podvojné oxidy typu spinelu Mg2TiO4, ilmenitu FeTiO3 a perowskitu CaTiO3. Směsné oxidy alkalických kovů a titanu vznikají tavením oxidu titaničitého s příslušnými oxidy, uhličitany nebo hydroxidy
V roztoku se snadno hydrolyzují na hydratovaný oxid titaničitý rozpustný v kyselinách, jejich redukce vodíkem za vysoké teploty poskytuje chemicky inertní titanové bronzy NaxTiO2 (x = 0,2 až 0,25) s elektrickou vodivostí na úrovni kovů. Ze sulfidů je nejdůležitější disulfid TiIVS2 (kovově lesklý polovodič).
Je známa úplná řada halogenidů titaničitých TiX4, jejichž barva se prohlubuje s rostoucím atomovým číslem halogenu (fluorid a chlorid jsou bezbarvé, bromid oranžový a jodid tmavohnědý). Netěkavý fluorid titaničitý TiF4 se připravují působením kyseliny fluorovodíkové na příslušné chlorid titaničitý. Chlorid titaničitý TiCl4 je bezbarvá, na vzduchu dýmající těkavá kapalina, která se připravuje zahříváním rutilu s uhlíkem v proudu chloru (950 °C)
V kyselých roztocích hydrolyzuje na oxid-chlorid titaničitý TiOCl2. Chlorid titaničitý je meziproduktem při výrobě titanu i mnoha jeho průmyslově důležitých sloučenin (titanová běloba, chlorid titanitý).
Ve vodných roztocích lze v důsledku velké hodnoty poměru náboj/poloměr připravit bazické titaničité soli silných oxokyselin. Monohydrát oxid-síranu titaničitého TiOSO4.H2O obsahuje klikaté řetězce -O-Ti-O-Ti-O-, kolem nichž jsou rozloženy anionty síranové a molekuly vody. Bezvodý dusičnan titaničitý Ti(NO3)4 se připravuje působením oxidu dusičného na TiCl4 (v tetraedrické vysoce reaktivní molekule Ti(NO3)4 uplatňuje titan koordinační číslo osm, protože dusičnanové anionty v ní vystupují jako dvojvazné ligandy). Pro titaničité sloučeniny je charakteristická reakce jejich kyselých roztoků s peroxidem vodíku za tvorby intenzivně žlutě až červeně zbarvených peroxokomplexů obsahujících kationty [TiIV(H2O)x (O2)(OH)]+.
Modrý fluorid titanitý TiF3 lze připravit mnoha způsoby
Chlorid titanitý TiCl3 existuje v několika modifikacích. Červenofialový α-TiCl3 je vrstevnatý polymer (s koordinačním číslem titanu šest), který se připravuje se redukcí chloridu titaničitého vodíkem
Hnědočerný β-TiCl3 je řetězovitý polymer (rovněž s koordinačním číslem titanu šest), v němž jsou atomy titanu pospojovány trojicemi chlorových můstků. Připravuje se redukcí chloridu titaničitého organokovovými sloučeninami (trimethylalanem). Ve vodě se rozpouští na fialový roztok obsahující ionty [Ti(H2O)6]3+, které jsou rovněž součástí pevných krystalohydrátů (titanitých kamenců MITi(SO4)2.12H2O, M = Rb, Cs). Redukčních vlastností titanitých sloučenin se využívá v kvantitativní analýze (titanometrii) při odměrném stanovení sloučenin železitých, měďnatých a platičitých
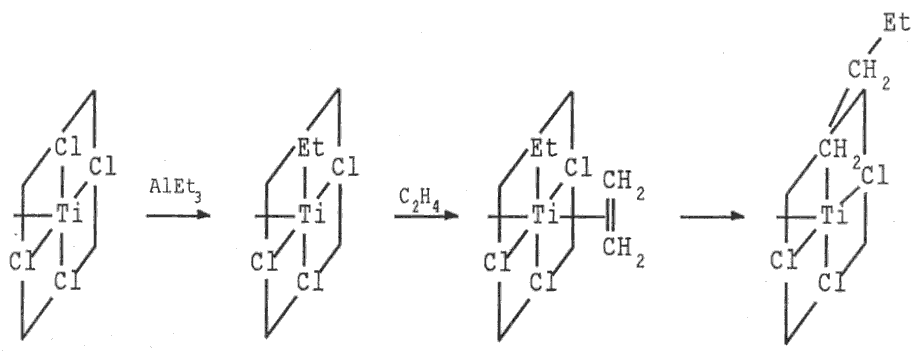
Obě modifikace chloridu titanitého (stejně jako modročerný bromid TiBr3 a fialověčerný jodid titanitý TiI3) se používají jako katalyzátory (Ziegler-Natta) při polymeracích nenasycených uhlovodíků (využívají se při výrobě polyethylenu, polypropylenu, polystyrenu, polybutadienu, polyisoprenu).
Fluorid titanatý TiF2 není schopen existence. Chlorid titanatý TiCl2 vzniká jako černý pyroforický prášek reakcí
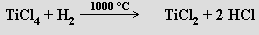
nebo výhodněji disproporcionací komplexu TiCl3 s tetrahydrofuranem (THF)
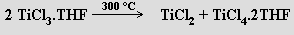
Velmi snadno disproporcionuje
a je proto obtížné ho připravit v čisté formě.