4 Názvosloví koordinačních sloučenin
4.1 Definice a základní pojmy
Koordinační sloučenina (komplex) vzniká, jestliže Lewisova báze (ligand) předá Lewisově kyselině (akceptoru) volný elektronový pár.
Koordinační sloučeninou(částicí) čili komplexem se rozumí molekula či ion, v němž jsou k atomu či iontu M vázány další atomy či atomové skupiny L tak, že jejich počet převyšuje oxidační číslo atomu M.
Vypustí-li se z této definice omezení dané oxidačním číslem atomu či iontu M, pak je možno pojmenovat podle názvoslovných pravidel pro koordinační sloučeniny každou sloučeninu vytvořenou připojením (adicí) jednoho či několika iontů (molekul) k jednomu či více iontům (molekulám), tedy i mnohé známé jednoduché anorganické sloučeniny. Tím se zamezí rozmanitostem v názvech i zbytečným názvoslovným sporům. Proto se doporučuje používat názvoslovných pravidel koordinačních sloučenin pro co nejširší okruh anorganických sloučenin. Připouští se však, že by nebylo účelné používat tohoto názvosloví v těch případech, kdy plně a hlavně jednoznačně postačí jednodušší názvy racionální (např. u jednoduchých solí). Je třeba výslovně zdůraznit, že použití názvoslovných pravidel koordinačních sloučenin pro sloučeniny jednoduché nemusí nutně znamenat i jejich vzájemnou strukturní analogii se sloučeninami koordinačními.
Při formulaci názvoslovných pravidel koordinačních sloučenin se používá základních pojmů, jež mají následující význam:
Atom (či ion) M ve smyslu výše uvedeném se nazývá centrální (středový) atom či ion.
Centrální atomy bývají nejčastěji atomy nebo ionty přechodných kovů, které mohou do svých neobsazených valenčních orbitalů přijmout volné elektronové páry – jsou tedy akceptory elektronů
Příklady:
Uvedené ionty Fe3+ a Pt2+ mohou být centrálními atomy, neboť disponují neobsazenými valenčními orbitaly:
| 3d5 | 4s0 | 4p0 | ||
| Fe3+ | [Ar] | |||
| 5d8 | 6s0 | 6p0 | ||
| Pt2+ | [Xe] | |||
Atomy vázané k atomu M jsou atomy donorové či koordinující.
Částice L obsahující jeden nebo více donorových atomů nebo vázaná k M jako celek bez možnosti specifikacedonorového či donorových atomů se nazývá ligand.
Ligandy jsou buď elektroneutrální molekuly nebo atomové skupiny, jako např. H2O, CO, NO, NH3, nebo anionty, např. F-, Cl-, S2-, OH-, CN-, SCN-, NO3-, apod., které obsahují atom s volným elektronovým párem (donorovým elektronovým párem), nebo s více donorovými páry. Ligandem může být také molekula organické látky s násobnými vazbami. Funkci donorových elektronových párů pak hrají p-elektrony násobných vazeb.
Příklady:
V komplexním kationtu [Cu(NH3)4]2+ je centrálním atomem ion Cu2+ a ligandy jsou molekuly NH3. Donory elektronových párů (donorové atomy) jsou atomy dusíku čtyř molekul amoniaku:
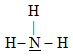
V komplexním aniontu [Fe(CN)6]3– je centrálním atomem Fe3+ a ligandy anionty CN-. Donory elektronových párů (tj. donorové atomy) jsou atomy uhlíku šesti iontů CN-:
![]()
| V koordinační molekule látky nazývané bis(benzen)chrom není možno určit konkrétní donorové atomy, protože ligand – nenasycený uhlovodík (benzen) – je k centrálnímu atomu (Cr) vázán jako celek pomocí p-elektronů násobných vazeb. | 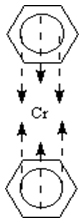 |
Centrální atom M je charakterizován koordinačním číslem. To je rovno počtu donorových atomů vázaných k M. U částic s nespecifikovaným donorovým atomem lze za koordinační číslo atomu či iontu M považovat počet částic (tj. ligandů) vázaných k němu jako celek. Nejčastějšími koordinačními čísly bývají 4 a 6, méně frekventovaná jsou koordinační čísla 2, 3, 5, 7, 8 a 12.
Příklady:
V komplexním kationtu [Cu(NH3)4]2+ je koordinační číslo mědi 4. Donory elektronových párů (donorové atomy) jsou atomy dusíku čtyř molekul amoniaku: |
4.jpg) |
V komplexním aniontu [Fe(CN)6]3- je koordinační číslo železa 6. Donory elektronových párů (tj. donorové atomy) jsou atomy uhlíku šesti iontů CN–: |
6.jpg) |
V komplexním kationtu [Cu(NH2CH2CH2NH2)2]2+ je koordinační číslo mědi 4, avšak počet ligandů je 2. Donory elektronových párů (donorové atomy) jsou všechny 4 atomy dusíku: |
2.jpg) |
V koordinační molekule látky nazývané bis(benzen)chrom je koordinační číslo chromu 2. |
 |
Částice s jedním donorovým atomem se nazývá jednovazný nebo monodonorový ligand.
Příklad:
Molekula NH3. Donor elektronového páru (donorový atom) je pouze atom dusíku:
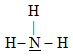
Obsahuje-li ligand více donorových atomů, pak se označuje jako vícevazný nebo polydonorový.
Příklad:
Molekula NH2CH2CH2NH2. Donory elektronového páru (donorové atomy) jsou dva atomy dusíku.
Chelátový ligand je ligand vázaný k jednomu a témuž centrálnímu atomu či iontu dvěma či více donorovými atomy. Koordinační sloučenina obsahující chelátový ligand se nazývá chelát.
Příklad:
MolekulaNH2CH2CH2NH2 se v komplexním kationtu [Cu(NH2CH2CH2NH2)2]2+chová jako chelátový ligand: Komplexní kation [Cu(NH2CH2CH2NH2)2]2+ je příkladem chelátu. |
2.jpg) |
Můstkový ligand se váže k více než jednomu centrálnímu atomu či iontu.
Příklad:
Anion OH- se v komplexním kationtu [Fe2(H2O)8(OH)2]4+ chová jako můstkový ligand: |
8(OH)2.jpg) |
Koordinační sloučenina s větším počtem centrálních atomů či iontů se nazývá vícejaderný (polycentrický, polynukleární) komplex. Počet centrálních atomů či iontů v takovéto koordinační částici se označuje pojmem dvojjaderný (bicentrický, binukleární), trojjaderný (tricentrický, trinukleární),… komplex.
Příklad:
Kation [Fe2(H2O)8(OH)4]4+ je dvojjaderný komplex.
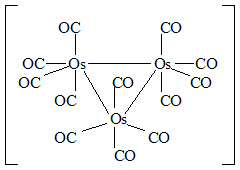
Koordinační částice, v nichž atomy kovů jsou navzájem přímo vázány vazbou kov-kov a zároveň se váží s ligandy, se označuje „cluster“ (čti „klastr“).
Příklad:
Sloučenina nazývaná dodekakarbonyltriosmium je příkladem klastru (a současně také trojjaderného komplexu):
PdF, Pedagogická fakulta, Masarykova univerzita
Návrat na úvodní stránku webu, nahoru
Technická spolupráce:
Servisní středisko pro e-learning na MU
Fakulta informatiky Masarykovy univerzity, 2009
