Kontakt: Zdeněk Moravec, hugo@chemi.muni.cz; A12/316
Cvičení se koná v NMR laboratoři A8/1S16.
| Bruker Avance III 300 MHz | Bruker Avance III HD 500 MHz |
|---|---|
 |
 |
Seznámení s NMR laboratoří
Základní aspekty měření pulzních NMR spekter:
Měření a interpretace 1H NMR spekter
Měření a interpretace 13C NMR spekter, APT, 11B a 19F NMR, v případě zájmu i dalších jader.

Umožňuje odvodit počet a intenzitu pásů v multipletu vzniklém spin-spinovou skalární inetrakcí.

| Měření | |
|---|---|
| ej | Zapnutí vzduchu pro vložení/vyjmutí vzorku |
| ij | Vypnutí vzduchu pro vložení/vyjmutí vzorku |
| lock | Spuštění lockování vzorku, nutno vybrat správné rozpouštědlo (spouštíme při změně vzorku nebo teploty) |
| atma | Automatic tuning/matching (spouštíme při změně vzorku, teploty nebo měřeného jádra) |
| topshim | Spuštění topshimu (spouštíme při změně vzorku nebo teploty) |
| rga | Automatické nastavení zesílení |
| zg | Spuštění měření |
| halt | Zastavení měření |
| stop | Nouzové ukončení měření - neuloží spektra |
| Nastavení měření | |
| d1 | Nastavení D1 (prodleva mezi skeny) [s] |
| sw | Nastavení šířky měřícího okna [ppm] |
| o1p | Nastavení středu měřícího okna [ppm] |
| ds | Počet slepých skenů |
| ns | Počet skenů |
| Zpracování spekter | |
| efp | Transformace FIDu na spektrum |
| t | Zobrazení spektra v průběhu měření |
| apk | Automatická fázová korekce |
| .ph | Manuální fázová korekce |
| .all | Zobrazení celého spektra |
| .md | Zobrazení více spekter přes sebe |
| Rozpouštědlo | Vzorec | 1H | 13C | Teplota tání | Teplota varu |
|---|---|---|---|---|---|
| Aceton | CD3COCD3 | 2,05 | 29,92; 206,68 | -94 | 56,5 |
| Acetonitril | CD3CN | 1,94 | 1,39; 118,69 | -45 | 81,6 |
| Benzen | C6D6 | 7,16 | 128,39 | 5,5 | 80,1 |
| Chloroform | CDCl3 | 7,21 | 77,23 | -63,5 | 61-62 |
| Dichlormethan | CD2Cl2 | 5,32 | 54,00 | -95 | 39,75 |
| Dioxan | C4D8O2 | 3,53 | 66,66 | 11,8 | 101,1 |
| N,N-Dimethylformamid | (CD3)2NCDO | 2,75; 2,92; 8,03 | 1,9 | -61 | 153 |
| DMSO | (CD3)2SO | 2,50 | 39,51 | 18,55 | 189 |
| Ethanol | CD3CD2OD | 1,11; 3,56; 5,19 | 17,31; 56,96 | -114,1 | 78,5 |
| Kyselina octová | CD3COOD | 2,04; 11,65 | 20,0; 178,99 | 16,7 | 118 |
| Methanol | CD3OD | 3,31; 4,78 | 49,15 | -97,8 | 64,7 |
| Pyridin | C5D5N | 7,22; 7,58; 8,74 | 123,87; 135,91; 150,35 | -41,6 | 115 |
| THF | (CD2)4O | 1,73; 3,58 | 25,37; 67,57 | -108,5 | 66 |
| Toluen | C6D5CD3 | 2,09; 6,98; 7,00; 7,09 | 20,4; 125,49; 128,33; 129,24; 137,86 | -95 | 110,6 |
| Voda | D2O | 4,7 | - | 3,81 | 101,42 |
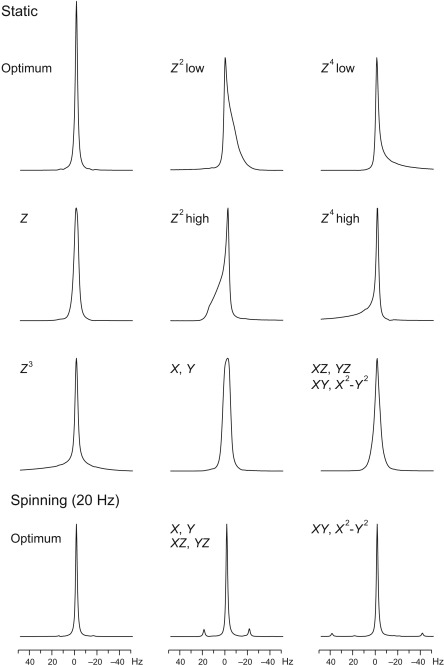
Správné shimování je nutné pro získání kvalitního spektra. Standardně se využívá automatický proces topshim, který ale občas nedokáže spektrometr naladit dokonale. Následující obrázek ukazuje deformace linií způsobené špatným shimováním.
Ruční shimování lze provést pomocí záložky Shim v BSMS panelu, který otevřete pomocí příkazu bsmsdisp. Nejprve se shimuje Z a Z2 a poté X a Y, během ladění se snažíme dostat zelenou čáru na panelu Lock co nejvýše.