Etiopatogeneze a patofyziologie roztroušené sklerózy
Etiopatogeneze RS není dosud zcela uspokojivě objasněna, předpokládá se vliv genetických a environmentálních faktorů (Ebers, 1995). V současné době je plausibilní teorie genetického nastavení organismu a onemocnění je spuštěno vlivem určitých vnějších faktorů (Ebers, 2007), nelze opomenout také vlivy epigenetické a stochastické (Sadovnic et al., 2012).
Environmentální faktory
Mezi nejvýznamnější environmentální faktory řadíme
Virové infekce
Za nejdůležitější jsou považovány virové infekce, které často předchází začátek nebo další atace nemoci. Infekce virem spalniček nebo virem Epsteina-Barrové (EBV) může vyvolat akutní diseminovanou encefalomyelitidu, způsobit demyelinizaci a poškození nervů (Ebers, 1998). Tato teorie je podporována též pozitivitou tzv. MRZ (M-morbilli, R-rubella, Z-varicella zoster) reakce v nálezech mozkomíšního moku. Jedná se o syntézu specifických antivirových protilátek proti neurotropním virům spalniček, zarděnek a neštovic.
Tyto viry se však v populaci vyskytují běžně, jejich přímý vztah k RS je tedy zpochybňován.
| Infekční etiologie RS: Možné kandidátní mikroorganismy | ||
|
||
V aktivaci choroby virovými infekcemi se pravděpodobně uplatňuje několik mechanismů (Ebers, 1998):
- Aktivace superantigenem, kterým virové a bakteriální produkty mohou navodit aktivaci T-lymfocytů.
- Zkřížená reaktivita mezi infekčním antigenem a vlastní tkání – tzv. molekulární mimikry. Byla nalezena zkřížená reaktivita mezi fragmenty viru hepatitis B, chřipkových antigenů a myelinovým bazickým proteinem (MBP), dále antigenů EBV a proteolipoproteinem (PLP).
- Aktivace T-lymfocytů vlastními antigeny, vzniklými zánětlivým procesem nebo štěpením, které nejsou za normálních okolností vystaveny imunitní kontrole – tzv. bystander aktivací. Bylo prokázáno, že alfa B-crystallin, který vzniká štěpením myelinu a není za normálních okolností dostupný rozpoznání imunitnímu systému, navozuje výraznou aktivaci T-lymfocytů.
Epstein-Barrové virus a riziko rozvoje RS
Jedná se o neurotropní virus, který se reaktivuje se stresem. Vyskytuje se s vysokou prevalencí v běžné populaci.
Byla provedena řada studií prokazující možný vliv EBV v etiologii RS (Ascherio et al., 2000; Lang et al., 2002; Levin et al., 2003; Levin et al., 2005; Levin et al., 2010; Sundstrom et al., 2004). Ascherio prokázal seropozitivitu EBV u více než 99 % RS pacientů ve srovnání s kontrolním souborem, kde byla nalezena pouze v 90 % (Ascherio et al., 2000). Dále byly prokázány protilátky proti antigenu EBV v mozkomíšním moku nemocných s RS (Bray et al., 1992; Cepok et al., 2005) a vyšší počet autoimunitních T-buňek u nemocných RS schopných rozpoznat EBV ve srovnání s kontrolními jedinci (Ascherio et al., 2001; Lang et al., 2002). Bylo také zjištěno nízké riziko rozvoje RS u lidí, kteří nikdy neprodělali infekci EBV (Thacker et al., 2006), naopak zvýšené riziko rozvoje RS, přetrvávající až 3 desetiletí bylo nalezeno po infekci mononukleózou (symptomatickou infekci EBV) (Nielsen et al., 2007).
Možný mechanismus ovlivnění rozvoje RS virem EBV není dosud objasněn. Předpokládá se mechanismus molekulárních mimiker, tj. zkřížená reaktivita mezi antigeny EBV a PLP (Lang et al., 2002; van Sechel et al., 1999) a bystander aktivace (Pender et al., 2003).
| Stát | RS pacienti | Non-RS |
| Kanada1 | 83 % (n=30) |
42 % (n=143) <0,001 |
| Mnohonárodnostní unie2 | ~80 % (n=72) |
40 % (n=69) P<0,05 |
| Německo3 | 98,6 % (n=147) |
72,1 % (n=147) P<0,001 |
Tab. 1 – Studie v pediatrii: Epstein-Barrové seropozitivita je zvýšena u nemocných s RS
(Zdroje: Alotaibi S et al. JAMA 2004; 291: 1875-79 | Banwell B et al. ECTRIMS 2004, Vienna, P280; 3 Pohl D et al. Neurology 2006; 67: 2063-65.)
Herpetické viry – Human herpesvirus type 6 (HHV 6) a riziko rozvoje RS
Jedná se o ubikvitární virus, který se vyskytuje až s 90% prevalencí v populaci. Jako ostatní neurotropní viry může vyvolat akutní encefalomyelitidu, navodit demyelinizaci a poškození axonů. Integruje se do hostitelského genomu a reaktivuje za určitých okolností, např. stresem.
Byl prokázán v oligodendrocytech v plakách RS ale též v CNS lézích jiné etiologie, např. ischemických. Jeho úloha v etiopatogeneze RS není dosud objasněna, byly prokázány zvýšené titry HHV-6 protilátek u RS, výsledky asociačních studií jsou však nejednoznačné (Ablaschi et al., 2000; Sanders et al., 1996; Soldan et al., 1997). Pozitivní asociace byla nalezena u 50 % RS studií a u 78 % studií, pokud byl testován zvlášť aktivní a latentní virus (Ablaschi et al., 2000).
Sluneční záření a nedostatek vitamínu D3
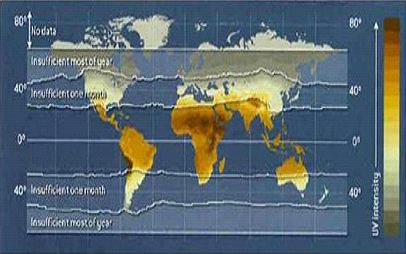
Dalším důležitým zevním rizikovým faktorem je nedostatek vitaminu D3, který se spolupodílí v imunitních regulacích (Munger et al., 2006). Ve studii experimentální alergické encefalomyelitidy (EAE) na myších bylo zjištěno, že aktivní metabolit vitaminu D3, calcitrol je silným inhibitorem EAE. Jeho podání těžce postiženým myším vedlo ke zlepšení tíže postižení (Cantorna et al., 1996). Hypotéza o souvislosti nedostatku vitaminu D3 s rizikem rozvoje RS v určité geografické oblasti je podložena narůstající prevalencí onemocnění se zvyšující se vzdáleností od rovníku.
Dochází k nedostatečné produkci vitaminu D3 vzhledem k nízké intenzitě slunečního záření, zejména v zimních měsících (Jablonski and Chaplin, 2000) (Obr. 3). V přímořských oblastech, kde je zajištěn vyšší příjem vitaminu D3 potravou se prevalence onemocnění snižuje (Presthus, 1960) (Obr. 4).
|
Nedostatek vit. D > 6 měsíců/rok Nedostatek vit. D 1–6 měsíců/rok Dostatek vit. D celý rok Nedostatek vit. D 1–6 měsíců/rok Nedostatek vit. D > 6 měsíců/rok |
|
| Obr. 3 – Počet měsíců v roce, během kterých není produkován dostatek vitaminu D3 vzhledem k nízké intenzitě slunečního záření. | |
| A – Finnmark (2003) | >83 |
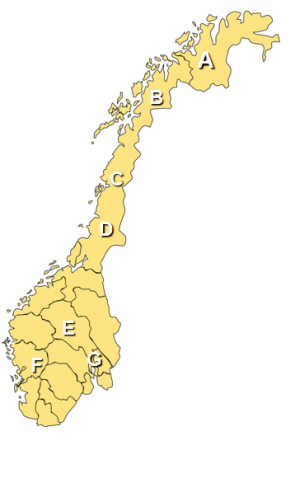
|
| B – Troms (2003) | >104 | |
| C – Nordland (1999) | 106 | |
| D – Nord Trøndelag (1999) | 164 | |
| E – Oppland (2002) | 190 | |
| F – Hordaland (2003) | 151 | |
| G – Oslo (2005) | 154 | |
| Obr. 4 – Prevalence RS onemocnění v jednotlivých oblastech Norska (/105)
Prevalence RS v Norsku nevzrůstá se zvyšující se zeměpisnou šířkou jako v ostatních zemích Evropy a USA.
|
||
| Biologické a imunomodulační účinky vitaminu D3 | ||
Vitamin D3 je významný imunomodulátor
|
||
Chronický nedostatek vitaminu D3 v potravě a slunečního záření, zejména v zimních měsících může zvýšit riziko rozvoje některých chronických onemocnění, zejména autoimmunitních onemocnění, jako RS, revmatoidní arthritis, diabetes mellitus typu I, dále rakoviny a afektivních onemocnění (Holick, 2004).
Proto je velmi důležité věnovat dostatečnou pozornost optimální suplementaci vitaminem D3. V současné době probíhá řada studií k objasnění této problematiky. Bylo zjištěno, že současná doporučená denní dávka 400 IU vitaminu D3 pro dospělé je velmi nízká a nedostatečná pro zachování cirkulujících hladin 25(OH)D3 v krvi a biologických funkcí vitaminu D. Bylo prokázáno, že v zimních měsících při nedostatečné expozici slunečního záření je potřeba suplementovat dávkou vitaminu D3 až 1000 IU/den, aby byla hladina v krvi zachována (Heaney et al., 2003) (Obr. 5).
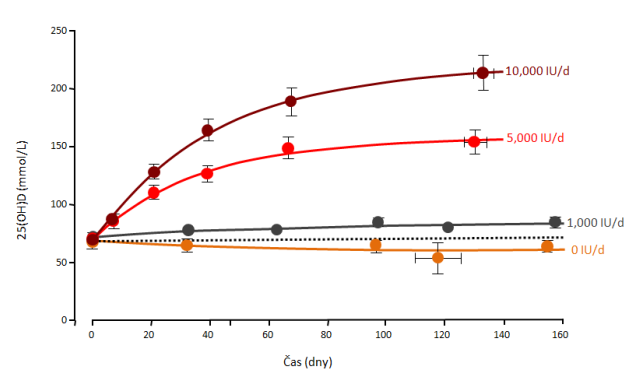
Obr. 5 – Cirkulující hladiny 25(OH)D3 ve vztahu k perorálnímu příjmu vitaminu D3
(Heaney RP et al. Am J Clin Nutr 2003; 77: 204–210)
| Prekursor vitaminu D- (7-dehydrocholesterol) je vlivem slunečního záření aktivován na aktivní metabolit 1,25-dihydroxycholecalciferol (1,25-dihydroxy vitamin D3). |
 |
| Obr. 6 – Metabolizmus vitaminu D3 | |
Stres
Stres, zejména chronický, hraje významnou roli v aktivaci imunitního systému a je dalším rizikovým faktorem rozvoje a progrese RS. Je prokázáno, že nervový, imunitní a endokrinní systém se navzájem ovlivňují (Ebers, 1998).
Sociální a kulturní faktory
Byla vyslovena řada teorií o souvislosti výskytu RS s různým typem výživy, především změnou skladby potravy v poměru omega-3 a omega-6 nenasycených mastných kyselin, přítomností chemikálií, vlivu hygienických podmínkek a urbanizace. Žádná z těchto teorií však nebyla potvrzena.
Genetické faktory
První genetické výzkumy vycházely z epidemiologických poznatků o familiárním výskytu RS (Tab.2). Nejčastěji jsou postiženi sourozenci nemocných. Jednovaječná dvojčata mají až 30% pravděpodobnost onemocnění, dvouvaječná 5% (Cree, 2008) (Tab.3). Identická dvojčata mají nejvyšší riziko, dvouvaječná dvojčata mají vyšší riziko než sourozenci, neboť se uplatňují společné gestační a zevní vlivy.
| Příbuzenský vztah | Riziko onemocnění RS |
| Výchozí pravděpodobnost výskytu v populaci | 1/1000 |
| Bratranec s RS | 7/1000 |
| Vlastní sourozenec | 35/1000 |
| HLA-identický sourozenec | 80/1000 |
| Jednovaječná dvojčata | 170/1000 |
Tab. 2 – Zvýšení rizika onemocnění RS u příbuzných z důvodu sdílení společných genů.
(Ebers G, MS Forum 2007; Modern Management Workshop, Wiesbaden)
| Země | Pravděpodobnost onemocnění RS |
| Kanada, Dánsko, Finsko, VB, USA4 | MZ = 25–30 % DZ = 3–5% |
| Francie4 | MZ = 5.9 % DZ = 3% |
| Itálie5 | MZ = 14.5 % DZ = 4% |
Tab. 3 – Pravděpodobnost onemocnění u jednovaječných a dvouvaječných dvojčat.
(Zdroje: Willer CJ et al. PNAS 2003; 100: 12877-82 | Ristori G et al. Ann Neurol 2006; 59: 27-34.)
Nejedná se o klasickou monogenní, ale multifaktoriální dědičnost. Na spuštění autoimunitního procesu se pravděpodobně podílí velké množství tzv. malých genů, pravděpodobně okolo 80 a jejich kombinace, které podmiňují vysokou interindividuální variabilitu choroby (Ebers, 1995). Primární roli v patogeneze RS hraje pravděpodobně geneticky determinovaná imunitní odpověď. Nejvíce studií se zaměřilo na asociaci této choroby s geny pro lidské leukocytární antigeny (HLA). Geny HLA I. a II. třídy jsou umístěny na krátkém raménku 6. chromosomu. Kódují buněčné povrchové proteiny, které hrají zásadní roli v iniciaci imunitní odpovědi a zejména v prezentaci antigenů CD4+ a CD8+ T-lymfocytům. Geny I třídy-(HLA-A, HLA-B, HLA-C) kódují antigeny, které jsou integrální součástí plasmatické membrány jaderných buněk a prezentují peptidové antigeny cytotoxickým CD8+ buňkám. Geny II třídy (HLA-DP, HLA-DQ, HLA-DR) jsou primárně exprimovány zejména na B-lymfocytech, makrofázích, aktivovaných T-lymfocytech a dendritických buňkách.
Alely DRB1*1501, DRB5*0101 a DQB1*0602 přispívají k rozvoji RS zvýšením prezentace peptidů myelinu T lymfocytům. Bylo prokázáno, že T-cell receptor (TCR) pacientů s RS rozpozná rezidua 85–99 myelinového bazického proteinu kódovaného DRB1*1501 a peptidu viru Epstein-Barre (EBV) kódovaného DRB5*0101, což podporuje teorii molekulárních mimiker (Lang et al., 2002).
V rozsáhlých, tzv. genome-wide asociačních studiích (GWAS), provedených v evropské populaci byla prokázána asociace RS s HLA- DRB5*0101- DRB1*1501- DQA1*0102- DQB1*0602 haplotypem, zejména s alelou HLA- DRB1*1501 (Lincoln et al., 2005; Prat et al., 2005; Sadovnic 2012; Schmidt et al., 2007; Jersild et al., 1972). Nosiči tohoto haplotypu mají trojnásobně zvýšené riziko rozvoje onemocnění, u homozygotů dokonce šestinásobné.
Metaanalýzou asociačních studií (GWAS) v souboru 9 772 nemocných a 17 376 kontrolních jedinců v evropské populaci, ve které bylo vyšetřeno 465 434 polymorfizmů, byla potvrzena asociace RS s alelou HLA-DRB1*1501 se shodnou frekvencí v různých populacích (p=1x10–320, OR=3.1) (Sawcer et al., 2011). Například Masterman popsal ve švédské populaci její přítomnost v 61 % u RS ve srovnání s 31 % v kontrolním souboru (p = 0.0001, OR = 3.5). Shodné nálezy byly popsány také ve studiích u jiných etnických skupin, např. v Japonsku nebo v populaci středního východu (Schmidt et al., 2007). Současně byl prokázán protektivní efekt alely HLA-A*02 ve třídě HLA I. Bylo zjištěno také 29 dalších suspektních genetických polymorfismů.
U neevropské populace byla nalezana také asociace s odlišnými alelami HLA- DRB1, například ve studii na Sardinii byla zjištěna asociace s alelami HLA- DRB1*1501, DRB1* 0301 a DRB1*0405 (Marrosu et al., 1997).
Geny mimo oblast HLA se také podílí na rozvoji a progresi onemocnění. Mezi kandidátní geny řadíme geny kódující cytokiny – CXCR5, IL2RA, iL7R, IL7, IL12RB1, L22RA2, IL12A, L12B, IRF8, TNFR, kostimulační molekuly – CD37, CD40, CD58, CD80, CD86, CLECL1, signální molekuly – CBLB, GPR65, MALT1, TYK2.
V současné době jsou známy výsledky několika mezinárodních asociačních studií. Vyšetřením celého genomu u 931 rodin byla prokázána asociace s polymorfizmy genů CD25 a CD127 kódujících IL-2R alfa a IL-7R alfa (Hafler et al., 2007), kódujících cytokiny a jejich receptory, které mohou ovlivnit zánětlivý proces v RS plakách. Ovlivňují regulaci a přežívání T lymfocytů a významnou měrou se podílí v patogenezi onemocnění (Gregory et al., 2007).
Gen CCR5 pro chemokinový receptor je umístěn na chromosomu 3p21-24. Jeho mutace 32CCR5 je přítomna asi u 7 % bělochů. Může zpomalit progresi a tíži onemocnění. Gen pro APOE4 je umístěn na chromosomu 3p21-24. Navodí agresivnější destrukci tkáně a rychlou progresi postižení. Gen pro osteopontin je umístěn na chromosomu 4q21-q25, je spojen s vyšším rizikem přechodu do sekundární progrese, má funkci chemotaktickou a prozánětlivou. Gen pro IFNγ je umístěn na chromosomu 12q14, zvyšuje riziko rozvoje RS u mužů.
Bylo nalezeno několik kandidátních genetických polymorfismů v oblasti HLA II – rs3135388, rs2395182, rs2239802, rs2227139, rs2213584 (Sombekke et al., 2009). Genetický polymorfismus rs 3135388 je markerem alely HLA-DRB1*1501, senzitivita činí 96.4 %, specifita 99 % 2 (de Bakker et. al., 2006).
Důležitou roli hraje také interakce mezi HLA- DRB1*1501 a zevními faktory, například virem EBV nebo herpetickými viry (De Jager et al., 2008; Sadovnic et al., 2012). HLA geny ovlivňují prezentaci antigenů zmíněných virů a jeví se, že vzájemná interakce může ovlivnit vnímavost jedince k RS. Zvýšená virová zátěž nebo změna prezentace EBV, které zkříženě reagují s buněčnými antigeny, mohou spustit patogenní proces prostřednictvím molekulárních mimiker (Niller et al., 2011; Sundström et al., 2009).
Patofyziologie roztroušené sklerózy
RS je komplexní onemocnění, v jehož patofyziologii se podílí několik procesů. Jedná se o zánětlivé postižení CNS s mnohočetnými zánětlivými infiltráty, demyelinizaci, postižení šedé hmoty s následnou atrofií, astrogliózu a axonální degeneraci (Hartung et al., 2004). Tyto procesy však nejsou univerzálně zastoupeny u jednotlivých pacientů, proto je klinický obraz a prognóza onemocnění rozdílná. Zánětlivé postižení CNS je považováno za klíčové pro aktivitu onemocnění a formaci akutních lézí. V těchto aktivních lézích nacházíme aktivované T-lymfocyty, především cytotoxické, aktivovanou mikroglii, makrofágy a plazmatické buňky. Nositelem imunologické specifity jsou lymfocyty, které jsou schopné svými antigen-specifickými receptory rozpoznat příslušný antigen a zahájit specifickou imunitní reakci. Za normálních okolností je cizí antigen nejdříve zpracován antigen-prezentující buňkou monocyto-makrofágové řady, zkompletován s molekulou hlavního histokompatibilního systému (MHC) a následně prezentován specifickým T-lymfocytům. Pokud T-lymfocyt antigen rozpozná, dojde k jeho aktivaci, další diferenciaci s následnou klonální proliferací. Aktivované lymfocyty produkují cytokiny. Jedná se o solubilní proteiny nebo glykoproteiny, které slouží jako chemické nástroje komunikace mezi buňkami. Koordinují interakce buněčné a protilátkové imunity a násobí imunitní reaktivitu. Mezi cytokiny řadíme interferony (IFN), interleukiny (IL) a tumor nekrotizující faktory (TNF). Za nejdůležitější je považován IL-2, který je nezbytný pro proliferaci imunokompetentní buňky. Aktivované T-lymfocyty produkují dále IFN. Jedná se o imunoregulační proteiny tvořené jako odpověď na virovou stimulaci, které jsou schopny navodit rezistenci vůči virům v okolní tkáni. Velmi důležitou roli hraje IFNγ, který navozuje zvýšenou prezentaci antigenu a produkci TNF v makrofázích. TNF byl poprvé popsán jako cytokin monocyto/makrofágové řady, který je schopný prostým kontaktem poškozovat myelin.
Podle povrchového znaku se T-lymfocyty dělí na CD4+ a CD8+T lymfocyty. Lymfocyty nesoucí povrchový znak CD4+ rozdělujeme podle spektra cytokinů, které produkují na subpopulaci Th-1, Th-2 a Th-17. Cytokiny, které jsou produkovány subpopulacemi Th-1 (IL-2, IL-12, IFNγ, TNFα) a Th17 (IL-17, IL-6, IL-21, IL-22, IL-23, TNFα) jsou prozánětlivé a jsou považovány za rozhodující v iniciaci a udržování imunopatologické zánětlivé buněčné reakce, naopak Th-2 cytokiny (IL-4, IL-10, IL-13, TGFβ, IL-5, IL-35) jsou protizánětlivé a tlumí zánětlivou reakci. T-lymfocyty svou aktivací zahájí spolupráci také s B-lymfocyty, které se transformují v plazmatické buňky, produkující protilátky. Tyto se také významně podílí na destrukci myelinu.
K aktivaci a klonální proliferaci autoagresivních CD4+ T-lymfocytů a cytotoxických CD8+ T-lymfocytů dochází na periferii. Jedná se o autoimunitní odpověď přímo proti CNS antigenům, zejména MBP, myelinovému asociovanému glykoproteinu (MAG), myelinovému oligodendrocytárnímu glykoproteinu (MOG), PLP a sekundárním autoantigenům, u kterých nacházíme podobnou sekvenci aminokyselin jako u některých virů, např. herpetických (Obr. 8, 9).
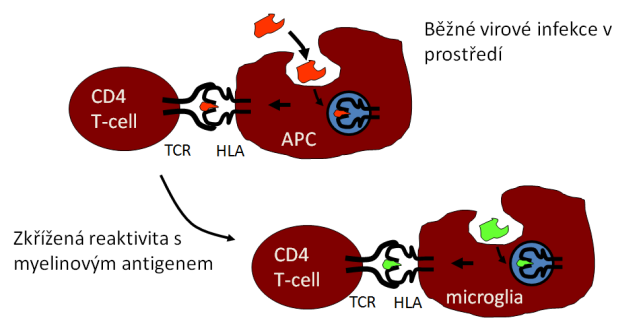
Obr. 8 – Molekulární mimikry u RS
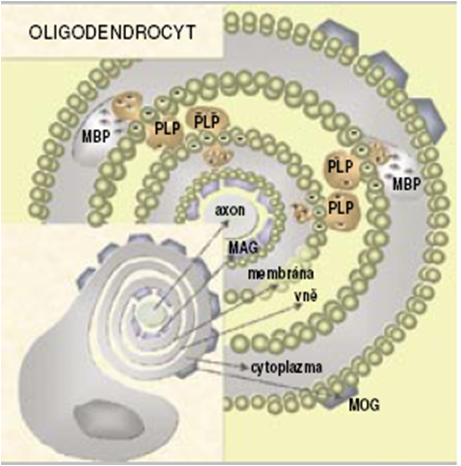
Obr. 9 – Autoimunitní odpověď proti CNS antigenům (MBP, MAG, MOG, PLP)
Aktivované T-lymfocyty a B-lymfocyty migrují přes hematoencefalickou bariéru (HEB) do CNS, zde dochází k jejich další klonální proliferaci, atrahují makrofágy, dochází k aktivaci mikroglie, B-lymfocytů, produkci protilátek, zánětlivých mediátorů, chemokinů a cytokinů (Martin et al., 2000). Bylo zjištěno, že patologie RS lézí je značně heterogenní u jednotlivých pacientů a mění se v závislosti na průběhu onemocnění (Lee et al., 1999; Lucchinetti et al., 2000). Liší se velikostí, lokalizací, stupněm poškození myelinu, oligodendrocytů a charakterem zánětlivého infiltrátu. Histopatologicky lze RS léze rozdělit do čtyř vzorců. I. a II. vzorec je charakterizován infiltrací T-lymfocytů a T-lymfocytů a protilátek, zatímco III. a IV. vzorec apoptózou a primárním postižením oligodendrocytů (Lucchinetti et al., 2000) (Obr. 10).
| Vzorec I | T-lymfocyty navozená encefalomyelitis |
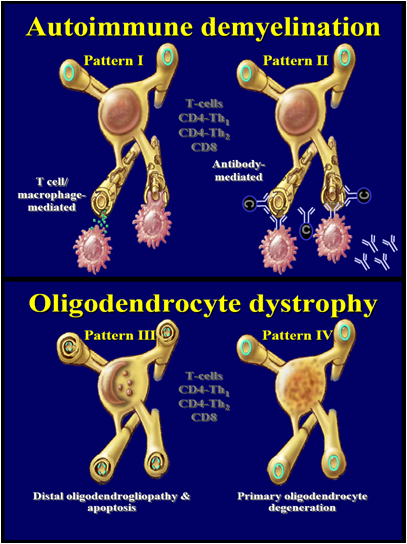
|
| Vzorec II | T-lymfocyty a protilátkově navozená encefalomyelitis | |
| Vzorec III | distální oligodendrogliopatie a apoptóza | |
| Vzorec IV | primární degenerace oligodendrocytů | |
| Obr. 10 – Heterogenita RS lézí | ||
V ložisku zánětu dochází k rozpadu myelinu a postižení axonů (Obr. 11 a 12). K axonálnímu postižení, tzv. transsekci axonů dochází již v akutní fázi onemocnění a to v různé míře u jednotlivých pacientů. Toto potvrzují nálezy z biopsií a na MRI spektroskopii. Ničení nervových vláken vede k trvalému neurologickému postižení a probíhá několika mechanismy. Je prokázáno, že stupeň axonálního postižení koreluje s mírou zánětu, který převažuje v počátečních stadiích nemoci. Demyelinizované vlákno ztrácí schopnost vedení elektrického vzruchu, exprimuje na svém povrchu molekuly MHC I třídy a dochází k jeho přerušení CD8+ T-lymfocyty. Dalším mechanismem je proces přesouvání iontových kanálů a tvorba kanálů nových u chronicky demyelinizovaných axonů. Tento energeticky náročný proces vlákno vyčerpává a vede k jeho zániku. V pozdní fázi onemocnění dochází k pomalému, pozvolnému postižení axonů, i když nejsou přítomny známky zánětu (Brusk, 2005; Bruck, 2007). Dochází však také k primární axonální degeneraci nezávisle na stupni zánětlivého postižení, jejíž etiopatogeneza není dosud uspokojivě objasněna. (Bruck, 2005; Bruck, 2007).
Pokud dojde ke snížení zánětlivé aktivity, může dojít k reparaci myelinu díky přítomnosti prekurzorů a aktivitě zbylých oligodendrocytů, které obnoví tvorbu myelinu, který je však méně kvalitní. Při opakovaném vzplanutí zánětu ve stejné lokalizaci schopnost remyelinizace klesá.

Obr. 11 – Schematické znázornění normálně myelinizovaného axonu
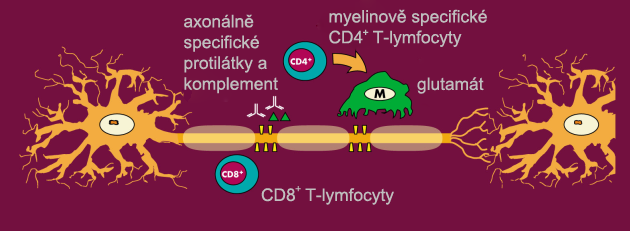
Obr. 12 – Axonální poškození v průběhu demyelinizace
Migrace autoagresivních zánětlivých buněk do CNS přes HEB, která není za normálních okolností propustná pro lymfocyty a další buňky imunitního systému, má zásadní význam pro formování zánětlivých RS lézí (Hartung et al., 2004). Důležitou roli v tomto procesu mají adhezivní molekuly, chemokiny a matrix metalloproteinázy (MMPs) (Bar-Or et. al., 2003). Chemokiny napomáhají migraci T-lymfocytů do CNS tvorbou chemického gradientu, pro který jsou T-lymfocyty vnímavé. Je prokázáno, že u pacientů v relapsu dochází ke zvýšení hladin některých chemokinů. Je zvýšen například interferon-gama inducible protein-10, který je exprimován mozkovými mikrovaskulárními endoteliálními buňkami (Salmaggi et al., 2002). Adhezivní molekuly jsou důležité pro vazbu T-lymfocytů na endoteliální buňky HEB. Jsou exprimovány oběma typy buněk. V patologii RS jsou důležité tři páry adhezivních molekul: E selectin a sialyl Lewis (SLe); vaskulární buněčná adhezivní molekula (VCAM)-1 a pozdní antigen (VLA)-4; a intracelulární adhezivní molekula (ICAM)-1 a funkční lymfocytární asociovaný antigen (LFA)-1 (Cannella and Raine, 1995). Ve studiích s EAE bylo prokázáno zvýšení hladiny ICAM-1 před prvními klinickými projevy nemoci (Matsuda et al., 1994).
NeurolK FN Bohunice, Lékařská fakulta, Masarykova univerzita |
Návrat na úvodní stránku webu, přístupnost |
| Servisní středisko pro e-learning na MU
| Fakulta informatiky Masarykovy univerzity, 2013
Centrum interaktivních a multimediálních studijních opor pro inovaci výuky a efektivní učení | CZ.1.07/2.2.00/28.0041

