Kyseliny a báze
Podle obecně užívané teorie Brønstedta a Lowryho:
Např. HNO3 je kyselina: HNO3 → H+ + NO3-
NH3 je báze: NH3 + H+ → NH4+
Anion, který vzniká z kyseliny po odštěpení protonu se označuje jako konjugovaná báze. Kyselina a její konjugovaná báze tvoří spolu tzv. konjugovaný pár.
HA → H+ + A- Př.: HCl
→ H+ + Cl-
kyselina → proton +
konjug. báze chloridový anion je konjugovanou
bází
konjugovaný pár
Z báze po přijetí protonu vzniká konjugovaná kyselina a obdobně báze se svou konjugovanou kyselinou tvoří konjugovaný pár (např. NH3 báze, NH4+ konjugovaná kyselina).
Schopnost kyseliny odštěpovat protony se projeví pouze v přítomnosti zásady, která je ochotná proton přijmout a naopak vlastnosti báze se projeví v přítomnosti látky s kyselým charakterem, která proton odštěpuje. Konjugovaný pár tedy nemůže existovat izolovaně, ale pouze v kombinaci s jiným konjugovaným párem. Ve vodných roztocích jako druhý konjugovaný pár často vystupuje voda. Obecně je možno každou protolytickou reakci psát ve tvaru:
AH + B → A- + BH+ HCl + H2O → Cl- + H3O+
kyselina báze konj. báze konj. kyselina kyselina báze konj. báze konj. kyselina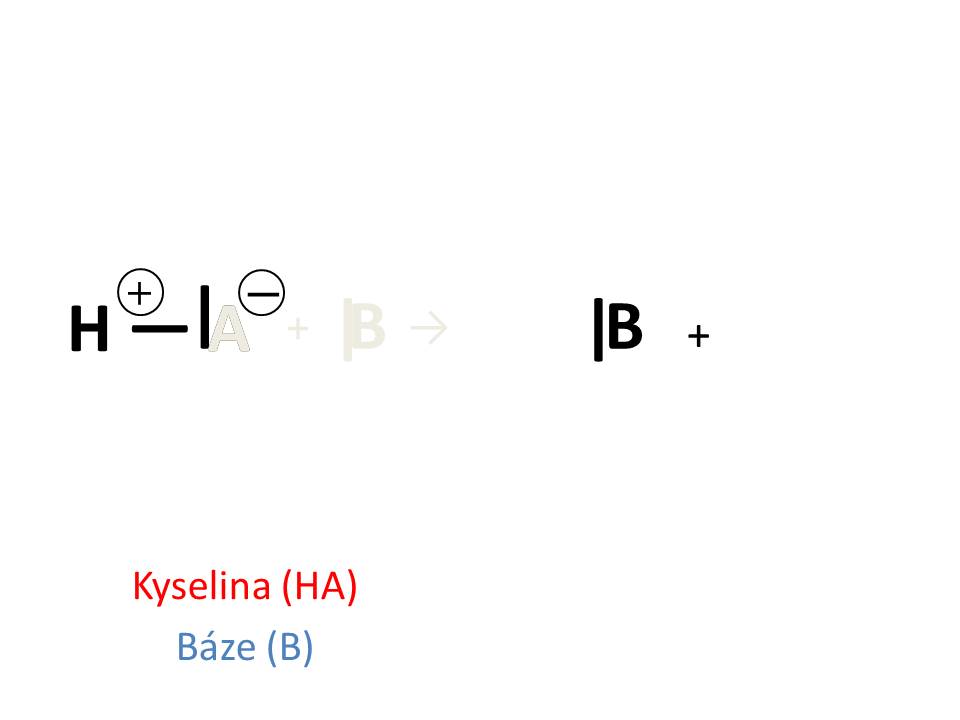
Ion H3O+, který se vyskytuje ve vodných roztocích kyselin se nazývá oxoniový kation.
Voda může protony vázat i uvolňovat, může se tedy chovat jako kyselina i jako zásada.
Látky, které mají schopnost uvolňovat i přijímat protony, vykazují vlastnosti kyseliny i báze, se nazývají amfiprotní (amfoterní). Pro pochopení stupnice pH je dobré rozumět autoprotolýze vody.
Stupnice pH. Kyselost prostředí se hodnotí podle koncentrace vodíkových iontů. Roztok, ve kterém jsou koncentrace oxoniových a hydroxidových iontů shodné, tedy [H3O+] = [OH-] = 10-7 mol.l-1, označujeme jako neutrální. Roztoky, ve kterých je [H3O+] větší než 10-7 mol.l-1, jsou kyselé a roztoky s [H3O+] menší než 10-7 mol.l-1 označujeme jako zásadité. Byl zaveden vodíkový exponent pH, definovaný jako záporný dekadický logaritmus koncentrace vodíkových iontů (protonů).
pH = - log [H3O+]
Obdobně lze definovat veličinu pOH pro hydroxidové ionty, tzn. pOH = - log [OH-]. Veličiny pH a pOH jsou ve vzájemném vztahu daném iontovým součinem vody: pH + pOH = 14
Vztah mezi pH a koncentrací vodíkových iontů shrnuje tabulka:|
Veličina |
Kyselý
roztok |
Neutrální
roztok |
Zásaditý
roztok |
|
Koncentrace H3O+ (mol/l) |
> 10-7 |
10-7 |
< 10-7 |
|
Hodnota pH |
pH < 7 |
pH = 7 |
pH > 7 |
Ze známé koncentrace vodíkových (či OH-) iontů lze vypočítat hodnotu pH a naopak, ze zjištěné hodnoty pH lze odvodit koncentraci [H3O+] ze vztahu [H3O+] = 10-pH.
Vzorové příklady:
Jaká je hodnota pH roztoku, je-li koncentrace H3O+ 1 mmol/l?
Řešení: [H3O+] se rovná 10-3 mol/l. Podle definice: pH = - log [H3O+] = - log 10-3 = - (-3) = 3
Vypočítejte koncentraci oxoniových kationtů,
je-li pH rovno 2,3.
Řešení: Z definice pH = - log [H3O+] se vyjádří [H3O+]: - pH = log [H3O+], 10-pH
= 10log[H3O+], 10-pH = [H3O+]
[H3O+] = 10-2,3.
Pomocí kalkulátoru s funkcí 10x získáme výsledek [H3O+] = 5 .
10-3 mol/l.
Průměrné hodnoty pH vybraných roztoků (tekutin) uvádí tabulka:
|
Roztok |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
|
Žaludeční šťáva |
|
|
|
|
|
|
|
|
|
|
|
|
Citronová šťáva |
|
|
|
|
|
|
|
|
|
|
|
|
Coca-Cola |
|
|
|
|
|
|
|
|
|
|
|
|
Ocet |
|
|
|
|
|
|
|
|
|
|
|
|
Pomerančový džus |
|
|
|
|
|
|
|
|
|
|
|
|
Pivo |
|
|
|
|
|
|
|
|
|
|
|
|
Minerální vody |
|
|
|
|
|
|
|
|
|
|
|
|
Moč |
|
|
|
|
|
|
|
|
|
|
|
|
Vodovodní voda |
|
|
|
|
|
|
|
|
|
|
|
|
Mléko |
|
|
|
|
|
|
|
|
|
|
|
|
Sliny |
|
|
|
|
|
|
|
|
|
|
|
|
Slzy |
|
|
|
|
|
|
|
|
|
|
|
|
Antacida |
|
|
|
|
|
|
|
|
|
|
|
|
Roztok
NaOH |
|
|
|
|
|
|
|
|
|
|
|
Silné a slabé kyseliny a zásady. Silné kyseliny patří mezi silné elektrolyty. Protože ve vodných roztocích prakticky zcela disociují, je koncentrace H3O+ u jednosytné silné kyseliny rovna celkové koncentraci kyseliny a pH = -log ckys. K nejznámějším silným kyselinám se řadí kyselina sírová, dusičná, chlorečná a chloristá. Z bezkyslíkatých kyselin je to pouze kyselinu chlorovodíková, bromovodíková a jodovodíková.
Slabé kyseliny patří mezi slabé elektrolyty. Při rozpouštění ve vodě se v roztoku ustanovuje rovnováha mezi nedisociovanými molekulami a vzniklými ionty, která je charakterizována disociační konstantou KA či jejím záporným dekadickým logaritmem pKA.
HA + H2O → A- + H3O+ ![]() pKA = -
log KA
pKA = -
log KA
Ke slabým kyselinám řadíme téměř všechny organické kyseliny a zbylé minerální kyseliny. Hodnota pH slabé kyseliny je vždy vyšší než pH silné kyseliny se stejnou koncentrací (na kyselosti se podílí pouze disociované H+ ionty), do výpočtu je zahrnuta disociační konstanta.
Mezi silné zásady patří hydroxidy alkalických kovů a kovů alkalických zemin (NaOH, KOH, Ca(OH)2, Ba(OH)2, Mg(OH)2). V roztoku jednosytných silných hydroxidů, např. NaOH nebo KOH, je v důsledku jejich úplné disociace koncentrace OH- iontů rovna koncentraci hydroxidu. Vztah pro výpočet pH se odvodí z vztahu pH + pOH = 14, odtud pH = 14 - pOH, a po dosazení: pH = 14 + log cOH.
Mezi slabé báze patří zejména amoniak NH3, všechny typy aminů (viz kapitola 4), dusíkaté heterocyklické báze, hydroxidy ostatních kovů.
Vzorový příklad:Vypočtěte pH roztoku kyseliny chlorovodíkové o koncentraci 0,0001 mol .l-1.
Řešení: Kyselina chlorovodíková je silný elektrolyt, v roztoku zcela disociuje: HCl + H2O → Cl- + H3O+.
Koncentrace H3O+ proto odpovídá celkové koncentraci HCl. [H3O+] = cHCl = 0,0001 mol.l-1 => pH = -log [H3O+] = -log 0,0001 = - log 10 -4 = 4
Pufry
Hlavní význam pufrů spočívá v možnosti přesného nastavení pH, v udržování daného pH a ve schopnosti tlumit výkyvy pH způsobené omezeným přídavkem kyseliny či zásady. Pufry, neboli tlumivé roztoky, jsou nejčastěji dvojsložkové systémy obsahující roztoky slabých kyselin a jejich solí nebo slabých zásad a jejich solí. Účinný pufr musí obě složky obsahovat v řádově si odpovídajících koncentracích. Jednoduchým příkladem je pufr složený ze slabé kyseliny a její soli, např. kyselina octová a octan sodný – octanový (acetátový) pufr. Chování pufru při přídavku silné kyseliny či zásady je možno popsat následujícím způsobem:
Po přídavku H+ iontů (protonů) do pufru dochází k jejich reakci s octanovým aniontem za vzniku slabé kyseliny octové:
CH3COO- + H+ → CH3COOH
Volné ionty H+ (protony) jsou tím převedeny na slabou kyselinu, pH roztoku se podstatně nemění. Podobně po přídavku OH- dojde k jejich následné reakci s kys. octovou a pH pufru se opět výrazně nemění:
CH3COOH + OH- → CH3COO- + H2O
pH pufru lze spočítat dle Hendersonovy-Hasselbalchovy rovnice:
kde pKA je záporný dekadický logaritmus disociační konstanty slabé kyseliny, cA je látková koncentrace kyselé složky pufru a cB je látková koncentrace bazické složky pufru. Pufr může být rovněž tvořen roztoky solí vícesytných kyselin. Typickým příkladem je fosfátový pufr tvořený směsí H2PO4- a HPO42- (např. NaH2PO4 + Na2HPO4). Také pro tento pufr platí Henderson-Hasselbalchova rovnice. Do rovnice dosazujeme za cA (koncentrace slabé kyseliny) hodnotu [H2PO4-] a za cB (koncentrace konjugované zásady) hodnotu [HPO42-]. Hodnota KA je disociační konstanta H2PO4-. Pufrační systémy v organismu jsou popsány v kapitole 30.
Literatura:
Jiří Dostál, Hana Paulová, Jiří Slanina, Eva Táborská: Biochemie pro posluchače bakalářských oborů (Brno, 2009).

Copyright © 2011, Biochemický ústav, Lékařská fakulta, Masarykova univerzita
Správce stránky: jrslanina(zavináč)med(tečka)muni(tečka)cz
Stránky vznikly s podporou FOND ROZVOJE VYSOKÝCH ŠKOL, projekt č. 2482/2011