Přehled základních pojmů z obecné chemie
Chemické vazby Uskutečnitelnost reakcí Roztoky Kyseliny a báze Oxidace a redukce

Chemické vazby a nevazebné interakce
S výjimkou vzácných plynů jsou všechny látky složeny z atomů, které jsou spojeny chemickými vazbami do molekul, popř. krystalických struktur. Při vzniku chemické vazby dochází k redistribuci elektronů příslušejících reagujícím atomům za vzniku nového, energeticky výhodnějšího uspořádání. Pevnost chemické vazby se hodnotí podle energie potřebné k jejímu rozštěpení, která je stejná jako energie uvolněná při vzniku téže vazby. Nazývá se vazebná energie a udává se v kJ. mol-1. Základními typy chemických vazeb jsou vazby kovalentní a iontové. Kromě těchto vazeb mezi atomy existují ještě přitažlivé síly mezi molekulami (nebo mezi částmi makromolekuly), jež podmiňují soudržnost látek. Energie těchto interakcí je značně menší než energie kovalentních vazeb i iontových interakcí v krystalových mřížkách - proto se též označují jako slabé nevazebné interakce, viz. dále.

- H· + H· → H–H
Větší počet sdílených elektronových párů mezi dvěma atomy podmiňuje vznik násobné kovalentní vazby. Násobná kovalentní vazba se skládá z jedné σ vazby a jedné nebo dvou vazeb π. Vazba π vzniká překrytím valenčních orbitalů (p nebo d) mimo spojnici jader. Násobné vazby jsou zejména typické pro uhlíkaté organické sloučeniny. Nacházejí se však i v řadě anorganických sloučenin zejména dusíku, kyslíku, síry (molekula dusíku N≡N, kyanovodík H-C≡N, oxid siřičitý O=S=O).

Obr. Vznik kovalentní vazby π překryvem 2 orbitalu p, které mají tvar prostorových osmiček, nad a pod spojnicí atomových jader.
Polarita vazeb a polarita molekul. Pokud kovalentní vazba spojuje dva stejné atomy, např. v molekulách plynů (N2, O2, F2), sdílené elektrony jsou rozloženy mezi oběma atomy rovnoměrně; takovou vazbu nazýváme nepolární. Molekuly těchto látek rovněž nepolární. Vazba polární vzniká tehdy, jsou-li spojeny dva různé atomy a sdílený elektronový pár je k nim poután různou silou. Potom není vazebný pár rozložen rovnoměrně mezi oba atomy, ale posunut blíže k atomu, který jej více přitahuje. Ten tím získává parciální záporný náboj (δ-). Na druhém atomu převládá pak náboj kladný (δ+) a kovalentní vazba nabývá polární povahy. Příklad: polarita vazby v molekule chlorovodíku Hδ+ - Clδ-: Míra přitahování vazebných elektronů je dána elektronegativitou atomu. Hodnoty elektronegativit prvků se pohybují v rozmezí 0,7 (Cs) až 4,1 (F). Sloučeniny, v nichž se vyskytují polární vazby, se navenek obvykle chovají jako dipóly, tzn. jsou navenek polární. To potom ovlivňuje jejich interakce s dalšími molekulami (viz nevazebné interakce). Koordinačně kovalentní vazba. Kromě typické kovalentní vazby se vyskytuje v tzv. komplexních sloučeninách zvláštní typ kovalentní vazby - koordinačně kovalentní. Vyznačuje se tím, že oba elektrony vazebného páru poskytuje pouze jeden z vázaných atomů. Tento (elektronegativní) atom má volný elektronový pár, tj. dvojici elektronů dosud nezapojenou do vazby. Nazývá se donorem elektronového páru. Druhý atom, který elektrony přijímá, má volný valenční orbital a nazýváme jej akceptorem. Proto se tato vazba také nazývá donor-akceptorová nebo dativní. Nejjednodušším příkladem koordinační vazby je vznik vazby mezi protonem a atomem dusíku při tvorbě iontu NH4+, všechny čtyři vazby N-H v amonném kationtu jsou rovnocenné.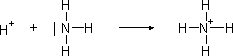 Koordinační vazba se vyskytuje především v tzv. komplexních sloučeninách. Přirozené komplexní sloučeniny jsou látky
mající význam v mnoha oblastech. V
hemoglobinu je porfyrinový komplex s centrálním atomem železa přenašečem
kyslíku, v chlorofylu je obdobný
komplex hořčíku, ve vitaminu B12 komplex
kobaltu. Mnoho enzymů vyžaduje ke své katalytické činnosti komplexně navázané
ionty kovů alkalických zemin nebo přechodných kovů.
Iontová vazba je
extrémním případem polární kovalentní vazby. Sdílené elektrony vazby jsou vtaženy
do oblasti elektronegativnějšího atomu, takže vznikají 2 samostatné ionty. Opačně
nabité ionty jsou pak přitahovány elektrostatickými silami. Iontové vazby se
uplatňují v krystalové mřížce iontových sloučenin. Kromě typických dvouprvkových
solí (NaCl, KF) se iontová vazba vyskytuje i u dalších solí anorganických a
organických kyselin, které jsou tvořeny kationty a anionty, jako NH4+,
NO3-, SO42-. Mezi těmito částicemi,
např. NH4+ a NO3-, je charakter
vazby iontový, ačkoliv v samotném molekulovém iontu jsou vazby typicky kovalentní.
Slabé nevazebné interakce (intermolekulární interakce). Jsou to interakce, které se
uplatňují mezi molekulami prvků a sloučenin, a jejich velikost určuje např. skupenský stav látek a
ovlivňuje rozpustnost v různých rozpouštědlech. Jejich biologický význam
spočívá v udržování sekundární, terciární příp. kvartérní struktury
biopolymerů, stabilitě nadmolekulárních struktur jako jsou biomembrány, ve
specifických biologických interakcích (vazba substrátu na enzym, protilátky na
antigen, hormonu na bílkovinný receptor atd). Mezi slabé interakce patří vodíkové
vazby, elektrostatické, disperzní a hydrofobní interakce.
Vodíkové vazby jsou
nejsilnější z nevazebných interakcí. Vyskytují se u látek, v nichž je atom
vodíku navázán na silně elektronegativní atom - dusík, kyslík nebo fluor.
Vysvětlují se silnou polaritou vazeb F-H, O-H a N-H. Vazebný elektronový pár
natolik posunut k elektronegativnějšímu atomu, že atom vodíku může
vytvořit slabou vazbu s volným elektronovým párem dalšího elektronegativního
atomu. Ve vzorcích se vodíková vazba vyznačuje tečkováním X-H ····Y.
Zvláštní význam mají vodíkové vazby pro vlastnosti vody. Protože kyslík v H2O
má dva nevazebné páry elektronů a dva kovalentně vázané vodíky, může každá molekula
vody tvořit vodíkové vazby současně až se čtyřmi jinými molekulami.
Koordinační vazba se vyskytuje především v tzv. komplexních sloučeninách. Přirozené komplexní sloučeniny jsou látky
mající význam v mnoha oblastech. V
hemoglobinu je porfyrinový komplex s centrálním atomem železa přenašečem
kyslíku, v chlorofylu je obdobný
komplex hořčíku, ve vitaminu B12 komplex
kobaltu. Mnoho enzymů vyžaduje ke své katalytické činnosti komplexně navázané
ionty kovů alkalických zemin nebo přechodných kovů.
Iontová vazba je
extrémním případem polární kovalentní vazby. Sdílené elektrony vazby jsou vtaženy
do oblasti elektronegativnějšího atomu, takže vznikají 2 samostatné ionty. Opačně
nabité ionty jsou pak přitahovány elektrostatickými silami. Iontové vazby se
uplatňují v krystalové mřížce iontových sloučenin. Kromě typických dvouprvkových
solí (NaCl, KF) se iontová vazba vyskytuje i u dalších solí anorganických a
organických kyselin, které jsou tvořeny kationty a anionty, jako NH4+,
NO3-, SO42-. Mezi těmito částicemi,
např. NH4+ a NO3-, je charakter
vazby iontový, ačkoliv v samotném molekulovém iontu jsou vazby typicky kovalentní.
Slabé nevazebné interakce (intermolekulární interakce). Jsou to interakce, které se
uplatňují mezi molekulami prvků a sloučenin, a jejich velikost určuje např. skupenský stav látek a
ovlivňuje rozpustnost v různých rozpouštědlech. Jejich biologický význam
spočívá v udržování sekundární, terciární příp. kvartérní struktury
biopolymerů, stabilitě nadmolekulárních struktur jako jsou biomembrány, ve
specifických biologických interakcích (vazba substrátu na enzym, protilátky na
antigen, hormonu na bílkovinný receptor atd). Mezi slabé interakce patří vodíkové
vazby, elektrostatické, disperzní a hydrofobní interakce.
Vodíkové vazby jsou
nejsilnější z nevazebných interakcí. Vyskytují se u látek, v nichž je atom
vodíku navázán na silně elektronegativní atom - dusík, kyslík nebo fluor.
Vysvětlují se silnou polaritou vazeb F-H, O-H a N-H. Vazebný elektronový pár
natolik posunut k elektronegativnějšímu atomu, že atom vodíku může
vytvořit slabou vazbu s volným elektronovým párem dalšího elektronegativního
atomu. Ve vzorcích se vodíková vazba vyznačuje tečkováním X-H ····Y.
Zvláštní význam mají vodíkové vazby pro vlastnosti vody. Protože kyslík v H2O
má dva nevazebné páry elektronů a dva kovalentně vázané vodíky, může každá molekula
vody tvořit vodíkové vazby současně až se čtyřmi jinými molekulami.
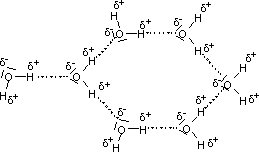 Vodíkové vazby se podílí zásadním způsobem na párování bází nukleových kyselin, které je podstatou
přenosu, přepisování a překladu genetického kódu. U bílkovin se na základě tvorby vodíkových vazeb formuje
sekundární struktura peptidového řetězce (α-helix, β-struktura).
Podstatou elektrostatických
interakcí jsou přitažlivé síly mezi kladným a záporným elektrickým nábojem.
Dochází buď k interakci celistvých ionizovaných skupin (interakce typu ion-ion) nebo dílčích nábojů, vznikajících
v molekulách v důsledku polarity vazeb (interakce
ion-dipól nebo dipól-dipól). Interakce typu ion-ion není identická s iontovou
vazbou, protože iontové vazby se uplatňují pouze v krystalové mřížce
iontových sloučenin. Zde jde o vznik iontových párů neboli tzv. solných můstků v roztocích. Energie těchto
interakcí je podstatně nižší než energie iontové vazby. K tvorbě iontových párů
dochází např. při interakci vedlejších aminokyselinových řetězců
v bílkovině, typu –COO- ····· +NH3-. Tato interakce má zejména
význam pro asociaci podjednotek podílejících se na kvartérní struktuře bílkovin.
Interakce ion-dipól nebo dipól-dipól u polárních látek jsou
zodpovědné za jejich nižší těkavost ve srovnání s analogickými
sloučeninami nepolárními. Jsou také podstatou tvorby solvatačních obalů iontů
v polárních rozpouštědlech. Na základě jejich existence lze vysvětlit i
obecnou rozpustnost polárních látek v polárních rozpouštědlech.
Disperzní síly se uplatňují u nepolárních
látek (uhlovodíky, lipidy). U těchto látek nemajících stálý dipól mohou vést
okamžité nerovnoměrnosti v rozložení elektronů ke vzniku dočasných dipólů,
jejichž vzájemné působení má za následek přitahování molekul. Energie
disperzních interakcí je nejmenší ze všech nekovalentních vazeb. Elektrostatické
a disperzní interakce se někdy označují společným názvem van der Waalsovy síly.
Hydrofobní
interakce je označení pro
vazbu vznikající mezi hydrofobními (nepolárními) molekulami látek ve vodném
prostředí. Energie vazby jednotlivých interakcí je nepatrná, ale vyskytují-li
se ve velkém množství, dosahuje se značné pevnosti. Tento typ interakcí se
uplatňuje ve struktuře biomolekul, např. při vytváření biologických membrán a v
terciární struktuře bílkovin.
Vodíkové vazby se podílí zásadním způsobem na párování bází nukleových kyselin, které je podstatou
přenosu, přepisování a překladu genetického kódu. U bílkovin se na základě tvorby vodíkových vazeb formuje
sekundární struktura peptidového řetězce (α-helix, β-struktura).
Podstatou elektrostatických
interakcí jsou přitažlivé síly mezi kladným a záporným elektrickým nábojem.
Dochází buď k interakci celistvých ionizovaných skupin (interakce typu ion-ion) nebo dílčích nábojů, vznikajících
v molekulách v důsledku polarity vazeb (interakce
ion-dipól nebo dipól-dipól). Interakce typu ion-ion není identická s iontovou
vazbou, protože iontové vazby se uplatňují pouze v krystalové mřížce
iontových sloučenin. Zde jde o vznik iontových párů neboli tzv. solných můstků v roztocích. Energie těchto
interakcí je podstatně nižší než energie iontové vazby. K tvorbě iontových párů
dochází např. při interakci vedlejších aminokyselinových řetězců
v bílkovině, typu –COO- ····· +NH3-. Tato interakce má zejména
význam pro asociaci podjednotek podílejících se na kvartérní struktuře bílkovin.
Interakce ion-dipól nebo dipól-dipól u polárních látek jsou
zodpovědné za jejich nižší těkavost ve srovnání s analogickými
sloučeninami nepolárními. Jsou také podstatou tvorby solvatačních obalů iontů
v polárních rozpouštědlech. Na základě jejich existence lze vysvětlit i
obecnou rozpustnost polárních látek v polárních rozpouštědlech.
Disperzní síly se uplatňují u nepolárních
látek (uhlovodíky, lipidy). U těchto látek nemajících stálý dipól mohou vést
okamžité nerovnoměrnosti v rozložení elektronů ke vzniku dočasných dipólů,
jejichž vzájemné působení má za následek přitahování molekul. Energie
disperzních interakcí je nejmenší ze všech nekovalentních vazeb. Elektrostatické
a disperzní interakce se někdy označují společným názvem van der Waalsovy síly.
Hydrofobní
interakce je označení pro
vazbu vznikající mezi hydrofobními (nepolárními) molekulami látek ve vodném
prostředí. Energie vazby jednotlivých interakcí je nepatrná, ale vyskytují-li
se ve velkém množství, dosahuje se značné pevnosti. Tento typ interakcí se
uplatňuje ve struktuře biomolekul, např. při vytváření biologických membrán a v
terciární struktuře bílkovin.
Literatura:
Jiří Dostál, Hana Paulová, Jiří Slanina, Eva Táborská: Biochemie pro posluchače bakalářských oborů (Brno, 2009).

Copyright © 2011, Biochemický ústav, Lékařská fakulta, Masarykova univerzita
Správce stránky: jrslanina(zavináč)med(tečka)muni(tečka)cz
Stránky vznikly s podporou FOND ROZVOJE VYSOKÝCH ŠKOL, projekt č. 2482/2011