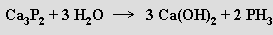
S vodíkem tvoří fosfor několik homologických řad fosfanů, z nichž nejstabilnější jsou první tři členy řady PnHn+2 (n = 1-9) s řetězovými strukturami, které byly připraveny v čisté formě. V nestabilních řadách PnHn s n = 3-10, PnHn-2 s n = 4-12 a PnHn-4 s n = 5-13 převládá tendence k tvorbě cyklických molekul.
Fosfan PH3 (b. t. -133,5 °C, b. v. -87,7 °C) je bezbarvý, jedovatý, po česneku páchnoucí plyn. Nelze ho připravit přímou syntézou z prvků, použitelný je rozklad fosfidů vodou
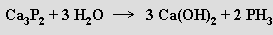
nebo zředěnými kyselinami
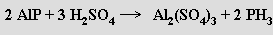
Vzniká i reakcí bílého fosforu s hydroxidy alkalických kovů v atmosféře vodíku a disproporcionací sloučenin obsahujících fosfor v oxidačních stavech 0, +I nebo +III.

[Zobrazit video]
| Příprava fosfanu reakcí bílého fosforu s hydroxidem v atmosféře vodíku |
Má silné redukční vlastnosti, z roztoků solí redukuje kovy, v kyslíkové atmosféře shoří na kyselinu fosforečnou a s chlorem poskytuje chlorid fosforečný
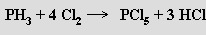
Vodík ve fosfanu lze substituovat alkalickým kovem
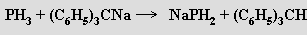
Fosfan je slabší baze než amoniak. Se silnými kyselinami tvoří fosfoniové soli PH4X, které jsou v plynné fázi disociovány na své složky a v alkalických roztocích se rozkládají za vzniku fosfanu
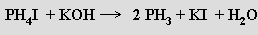
Difosfan P2H4 (H2P-PH2, b. t. -99 °C, extrapolovaný b. v. 63,5 °C) je bezbarvá nestálá kapalina, jejíž páry jsou samozápalné. Strukturně je analogem hydrazinu, nemá však jeho bazické vlastnosti. Osvětlením nebo zahřátím se rozkládá na žlutý polymerní amorfní produkt s dosud neznámou strukturou a přibližnou stechiometrií (P2H)x.
Fosfidy jsou sloučeniny fosforu s elektropozitivnějšími prvky. Připravují se zahříváním kovu s červeným fosforem v inertní atmosféře nebo elektrolýzou tavenin směsí fosforečnanů s kovovými oxidy nebo halogenidy. Podobají se boridům, karbidům a nitridům. Složení se pohybuje od M4P přes MP až po MP15 a podle něho dělíme fosfidy na bohaté na kov (tvrdé, křehké, málo reaktivní a termicky vysoce stabilní), monofosfidy a fosfidy bohaté na fosfor (vodou se rozkládající, termicky nestálé polovodiče).
Oxid fosforitý P4O6 (b. t. 23,8 °C, b. v. 175.4 °C) vzniká spalováním fosforu při nedostatku kyslíku. Ve všech skupenstvích je tvořen molekulami P4O6. Základem struktury je tetraedrický skelet P4, jehož hrany tvoří kyslíkové můstky (adamantoidní struktura). Je anhydridem kyseliny fosforité, ve vroucí vodě podléhá hlubší destrukci na fosfan, červený fosfor a kyselinu orthofosforečnou. Jeho reakcí s chlorovodíkem se tvoří chlorid fosforitý a kyselina fosforitá

|
P4O6
|
Adamantoidní P4O10
|
Vrstevnatý P4O10
|
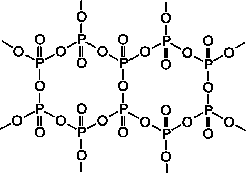
Oxid fosforečný P4O10, který vzniká hořením fosforu na vzduchu, existuje v několika polymorfních modifikacích. Hexagonální H-forma má strukturu odvozenou od P4O6 přidáním terminálních atomů kyslíku ke každému atomu fosforu (sublimuje při 360 °C a je základem obchodních preparátů). Jejím roztavením rychlým ohřevem molekuly P4O10 polymerují za současného poklesu tenze par a zvýšení viskozity. Prudkým ochlazením taveniny vzniká amorfní sklovitá modifikace. Orthorhombické (O- (metastabilní) a O'- (stabilní)) formy jsou tvořeny vrstvami s analogickou koordinací atomů fosforu jako v H-formě. Oxid fosforečný má mimořádnou dehydratační schopnost, odnímá vodu i kyselinám sírové a dusičné za vzniku příslušných anhydridů. V laboratoři se proto často využívá k sušení některých plynů a rozpouštědel. S vodou se energicky slučuje, soustava má komplikované složení. S halogenovodíky tvoří halogenidy fosforylu
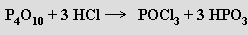
Oxidy o složení P4O7 , P4O8 a P4O9 se připravují parciální oxidací P4O6 a jsou přechodem mezi oxidy fosforitým P4O6 a fosforečným P4O10. Dříve deklarovaný oxid fosforičitý (PO2)x byl jejich směsí. Dále jsou známy suboxid PO a peroxid P2O6, ale strukturní údaje o nich dosud chybí.
Je známa řada sulfidů fosforu o složení P4S2, P4S3 (nejstabilnější), - a -P4S4, - a -P4S5, P4S7, P4S9 a P4S10. Většinou se připravují reakcí prvků v příslušném molárním poměru při zvýšené teplotě. Zahřívání P4O10 a P4S10 ve vhodném poměru na přibližně 400 °C lze získat oxidsulfidy P4O6S4 a P4O4S6.
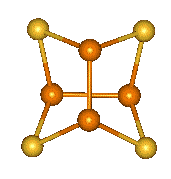
Strukturními ekvivalenty analogické oxidům téhož složení jsou pouze P4S9 a P4S10, sulfid analogický oxidu fosforitému nebyl dosud připraven. Vesměs jde o žluté pevné krystalické látky rozkládající se v kyselém i zásaditém prostředí
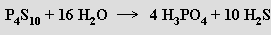
P4S2
|
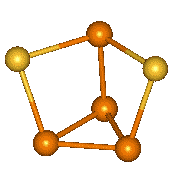
P4S3
|
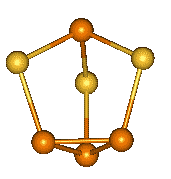
α-P4S2
|
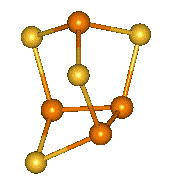
β-P4S2
|
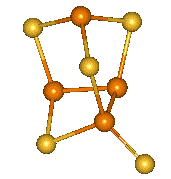
α-P4S6
|
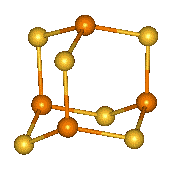
β-P4S6
|
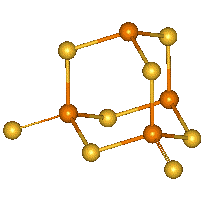
P4S8
|
P4S9
|
P4S10
|
P4O6S4
|
P4O4S6
|
Reakce P4S3 s chlorečnanem draselným se využívalo při výrobě zápalek vzněcujících se na jakékoliv drsné ploše (obsahovaly 20 % KClO3, 9 % P4S3, 14 % mletého skla, 11 % Fe2O3, 7% Zn a lepidlo; bezpečnostní zápalky mají hlavičky z KClO3, třecí ploška obsahuje 50 % netoxického červeného fosforu, 28 % Sb2O3, 1 % Fe2O3 a arabskou gumu). P4S10 je surovinou pro výrobu organothiofosforečných derivátů využívaných při výrobě detergentů, pesticidů, aditiv do mazacích olejů, antioxidantů a inhibitorů koroze.
S halogeny tvoří fosfor tři typy binárních sloučenin (PX3, P2X4 a PX5) a také smíšené halogenidy (PX2Y, PX3Y2). Trihalogenidy PX3 se připravují přímou syntézou z prvků ve vhodném stechiometrickém poměru, pouze fluorid fosforitý PF3 (b. t. -151,5 °C, b. v. -101,8 °C; bezbarvý plyn bez zápachu, nebezpečný tvorbou komplexu s hemoglobinem) fluorací chloridu fosforitého
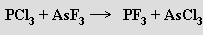
Molekuly |PX3 mají vzhledem k volnému elektronovému páru na atomu fosforu tvar trigonální pyramidy. V komplexech vystupují jako donorové ligandy, jsou však schopny i elektrony přijímat, přičemž volný elektronový pár na fosforu zůstává inertní. Jsou stabilnější než halogenidy dusité, vodou se rozkládají za tvorby kyselin fosforité a halogenovodíkové. Pro laboratorní i technologickou praxi je nejvýznamnější za laboratorní teploty kapalný chlorid fosforitý PCl3 (b. t. -93,6 °C, b. v. 76,1 °C) snadno podléhající mnoha substitučním, redukčním, oxidačním i adičním reakcím.
Tetrahalogenidy se symetrickou strukturu X2 P-PX2 lze považovat za deriváty difosfanu. Tetrachlordifosfan P2Cl4 se tvoří účinkem elektrického výboje na směs par chloridu fosforitého s vodíkem, nejstabilnější tetrajoddifosfan P2I4 vzniká reakcí jodu s bílým fosforem v sirouhlíku. Zahříváním všechny tetrahalogendifosfany disproporcionují na halogenidy fosforité a fosfor. Průběh hydrolýzy je složitý a poskytuje směs fosfanů a oxokyselin fosforu.
Pentahalogenidy PX5 se připravují reakcemi trihalogenidů s příslušným halogenem, pouze fluorid fosforečný PF5 nepřímo fluorací chloridu fosforečného fluoridem arsenitým. V plynném stavu mají všechny pentahalogenidy molekulární povahu, v krystalickém stavu a v roztocích existují v iontové formě (PCl4+ PCl6−, PBr4+ Br−). Molekulovou formu chloridu fosforečného PCl5 lze připravit i v pevném stavu prudkým ochlazení par na velmi nízkou teplotu. Termická stabilita těchto látek klesá s rostoucí velikostí a klesající elektronegativitou halogenu (už chlorid fosforečný je v parách částečně disociován na chlorid fosforitý a chlor). Parciální hydrolýzou vznikají vedle halogenovodíků halogenidy fosforylu, úplná hydrolýza poskytuje kyseliny trihydrogenfosforečnou a halogenovodíkovou. Reakcí fluoridu fosforečného s fluorovodíkem vzniká kyselina hexafluorofosforečná H[PF6]. Je silnou kyselinou, jejíž soli se připravují reakcemi chloridu fosforečného s fluoridy kovů.
Chlorid POCl3 a bromid fosforylu POBr3 se tvoří parciální hydrolýzou příslušných pentahalogenidů, jejich reakcemi s oxidem fosforečným
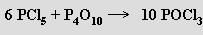
nebo kyselinou šťavelovou
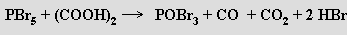
Fluorid fosforylu POF3 a jodid fosforylu POI3 lze získat halogenací chloridu fosforylu. Fluorid fosforylu je plynný, chlorid kapalný, bromid a jodid jsou pevné látky. Jsou známy i fluoridchloridy a fluoridbromidy fosforylu a také halogenidy thiofosforylu PSX3. Ve všech případech jde o reaktivní látky, které se vodou rozkládají a snadno podléhají mnoha substitučním reakcím.
Kyselina fosforná (dihydrido-dioxofosforečná) H[PH2O2] je bílá krystalická látka (b. t. 26,5 °C) vznikající reakcí
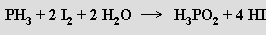
Je silnou jednosytnou kyselinou (pKa = 1,1), která se při zahřívání nad 130 °C rozkládá za vzniku fosfanu, fosforu, kyseliny fosforité a vodíku. Volná kyselina fosforná i její soli jsou dobře rozpustné ve vodě a působí jako silná redukovadla. Směs fosfornanu a fosforitanu se tvoří působením hydroxidů alkalických kovů na bílý fosfor (fosforitan lze odstranit jako nerozpustnou vápenatou sůl)
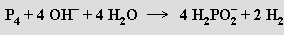
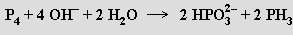
Monohydrát fosfornanu sodného NaH2PO2.H2O se využívá jako redukční činidlo při bezproudovém niklování kovů (kyselé roztoky) i nevodivých materiálů (silněji redukující alkalické roztoky).
Kyselina fosforitá (hydridodihydrogenfosforečná) H2[PHO3] (b. t. 70,1 °C) je bezbarvá krystalická látka, která se dobře rozpouští ve vodě a je schopna redukovat ušlechtilé kovy z roztoků jejich solí
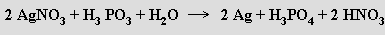
Připravuje se hydrolýzou chloridu fosforitého v organickém rozpouštědle (CCl4). Termicky bez přítomnosti vody disproporcionuje na fosfan a kyselinu trihydrogenfosforečnou
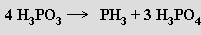
v přítomnosti vody vzniká kyselina orthofosforečná a uvolňuje se vodík
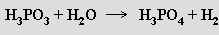
Je silnou dvojsytnou kyselinou (pKa' = 1,3, pKa″ = 6,7) tvořící dvě řady solí. Fosforitany kovů alkalických zemin a těžkých kovů jsou málo rozpustné. Kyselina fosforitá a fosforitany jsou slabšími redukčními činidly než kyselina fosforná a fosfornany. Dehydratací hydrogenfosforitanů vznikají difosforitany MI2[H(O2)POP(O2)H]. Estery kyseliny fosforité existují ve dvou izomerních formách – P(OR)3 i OPR(OR)2.
Kyselina tetrahydrogendifosforičitá H4P2O6 je obsažena ve směsi kyselin tvořících se pomalou oxidací bílého fosforu vzdušným kyslíkem. Je to stálá čtyřsytná kyselina, známá i jako dihydrát, tvoří jen dvě řady solí. Její molekuly mají symetrickou strukturu (HO)2OP-PO(OH)2. Termicky a v kyselých roztocích se rozkládá na kyselinu fosforitou a orthofosforečnou
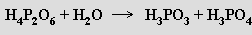
Disodnou sůl lze připravit oxidací červeného fosforu chloritanem sodným. Je známa i izomerní kyselina izodifosforičitá (HO)(H)OP-O-PO(OH)2 obsahující jeden atom vodíku přímo vázaný na fosfor a můstek POP.
Kyselina trihydrogenfosforečná (orthofosforečná) H3PO4 je bezbarvá krystalická látka (b. t. 42 °C). Má vrstevnatou strukturu, v níž je každá molekula spojena se šesti sousedy vodíkovými vazbami. Charakteristický je její sklon ke kondenzačním reakcím (i tavenina H3 PO4 obsahuje kyselinu difosforečnou), ve vodných roztocích je jedinou stabilní formou kyselin fosforečných. Dobře se rozpouští ve vodě (tvoří s ní hemihydrát H3PO4.1/2H2O s b. t. 29,3 °C), do prodeje přichází její 85-90% roztok. Za laboratorní teploty je to nepříliš reaktivní látka, při zvýšené teplotě však snadno reaguje s většinou kovů a jejich oxidů. Průmyslově se vyrábí hydratací oxidu fosforečného získaného spalováním bílého fosforu nebo rozkladem fosforečnanů (apatitů) kyselinou sírovou.

[Zobrazit video]
| Příprava kyseliny fosforečné hydratací oxidu fosforečného |
Je dosti silnou trojsytnou kyselinou (pKa'= 2,12, pKa'' = 7,21, pKa''' = 12,3) tvořící tři řady solí. Všechny dihydrogenfosforečnany jsou rozpustné ve vodě, hydrogenfosforečnany a fosforečnany jen s kationty alkalických kovů. Aniont fosforečnanový a hydrogenfosforečnanový podléhají ve vodném roztoku hydrolýze
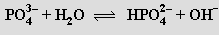
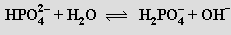
Směs alkalického hydrogen- a dihydrogenfosforečnanu má vlastnosti tlumivého roztoku. Kyselina trihydrogenfosforečná slouží k povrchové antikorozní úpravě kovů (fosfátování), výrobě rozpustných fosforečnanů a fosforečných hnojiv a v potravinářství k okyselení nápojů (Coca Cola). Při výrobě hnojiva superfosfátu se fluoroapatit převádí kyselinou sírovou na rozpustnou sůl dihydrogenvápenatou
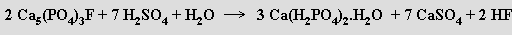
Použije-li se místo kyseliny sírové kyselina orthofosforečná, není produkt zředěn síranem vápenatým. Orthofosforečnany se používají v potravinářském průmyslu a při výrobě detergentů.
Kyselina tetrahydrogendifosforečná H4P2O7 (b. t. 61 °C) je bezbarvá krystalická látka, která vzniká termickou dehydratací (220 °C) kyseliny trihydrogenfosforečné. V tavenině je směsí oligofosforečných kyselin a produktů jejich autoprotolýzy. Snadno se rozpouští ve vodě, v níž přechází na H3 PO4. Je silnou čtyřsytnou kyselinou (pKa' = 1,0, pKa'' = 2,0, pKa''' = 6,6, pKa'''' = 9,6, kondenzované kyseliny jsou obecně silnější, než výchozí monomery). Tvoří jen difosforečnany a dihydrogendifosforečnany (vzhledem k blízkým hodnotám pKa' a pKa'' resp. pKa''' a pKa'''') vznikající termickou kondenzací hydrogenfosforečnanů
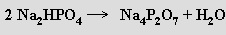
resp. dihydrogenfosforečnanů

Dihydrogendifosforečnany jsou většinou rozpustné, z difosforečnanů jen soli alkalických kovů. Praktické uplatnění nacházejí sodné soli v potravinářství, z vyšších oligomerů je trifosforečnan sodný významnou součástí (až 45 %) syntetických detergentů (nevýhodou je jeho eutrofikační působení ve vodách). Estery oligofosforečných kyselin hrají klíčovou úlohu (spojenou se vznikem a štěpením vazeb POP) v životních procesech.
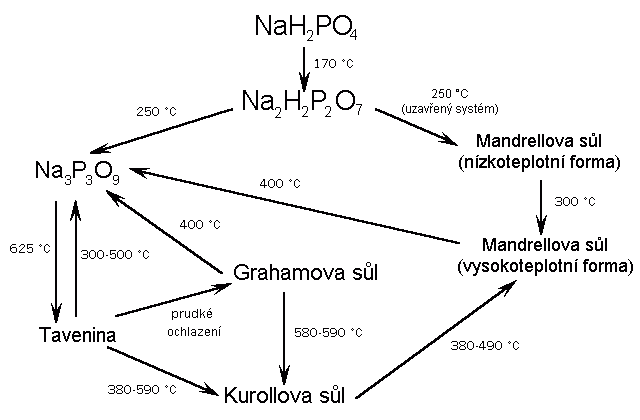
Kyselina hydrogenfosforečná (metafosforečná) (HPO3)x je sklovitá pevná látka, snadno rozpustná ve vodě, v níž přechází na kyselinu trihydrogenfosforečnou (je konečným produktem její dehydratace). Její struktura není dosud přesně známa. Lineární metafosforečnany (MPO3)x obsahují polymerní anionty (podobné pyroxenům) tvořené zřetězenými tetraedry PO4. Vznikají zahříváním dihydrogenfosforečnanů
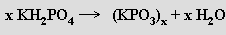
nebo dihydrogendifosforečnanů alkalických kovů
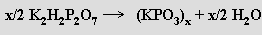
Tavením NaH2PO4 vznikají skla o složení (NaPO3)x (x = 20 až 500), která se rozpouštějí ve vodě na koloidní roztoky schopné iontové výměny (kationty sodné za vápenaté při změkčování vody). Ze sklovité formy sodné soli (Grahamova sůl) lze tepelným zpracováním získat krystalické látky (Kurrolova a Maddrelova sůl). Všechny přecházejí dlouhodobým zahříváním na soli cyklických kyselin polymetafosforečných (HPO3)n (n = 3-8, běžné jsou první dva členy této řady), které vznikají i reakcemi difosforečnanů s některými solemi:
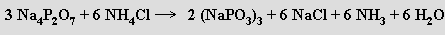
Z dusíkofosforečných sloučenin jsou nejvýznamnější fosfazeny obsahující fragment ≡P=N–. Jsou početnou skupinou sloučenin tvořících několik homologických řad. Některé z nich se mohou (podobně jako PCl5) vyskytovat v molekulové i iontové formě. Monofosfazeny s organickými substituenty lze získat Kirsanovovou reakcí
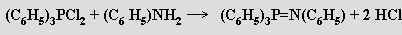
Difosfazeny je možno připravit reakcí chloridu fosforečného s chloridem amonným v chlorovaných uhlovodících jako rozpouštědlech
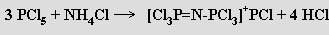
Nejrozsáhlejší skupinu fosfazenů představují cyklické nitridodihalogenidy fosforečné (PNX2)n (X = F, Cl, Br). Reakcí amoniaku s chloridem fosforečným byly cyklické nitridodichloridy fosforečné (chloro-cyklo-fosfazeny) připraveny už J. von Liebigem a F. Wöhlerem (1834), jejich stechiometrie a struktura byly objasněny až mnohem později (vazebné poměry v cyklo-fosfazenech jsou dosud předmětem diskusí). Směs oligomerních chloro-cyklo-fosfazenů se získá zahříváním chloridu fosforečného s chloridem amonným (120 až 150 °C v symetrickém tetrachloretanu jako rozpouštědle, v reakčním mechanismu zůstává řada neobjasněných detailů)
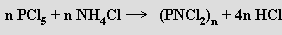
Byly izolovány cyklické oligomery (n = 3 až 8) a lineární polymer (n = ∞). Nejlépe prostudovány jsou (téměř) rovinný hexachloro-cyklo-trifosfazen (PNCl2)3 a nerovinný vaničkový oktachloro-cyklo -tetrafosfazen (PNCl2)4. Hydrolýzou chloro-cyklo-fosfazenů vznikají kyseliny cyklo-nitridofosforečné (PN(OH)2)n. Zahříváním směsi oligomerních chloro-cyklo-fosfazenů (na 250-350 °C) vzniká řetězovitý polymer (PNCl2)∞ nazývaný podle svých vlastností anorganický kaučuk. Fluoro-cyklo-fosfazeny se připravují fluorací chloro-cyklo-fosfazenů
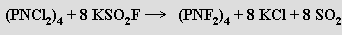
Oktafluoro-cyklo-tetrafosfazen (PNF2)4 představuje na rozdíl od (PNCl2)4 rovinný cykl. Atom dusíku se v některých cyklofosfazenech se chová jako slabá baze schopná protonizace. Jsou známy i DA-komplexy s polyfosfazeny jako N-donorovými ligandy. Počet známých organických i anorganických derivátů polyfosfazenů je obrovský. Byla navržena řada jejich možných aplikací (plasty pro extré mní tepelné podmínky, prostředky pro nehořlavou úpravu tkanin a dřevotřískových desek, pesticidy, hnojiva), ale praktické využití omezuje jejich vysoká cena a snadná hydrolýza nejlevnějších chloroderivátů (stabilnější jsou fluoro-, amino- a alkoxoderiváty).
Mnoho sloučenin obsahující vazby P-N lze považovat za deriváty kyselin fosforečných (kyselina diamidofosforečná HPO2 (NH2)2, triamid fosforylu PO(NH2)3, cyklo-difosfazány (X3PNR)2, kyseliny cyklo-imidofosforečné). Řád vazby P-N je v řadě z nich větší než jedna, což se vedle zkrácení vazby projeví i omezenou možností rotace kolem ní.
Za organofosforečné sloučeniny považujeme látky obsahující alespoň jednu vazbu P-C. Je znám fosforový analog pyridinu (fosfabenzen C5H5P, 1971), deriváty s dvojnou vazbou P=C (ylidy, (C6H5)3 P=CH2) a plně substituovaný fosforan P(C6H5)5. Mnoho organických sloučenin fosforu je vysoce toxických a na jejich bázi byly vyvinuty nejen herbicidy a pesticidy, ale i nervově paralytické jedy (u člověka způsobují dezorientaci, stavy úzkosti, ochrnutí a nakonec smrt).