Sodík a cesium jsou monoizotopické, lithium je má dva izotopy (7Li se zastoupením 92,7 % a 6Li; lehčí izotop má význam pro přípravu tritia reakcí Li (n , α) 3H). Draslík a rubidium mají po jednom radioaktivním izotopu s dlouhými poločasy rozpadu (40K, 0,01 %, τ1/2 = 1,27.109 let; 87Rb, 27,2 %, τ1/2 = 5,7.1010 let), jejich aktivita je nízká a dlouhé rozpadové poločasy způsobují, že nemají významnější vliv na přesnost stanovení atomových hmotností obou prvků. Tři nejlehčí prvky této skupiny patří mezi biogenní (sodík a draslík v makromnožstvích, lithium stopově). Všech 21 známých izotopů francia je radioaktivních, nejstálejší je 223Fr (τ1/2 = 21,8 min.).
V přírodě se alkalické kovy vyskytují jen ve sloučeninách. Nejrozšířenějšími z nich jsou sodík (2,27 %, sedmý prvek, pátý kov po hliníku, železu, vápníku a hořčíku) a draslík (1,84 %). Ostatní jsou zastoupeny podstatně méně (lithium 18 ppm, rubidium 78 ppm, cesium 2,6 ppm a francium 2.10-18 ppm; zemský povrch do hloubky 1 km obsahuje 15 g francia jako produktu rozpadu 227Ac). Nacházejí se v rozmanitých minerálech a pro značně rozdílné iontové poloměry nikoliv společně. V přírodních roztocích (mořská voda) je dostupný zejména chlorid sodný (3 %, Mrtvé moře 20 %; obsah Ca2+, Mg2+ a SO42− způsobuje vlhnutí produktů získaných z tohoto zdroje), draselné soli se zde vyskytují v podstatně menších koncentracích (0,06 % KCl, Mrtvé moře 1,5 %; nižší obsah oproti sodíku je dán menší rozpustností draselných solí a pevnějším poutáním kationtů draselných v křemičitanech tvořících zemskou kůru). Technicky významnými minerály lithia jsou lepidolit K2Li3Al4Si7O21(OH,F)3 a spodumen LiAlSi2O6, sodíku kamenná sůl (halit) NaCl (ložisko u Cheshire v Anglii o rozměrech 60×24×0,4 km obsahuje 1011 tun chloridu sodného), trona Na2CO3.NaHCO3.2H2O, kryolit Na3AlF6, Glauberova sůl Na2SO4.10H2O, glauberit Na2SO4.CaSO4 a chilský ledek NaNO3 a draslíku karnalit KCl.MgCl2.6H2O, kainit KCl.MgSO4.3H2O a sylvín KCl. Minerál rubidia není znám (sloučeniny rubidné se získávají ze zbytků po zpracování lepidolitu), cesium obsahuje křemičitan pollucit (Cs4Al4Si9O26.H2 O, naleziště u jezera Bernic v Kanadě).
Alkalické kovy jsou stříbrobílé neušlechtilé kovy s malou hustotou (lithium s 0,534 g.cm-3 má nejmenší hustotu ze všech pevných látek). Body tání jsou v rozmezí 28,6 (Rb) až 180,5 °C (Li; slitina 12 % Na, 47 % K a 41 % Cs má s -78 °C nejnižší bod tání ze všech kovových slitin), body varu spadají do intervalu 688 °C (Rb) až 1347 °C (Li). Všechny alkalické kovy jsou velmi měkké (dají se řezat nožem, nejměkčí je cesium), dobře vedou elektřinu i teplo (elektrická vodivost sodíku je při laboratorní teplotě 3× nižší než u stříbra), elektronegativita se pohybuje mezi 1,0 až 0,7. Krystalují v kubických prostorově centrovaných mřížkách.
Většina vlastností alkalických kovů se pravidelně mění v závislosti na atomovém čísle prvku (elektronegativita, ionizační energie, atomové a iontové poloměry). Pozoruhodnou výjimkou jsou redoxní potenciály (Li -3,03 V, Na -2,713 V, K -2,925 V, Rb -2,93 V a Cs -2,92 V), podle nichž by se nejelektropozitivnějším kovem jevilo lithium. Jev souvisí s malým rozměrem a velkou hydratační energií kationtu lithného. Všechny sloučeniny alkalických kovů jsou bezbarvé, nezpůsobuje-li zbarvení aniont nebo poruchy krystalových mřížek. Většina jich je dobře rozpustná v polárních rozpouštědlech jako silné elektrolyty s výjimkou některých lithných (fluorid, uhličitan, fosforečnan) a draselných solí (KClO4, K2[SiF6], K2 [PtCl6], KHC4H4O6 a K3 [Co(NO2)6]). Solím alkalických kovů se podobají soli kationtů amonného NH4+ a thallného Tl+ (někdy jsou proto označovány jako pseudoalkalické kovy). Sloučeniny alkalických kovů barví charakteristickým způsobem plamen (lithium karmínově červeně, sodík žlutě, draslík, rubidium a cesium fialově) a této vlastnosti se využívá k jejich důkazu i kvantitativnímu stanovení.
Alkalické kovy uplatňují ve sloučeninách prakticky výlučně oxidační stupeň +I. Přítomnost jediného valenčního elektronu je příčinou slabé vazebné interakce v kovu (důsledkem jsou nízké hodnoty bodů tání a varu i disociačních, výparných a sublimačních enthalpií). Všechny prvky této skupiny mají relativně velké atomové a iontové poloměry. Nízké hodnoty elektronegativit a prvních ionizačních energií způsobují, že ve sloučeninách alkalických kovů se uplatňuje převážně iontová vazba. Podíl kovalence činí několik procent (NaCl) až ≈ 1/3 (LiI). Sloučeniny lithné jsou většinou rozpustné v nepolárních organických rozpouštědlech v důsledku výraznějšího uplatnění kovalentní interakce. Čistě kovalentní nepolární vazbu lze předpokládat v homoatomických molekulách M2 existujících v plynné fázi (jejich stabilita se snižuje od lithia k cesiu).
Alkalické kovy jsou vysoce reaktivní a mají silné redukční schopnosti (jsou schopny redukovat řadu kovů a polokovů z jejich sloučenin), které se zvyšují od lithia k cesiu.
SiF4 + 4 K → Si + 4 KF
Na vzduchu se snadno oxidují a pokrývají nekompaktní vrstvou oxidačních produktů. Interakci se vzdušným kyslíkem významně ovlivňuje přítomnost vlhkosti. Uskladňují se proto pod inertním rozpouštědlem (petrolejem). S vodou prudce reagují za tvorby příslušného hydroxidu a uvolňování vodíku (cesium se už v přítomnosti stop vlhkosti zapaluje)
2 M + 2 H2O → 2 MOH + H2
Snadno redukují i řadu dalších nekovů, někdy má reakce explozívní charakter (reakce draslíku, rubidia nebo cesia s bromem nebo se sírou). Schopnost tvořit hydráty klesá od lithia k cesiu, s alkoholy ROH se tvoří alkoholáty RO−M+ (R = alkyl, aryl). Roztoky alkalických kovů v kapalném amoniaku a některých alifatických aminech (méně stabilní roztoky než v amoniaku, rozkládají se na příslušný substituovaný amid a vodík) mají extrémně silné redukční schopnosti. Zelený paramagnetický roztok adiční sloučeniny tvořící se reakcí sodíku s naftalenem v tetrahydrofuranu (použitelné jsou i jiné ethery) lze za pří tomnosti (CH3)2PCH2CH2P(CH3)2 využít k redukci bezvodých halogenidů některých kovů (V, Cr, Mo, W, Fe, Co) vedoucí k přípravě komplexů, v nichž má kov oxidační číslo nula. Některé kovy (Zn, Cd, Hg, Tl, Sn, Pb) tvoří v amoniaku s alkalickými kovy intermetalické sloučeniny (NaZn, NaHg8, NaHg18, KPb2). Objemné kationty Rb+ a Cs+ (také NR4+) mají schopnost stabilizovat velké (např. polyhalogenidové) anionty.
Chemicky se lithium více než ostatním alkalickým kovům podobá hořčíku (hořením obou prvků vznikají oxidy; hydroxidy, fluoridy, uhličitany a fosforečnany jsou málo rozpustné; chloristany jsou naopak rozpustné velmi dobře; uhličitany a hydrogensulfidy se termicky rozkládají před bodem tání; hydrogenuhličitany nejsou známy; karbidy a nitridy snadno vznikají přímou reakcí prvků; sírany netvoří kamence; chloridy a alkylsloučeniny jsou rozpustné v organických rozpouštědlech; ionty mají sklon k hydrataci; malá velikost iontů nedovoluje stabilizaci větších aniontů), protože rozměry jejich kationtů jsou si velmi blízké (rLi+ = 76 pm, rMg2+ = 72 pm; rNa+ = 102 pm). Lithium se od ostatních alkalických kovů liší také termickou stabilitou svého hydridu (taví se bez rozkladu), rozkladem hydroxidu na oxid a nikoliv na nestálý peroxid nebo hyperoxid, stabilitou monohydrátu LiOH.H2O a tvorbou imidu lithného LiNH.
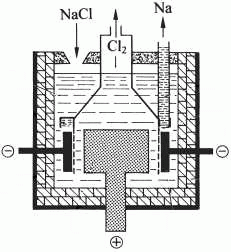
Sodík se vyrábí elektrolýzou taveniny 40 % chloridu sodného a 60 % chloridu vápenatého při 580 °C (bod tání NaCl je 808 °C). Používá se grafitová anoda a železná katoda, katodický prostor musí být oddělen od anodického diafragmou.
Pro výrobu draslíku není metoda vhodná a v průmyslovém měřítku se proto k jeho výrobě využívá redukce roztaveného chloridu draselného sodíkem (850 °C, vzniklá slitina sodíku a draslíku se dělí destilací). Rubidium a cesium se připravují zahřívání svých hydroxidů nebo oxidů s hořčíkem v proudu vodíku nebo redukcí chloridů vápníkem ve vakuu.
Největší praktický význam má sodík. Přibližně 60 % jeho produkce se ve formě slitiny s olovem používá k výrobě tetraethylplumbanu Pb(C2H5)4 jako antidetonátoru do paliv pro výbušné motory, dalších 20 % jako redukovadlo při výrobě kovů (titan, zirkonium). Je surovinou pro výrobu peroxidu, amidu, hydridu a kyanidu sodného, uplatňuje se v sodíkových výbojkách, jako složka slitin a spolu s draslíkem jako chladící prostředek v některých typech jaderných reaktorů. Laboratorně sodík slouží k sušení rozpouštědel (diethylether, benzen) a směs chloridu sodného s ledovou drtí se používá jako chladící prostředek (do -18 °C).
Většina produkce (95 %) draselných sloučenin jsou hnojiva (převážně KCl nebo K2SO4; KNO3 je velmi dobré, ale drahé hnojivo). Chlorid draselný je surovinou při výrobě hydroxidu a uhličitanu draselného, bromid draselný (také NaCl, LiF a CsI) se používá ke zhotovování optických prvků a kyvetových okének pro infračervenou spektroskopii.
Lithium zvyšuje tvrdost a odolnost slitin hliníku, zinku, hořčíku a olova (pro konstrukci kosmických lodí používaná velmi pevná slitina LA 141 s měrnou hmotností 1,35 g.cm-3 obsahuje 14 % Li, 1 % Al a 85 % Mg) a používá se rovněž v metalurgii mědi. V posledních desetiletích nabývá na významu řada lithných sloučenin. 34 látek se vyrábí ve velkých množstvích; stearát k zahušťování olejů na mazací tuky, uhličitan pro výrobu porcelánu a použití v lékařství, hydroxid pro adsorpci oxidu uhličitého v kosmických lodích, 6LiD má použití v termojaderných zbraních, LiAlH4 v organické syntéze, ferroelektrický LiTaO3 k modulaci laserových paprsků, LiCl jako pájecí pasta na hliníkové součástky, LiF jako termoluminofor v rentgenové dozimetrii). Výhledově se uvažuje o použití lithia v akumulátorech pro elektromobily (Li/FeSx, elektrolyt LiCl/KCl, pracovní teplota 400 °C).
Cesium snadno uvolňuje elektrony působením světla a používá se k výrobě fotočlánků. Izotop 137Cs slouží jako zdroj záření β− (τ1/2 = 30 let).