Fosfor poprvé izoloval H. Brandt (1669) rozkladem, zahuštěním a vysokoteplotní destilací moči jako voskovitou látku, jejíž páry na vzduchu ve tmě světélkuje. Tato vlastnost dala prvku jeho název (phos = světlo, phoros = nesoucí).
Fosfor je v zemské kůře 11. nejrozšířenějším, pro rostliny i živočichy důležitým biogenním prvkem. Koloběh fosforu v přírodě je ovlivněn tím, že neexistuí žádné jeho těkavé sloučeniny, které by cirkulovaly prostřednictvím atmosféry. Přírodní fosfor je monoizotopický 3115P s jaderným spinem ½. Uměle připravený radioaktivní izotop 3215P (rozpad β−, τ1/2 = 14,28 dne) se používá jako tracer při studiu reakčních mechanismů a pro vnitrotělové ozařování. V přírodě se fosfor nachází výlučně v podobě orthofosforečnanů, nejčastěji využívanými minerály jsou fluoroapatit Ca5F(PO4)3 (amorfní fosforit má podobné složení) a hydroxylapatit Ca5(OH)(PO4)3.
Fosfor tvoří větší počet alotropických modifikacích. Všechny tají na stejnou kapalinu obsahující tetraedrické molekuly P4, které jsou při teplotách nad 800 °C a nízkých tlacích v rovnováze s biatomickými molekulami |P≡P|. Světélkování par (chemiluminiscence) fosforu se využívá pro jeho kvalitativní důkaz (Mitscherlichova zkouška).
Bílý fosfor (b. t. 44,1 °C, b. v. 280,5 °C) je bílá voskovitá samozápalná látka charakteristického zápachu známá ve dvou modifikacích (kubické α- a hexagonální β-, bod přeměny -76,9 °C).

Krystalové struktury obou jsou složité a jejich stavebními kameny jsou tetraedrické molekuly P4 (základní buňka α-formy obsahuje 56 molekul P4).

Termodynamicky je bílý fosfor nejméně stálý ze všech alotropů tohoto prvku, přesto nejčastěji vzniká při přechodu z plynného nebo kapalného skupenství do pevného stavu. Je jedovatý (letální dávka pro člověka je 50 mg, působí i kontaktem s pokožkou), rozpouští se v sirouhlíku, dichlordisulfánu, chloridu fosforitém, kapalném oxidu siřičitém, amoniaku a benzenu. Pro svou samozápalnost se uchovává pod vodou, v níž je nepatrně rozpustný. Je vysoce reaktivní, snadno se slučuje s kyslíkem, halogeny, sírou a některými kovy.

Červený fosfor vzniká zahříváním bílého fosforu v inertní atmosféře. Je nejedovatý, podstatně méně reaktivní než bílý fosfor a v běžných rozpouštědlech nerozpustný. Přeměna bílé na červenou modifikaci je katalyzována jodem, sírou nebo UV zářením, odstín zbarvení preparátů je závislý na způsobu jejich přípravy. Zapaluje se až při 400 °C. Početné modifikace červeného fosforu jsou tvořeny prostorovou sítí vznikající propojením jednotek P4 po přerušení jedné z vazeb P–P.
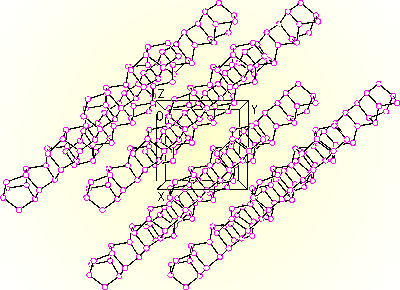

Černý fosfor je nejméně reaktivní (termodynamicky nejstabilnější) modifikací s vyšším stupněm polymerace než červený fosfor. Je polovodič, jeho elektrické vlastnosti významně ovlivňují nečistoty. Známy jsou tři krystalické a amorfní modifikace, všechny tvořené zvlněnými hexagonálními vrstvami atomů fosforu.
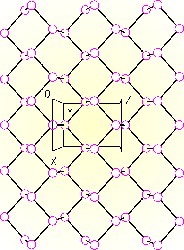 |  |
Černý fosfor se připravuje zahříváním červeného fosforu pod tlakem (1,2 GPa) nebo podstatně pomaleji za normálního tlaku při 370 °C v přítomnosti rtuti.
Preferované oxidační stavy jsou u fosforu analogické jako u dusíku. Tvorba iontů P3− je energeticky nevýhodná, a nejsou proto schopny existence. Oxidační čísla se pohybují v intervalu -III až +V, možnosti geometrického uspořádání jsou velmi pestré. Nejčastější jsou koordinační čísla tři až šest (pro řidší koordinační číslo 9 je známo 14 variant prostorového uspořádání).
Důsledkem poměrně nízké elektronegativity (2,1) je převaha kovalence ve vazbách a neschopnost podílet se na tvorbě vodíkových můstků. Vazby P–H jsou slabší než N–H, na rozdíl od dusíku může fosfor tvořit více než čtyři σ-vazby. K tvorbě π-vazeb fosfor vždy využívá 3d-orbitaly (pπ-dπ vazby), zatímco dusík může tvořit pouze pπ–pπ vazby. To je často příčinou rozdílného chování analogických sloučenin obou prvků. Fosfan (PH3) a jeho deriváty (trifenylfosfan P(C6H5)3) se často uplatňují jako ligandy v komplexech.
Fosfor tvoří binární sloučeniny téměř se všemi prvky (mimo antimonu, bismutu a vzácných plynů). S kyslíkem a halogeny reaguje již za laboratorní teploty, s ostatními po zahřátí.
Oxokyseliny a oxoanionty fosforu jsou četnější než u kteréhokoliv jiného prvku s výjimkou křemíku. Pro všechny tyto sloučeniny je charakteristická tetraedrická koordinace fosforu a pro kyseliny a kyselé soli přítomnost ionizovatelné skupiny -OH. Vodík může být vázán i přímo na atom fosforu, pak ale není ionizovatelný. Řetězení je možné můstky P-O-P i přímými vazbami P-P. Peroxosloučeniny mohou obsahovat jak skupiny POOH, tak i můstky POOP. Je známa i početná skupina heteropolykyselin fosforu. Svými vlastnostmi i strukturou se oxokyseliny fosforu významně liší od analogických sloučenin dusíku.
Fosfor se vyrábí z fosforečnanu vápenatého v elektrických pecích redukcí uhlíkem s použitím písku jako struskotvorné přísady

Většina elementárního fosforu (80–90 % produkce) se spaluje na oxid fosforečný, který je výchozí surovinou pro výrobu kyseliny fosforečné a fosforečnanů (průmyslová hnojiva). Mnoho sloučenin fosforu (především organofosforečné deriváty) se používá při výrobě detergentů, insekticidů a herbicidů.