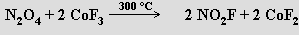Za běžných podmínek jsou stabilní tři molekulové sloučeniny a dvě iontové soli, které lze považovat za binární sloučeniny dusíku s vodíkem. Amoniak NH3 a hydrazin N2H4 mají charakter bazí, azoimid HN3 kyseliny, azid amonný NH4N3 a azid hydrazinia(1+) N2H5N3) solí. Není znám hydrid amonný NH4H, nestabilní jsou diazen (diimid) N2H2 (rozklad nad -180 °C) a tetrazen H2N–N=N–NH2 (rozklad nad -30 °C).
Amoniak NH3 (b. t. -77,7 °C, b. v. – 33,4 °C) je bezbarvý, dráždivý, snadno zkapalnitelný plyn charakteristického štiplavého zápachu.
Jeho molekula má tvar trigonální pyramidy, polarita vazeb N-H je příčinou poměrně vysoké hodnoty dipólového momentu (1,46 D).
 |  |
Je mimořádně dobře rozpustný ve vodě (v 1 litru vody se rozpustí 1 200 litrů amoniaku při 0 °C a 700 litrů při 20 °C), s níž tvoří dva hydráty 2NH3.H2O a NH3.H2O. Ve vodě je slabou bazí (pKb = 4,76), hydroxid amonný NH4OH v molekulární neionizované formě není vzhledem k vazebných možnostem dusíku schopen existence
NH3 + H2O ⇌ NH3.H2O ⇌ NH4+ + OH–

Amoniak má redukční schopnosti
3 CuO + 2 NH3 → 3 Cu + 3 H2O + N2
3 Cl2 + 2 NH3 → 6 HCl + N2
a v kyslíku hoří žlutým plamenem (směs kyslíku s 16–27 % NH3 je výbušná)
4 NH3 + 3 O2 → 6 H2O + 2 N2
Často vystupuje jako ligand v amminkomplexech (z některých nelze amoniak uvolnit ani silnými hydroxidy), z nichž řada má význam v analytické chemii i v průmyslu. Připravuje se hydrolýzou nitridů (laboratorně často využívaná reakce pro přípravu ND3)
Mg3N2 + 6 D2O → 3 Mg(OD)2 + 2 ND3
nebo vytěsněním z amonných solí silnými hydroxidy
NH4Cl + NaOH → NH3 + NaCl + H2O
Průmyslově se amoniak vyrábí Haber-Boschovou syntézou z prvků (výtěžky 20 až 60 %)

Získává se i z čpavkových vod v plynárnách a koksovnách, varem roztoků amonných solí s vápenným mlékem a rozkladem kyanamidu vápenatého přehřátou vodní parou
CaCN2 + 3 H2O → CaCO3 + 2 NH3
V přírodě amoniak vzniká při rozkladu organických dusíkatých sloučenin. Využívá se k výrobě kyseliny dusičné, průmyslových hnojiv, sody Solvayovou metodou, jako chladící medium a reagencie v analytické chemii.
Soli amonné jsou pevné, krystalické, ve vodě většinou velmi dobře rozpustné látky (málo rozpustné soli tvoří kation amonný s anionty PtCl62− a [Co(NO2)6]3−) obsahující kation NH4+ (riont = 143 pm). Podobají se solím draselným a rubidným (riont = 133 resp. 148 pm).
 |  |  |
| NH4+ | Rb+ | K+ |
| 143 pm | 148 pm | 133 pm |
Lze je připravit zaváděním amoniaku do roztoků příslušných kyselin, při zvýšené teplotě se rozkládají většinou za uvolnění amoniaku
NH4Cl ⇌ NH3 + HCl
(NH4)2SO4 → NH3 + NH4HSO4
Termickým rozkladem dusičnanu amonného však vzniká oxid dusný
NH4NO3 → N2O + 2 H2O
Fluorid amonný NH4F krystaluje ve wurtzitové mřížce (ostatní halogenidy amonné jsou strukturní analoga chloridu sodného nebo cesného). Chlorid amonný NH4Cl (salmiak) se používá při pájení kovů a jako součást elektrolytu v Leclanchéových článcích. Sulfid amonný (NH4)2S se připravuje zaváděním sulfánu do vodného roztoku amoniaku a slouží jako analytické činidlo. Síran amonný (NH4)2SO4 je průmyslovým hnojivem, uhličitan amonný (NH4)2CO3 je nestálý (rozklad nastává již při 60 °C).
Po vodě a oxidu siřičitém je kapalný amoniak třetím nejdůležitějším anorganickým rozpouštědlem. Rozpustnost iontových solí je v něm obvykle nižší než ve vodě, nevznikají-li rozpustné komplexy (ve 100 cm3 kapalného amoniaku se rozpustí 207 g ve vodě nerozpustného AgI). Autoprotolytická konstanta při bodu varu (-33 °C) je 10-30 M2 (při -50 °C má hodnotu 10-33 M2)
2 NH3 ⇌ NH4+ + NH2–
srovnej s autoprotolýzou vody
2 H2O ⇌ H3O+ + OH–
Stupnice pH má v kapalném amoniaku rozsah 0 až 30 (0 pro 1 M NH4Cl, 30 pro 1 M KNH2). Neušlechtilé kovy se rozpouštějí v roztocích amonných solí v kapalném amoniaku za vývoje vodíku
M + n NH4+ → Mn+ + n/2 H2 + n NH3
Výjimkou je reakce sodíku s dusičnanem amonným, při níž se tvoří dusnatan disodný
3 Na + NH4NO3 → Na2NO2 + NaOH + NH3
Kovy s-bloku se v kapalném amoniaku rozpouštějí primárně na modré roztoky s vysokou elektrickou vodivostí, které obsahují solvatované ionty kovu a elektrony. Po delším stání za laboratorní teploty z nich krystalují amidy těchto kovů. Amoniak je zásaditější než voda a proto i ve vodě slabé kyseliny (do pKa = 5) jsou v něm zcela disociovány (tzv. nivelizační efekt) a naopak ve vodě silné zásady jsou v něm slabé. Amonolýzou, která je analogií hydrolýzy, vznikají amidy, imidy nebo nitridy
HgCl2 + 2 NH3 → HgNH2Cl + NH4Cl
PCl3 + 6 NH3 → P(NH2)3 + 3 NH4Cl
GeI4 + 6 NH3 → Ge(NH)2 + 4 NH4I
SbCl3 + 4 NH3 → SbN + 3 NH4Cl
Kapalný amoniak je vhodným prostředím pro přípravu sloučenin s neobvykle nízkými oxidačními čísly kovů (K4 [Ni0(CN)4]) a acetylidů (M2C2) i hydrogenacetylidů (MHC2) alkalických kovů.
Amidy jsou bezbarvé krystalické látky s redukčními účinky. Tvoří se rozpouštěním alkalických kovů v kapalném amoniaku za katalýzy chloridu železitého nebo srážením roztoků některých solí kovů alkalických zemin, stříbra, zinku, kadmia, manganu a niklu v kapalném amoniaku alkalickými amidy. Bazicitou převyšuje anion NH2− nejen vodu
NH2− + H2O ⇌ NH3 + OH–
ale dokonce i anion OH−
NH2− + OH− ⇌ NH3 + O2–
Imidy jsou známy jen u lithia, vápníku, germania, cínu a olova. Tvoří se buď termickým rozkladem amidů
2 LiNH2→ Li2NH + NH3
nebo přídavkem alkalického amidu k soli kovového kationtu
PbI2 + 2 KNH2→ PbNH↓ + 2 KI + NH3
Nitridy se tvoří reakcí dusíku s kovy, termickým rozkladem amidů čí imidů
3 Ba(NH2)2→ Ba3N2 + 4 NH3
3 CaNH→ Ca3N2 + NH3
nebo zahříváním některých kovů (i jejich oxidů nebo chloridů) v proudu amoniaku
CrCl3 + NH3→ CrN + 3 HCl
Výjimečně jsou použitelné i srážecí reakce
BiI3 + 3 KNH2→ BiN↓ + 3 KI + 2 NH3
Podle typu vazby se nitridy se dělí do tří skupin. Iontové nitridy (Li3N , Mg3 N2, Be3N2 , Ca3N2) jsou bezbarvé, vodou se rozkládající, krystalické látky (některé z nich jsou explozívní)
Mg3N2 + 6 D2O → 2 ND3 + 3 Mg(OD)2
Intersticiální (kovové) nitridy tvoří přechodné kovy. Často jde o berthollidy s vysokými body tání, značnou tvrdostí (8 až 10 v Mohsově stupnici), dobrou elektrickou vodivostí a chemickou odolností. Nejčastější složení je XN (X = Ti, Zr, Hf, V, Nb, Ta, U) a X2N (X = Mo, W), možné je i jiné (Mn5N2, Mn3N2, U2N3). Z kovalentních nitridů, které tvoří prvky p-bloku, jsou nejznámější nitridy hliníku (AlN) a boru (BN; existuje ve dvou formách analogických grafitu a diamantu) a síry (S4N4).
Fluoroderiváty amoniaku NHnF3-n (n = 0-2) vznikají při elektrolýze taveniny hydrogendifluoridu amonného NH4HF2 (v malém množství se přitom tvoří i plynný difluordiazen F-N=N-F známý ve formě cis- a trans-izomeru). Fluorid dusitý NF3 (b. t. -206,8 °C, b. v. -129 °C) je bezbarvý, chemicky poměrně inertní plyn, který však snadno reaguje s vodíkem
2 NF3 + 3 H2→ N2 + 6 HF
Chloroderiváty NHnCl3-n (n = 0-2) se tvoří zaváděním chloru do roztoku chloridu amonného při vhodném pH (NH2Cl při pH > 8,5, NHCl2 při pH 5 a NCl3 při pH < 4,5). Všechny jsou endotermními výbušnými sloučeninami, které se vodou rozkládají
NH3-nCln + n H2O ⇌ NH3 + n HClO
S amoniakem reagují za vzniku dusíku
NCl3 + 4 NH3→ N2 + 3 NH4Cl
Chloramin NH2Cl a dichloramin NHCl2 jsou za laboratorní teploty schopny existence jen v roztoku, chlorid dusitý NCl3 (b. t. -27 °C, b. v. 71 °C) lze izolovat jako nestálou žlutou olejovitou kapalinu.

Známy jsou i smíšené fluorochloroderiváty. Z bromoderivátů NHnBr3-n lze připravit bromamin NH2Br a dibromamin NHBr2 reakcí bromu s amoniakem v etherickém roztoku, z něhož je nelze izolovat. Přidáním bromu do kapalného amoniaku a odpařením vzniklého roztoku vzniká červenofialový amoniakát bromidu dusitého NBr3.6NH3, který se za laboratorní teploty explozívně rozkládá. Působením vodného roztoku amoniaku na elementární jod se tvoří sraženina amoniakátu jodidu dusitého NI3.NH3 (jododusík), která je extrémně explozívní. V nadbytku amoniaku se rozpouští za tvorby jodaminu NH2I.


Hydrazin N2H4 (H2N-NH2, b. t. 1,4 °C, b. v. 113,5 °C) je bezbarvá, na vzduchu dýmavá kapalina, která se s vodou neomezeně mísí.

Monohydrát N2H4.H2O se připravuje reakcí amoniaku s roztokem alkalického chlornanu v přítomnosti želatiny (F. Raschig, 1907), při níž se jako meziprodukt tvoří chloramin
NH3 + NaClO → NaOH + NH2Cl
NH2Cl + NH3 + NaOH → N2H4 + NaCl + H2O
celkově:
2 NH3 + NaClO → N2H4 + NaCl + H2O
Přídavek želatiny potlačuje nežádoucí reakci vznikajícího hydrazinu s přítomným chloraminem maskováním iontů těžkých kovů, které tuto reakci katalyzují
N2H4 + 2 NH2Cl → 2 NH4Cl + N2
Hydrazin je dvojsytnou bazí (slabší než amoniak, pK' = 6,07, pK'' ≈ 15), která tvoří dvě řady solí. Kationt N2H5+ je ve vodném roztoku stálý, N2H62+ podléhá hydrolýze
N2H62+ + H2O ⇌ N2H5+ + H3O+
Neutralizací hydrazinu kyselinou sírovou lze získat hydrogensíran hydrazinia(1+) N2H5HSO4 (používá se jako redukční činidlo v analytické chemii), síran hydrazinia (1+) (N2H5)2SO4 a bis(hydrogensíran) hydrazinia(2+) N2H6(HSO4)2.
V zásaditém prostředí je hydrazin silným redukčním činidlem. Zapálením na vzduchu rychle a kvantitativně shoří
N2H4 + O2 → N2 + 2 H2O
a energicky reaguje i s halogeny
N2H4 + X2 → N2 + 4 HX
Zahříváním NF3 s mědí vzniká plynný tetrafluorohydrazin N2F4 (b. v. -73 °C), který snadno disociuje na radikály F2N∙ .
Hydroxylamin NH2OH (b. t. 32 °C) je bezbarvá, reaktivní, krystalická, ve vodě dobře rozpustná, látka s vysokou permitivitou.
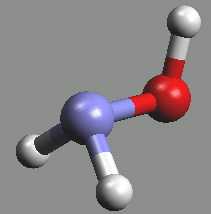
Je slabou zásadou (pKb = 8,18), může působit oxidačně i redukčně. S kyselinami poskytuje soli hydroxylamonné, s aldehydy a ketony oximy (HRC=NOH resp. RR’C=NOH; oximy slouží k přípravě kaprolaktamu, který je meziproduktem při výrobě polyamidových vláken). Připravuje se katodickou redukcí kyseliny dusičné v 50% kyselině sírové nebo redukcí alkalických dusitanů ve slabě kyselém prostředí alkalickým hydrogensiřičitanem
NO2– + 2 HSO3– + H3O+ → NH2OH + 2 HSO4–
nebo z azidů kovů
AgN3 + I2 → IN3 + AgI
Azoimid HN3 (b. t. -80 °C, b. v. 35,7 °C) je bezbarvá, pohyblivá, extrémně jedovatá, explozívní kapalina s pronikavým zápachem. Ve vodném roztoku je poměrně stálý.

Tři atomy dusíku v jeho molekule jsou uspořádány lineárně, popis vazebných poměrů je složitý, protože se uplatňuje jedna lokalizovaná π-vazba i delokalizovaný π-systém.
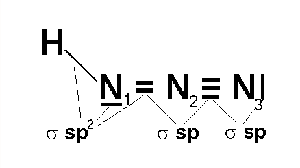

Je přibližně stejně slabou kyselinou jako kyselina octová (pKa = 4,75). Má jak oxidační
Zn + 3 HN3 → Zn(N3)2 + NH3 + N2
tak i redukční vlastnosti
2 HN3 + I2 → 3 N2 + 2 HI
Připravuje se oxidací vodného roztoku hydrazinu kyselinou dusitou (T. Curtis, 1890)
N2H4 + HNO2 → HN3 + 2 H2O
Soli azoimidu se nazývají azidy, podobají se chloridům a lze je připravit reakcí amidu sodného s dusičnanem sodným nebo oxidem dusným
NaNH2 + N2O → NaN3 + H2O
Anion N3− má analogickou elektronovou strukturu jako oxid uhličitý, průměrné oxidační číslo dusíku je 1/3.

Iontové azidy jsou poměrně stálé, kovalentní azidy (Pb(N3)2, AgN3, Hg(N3)2) jsou extrémně explozívní a používají se do rozbušek.
Halogenazidy XN3 (fluorazid FN3 a chlorazid ClN3 jsou plyny, bromazid BrN3 kapalina a jodazid IN3 pevná látka) se připravují z azoimidu
4 HN3 + 2 F2 → 3 FN3 + N2 + NH4F
HN3 + HClO → ClN3 + H2O
Oxid dusný N2O (NNO, b. t. -102,4 °C, b. v. -88,5 °C) je bezbarvý netoxický plyn s nasládlou chuti, málo rozpustný ve vodě. Jeho molekula je lineární (|N≡N=O; rNN = 113, rNO = 119 pm).

Za laboratorní teploty je málo reaktivní, podporuje hoření, protože se při vyšších teplotách rozkládá na prvky. Ke kyselině didusné H2N2O2 má stejný vztah jako oxid uhelnatý ke kyselině mravenčí. Reakce s roztaveným amidem sodným je průmyslově využívána k výrobě azidu sodného, z něhož se vyrábějí všechny ostatní azidy
N2O + NaNH2 → NaN3 + H2O
Oxid dusný se připravuje termickým rozkladem (≈ 250 °C) látek sumárního složení N2O.nH2O, nejčastěji dusičnanu amonného (je možno použít i reakce azoimidu s kyselinou dusitou)
NH4NO3 → N2O + 2 H2O
Používá se jako náplň bombiček sloužících pro přípravu šlehačky, dříve se používal v lékařství jako anestetikum (rajský plyn).
Oxid dusnatý NO (b. t. -163,6 °C, b. v. -151,8 °C) je bezbarvý, ve vodě nerozpustný plyn. Vzhledem k lichému počtu elektronů v molekule je paramagnetický, tendence k dimerizaci je malá a projevuje se jen v kondenzovaných stavech.
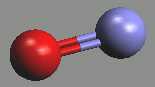
Řád vazby v oxidu dusnatém je 2,5, v kationtu nitrosylovém NO+ má hodnotu tři. Vyrábí se katalytickou oxidací amoniaku vzdušným kyslíkem

nebo přímou syntézou z prvků v elektrickém oblouku
N2 (g) + O2 (g) → 2 NO (g) ; ΔH0 = 176,3 kJ.mol-1
Laboratorně se připravuje reakcí zředěné kyseliny dusičné s mědí
8 HNO3 + 3 Cu → 3 Cu(NO3)2 + 4 H2O + 2 NO

Za zvýšeného tlaku a teploty nad 50 °C disproporcionuje
3 NO → N2O + NO2
Dikyslík ho rychle (neobvyklou reakci 3. řádu s negativním teplotním koeficientem) oxiduje na hnědý oxid dusičitý. Reakcí oxidu dusnatého s oxidem sodným vzniká dusnatan, který snadno disproporcionuje na dusitan a didusnan
4 Na2O + 4 NO → 4 Na2NO2→ 2 Na2O + 2 NaNO2 + Na2N2O2
Oxid dusnatý reaguje s řadou sloučenin přechodných kovů za vzniku nitrosylových komplexů. Jako ligand vystupuje NO jako tří elektronový donor a může se koordinovat lineárně, lomeně nebo jako dvojitý či trojitý můstek. Formálně lze předpokládat, že NO poskytne lichý elektron centrálnímu kovovému kationtu a koordinuje se jako NO+ (v [Fe(NO)(H2O)5]2+, jeho vznik ve formě hnědého proužku se využívá při kvalitativním testu na dusičnany) nebo při opačném přechodu elektronu jako NO− ([Co(NO)(NH3)5]2+).
Oxid dusitý N2O3 je při teplotách pod bodem tání (-102 °C) světlemodrá pevná látka, která je chemickým individuem.

Jeho molekula je nesymetrická (ON–NO2) s poměrně dlouhou vazbou N–N (rNN = 189 pm).
Kapalná ekvimolární směs oxidů dusnatého a dusičitého se chová stejně jako kapalina vzniklá táním oxidu dusitého, protože se nad bodem tání ustavuje rovnováha
N2O3 ⇌ NO + NO2
komplikující studium chemické reaktivity oxidu dusitého. S vodou reaguje oxid dusitý za tvorby kyseliny dusité a lze ho proto považovat za její anhydrid. S koncentrovanými kyselinami poskytuje nitrosylové soli (hydrogensíran nitrosylu NOHSO4 vzniká při komorové výrobě H2SO4).
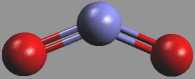
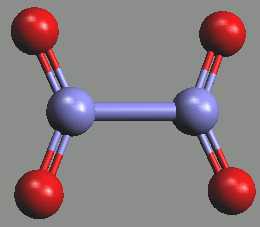
Oxid dusičitý NO2 existuje v pevném stavu jako bezbarvý dimer N2O4 (b. t. -9.3 °C).
V kapalné a plynné fázi se ustavuje rovnováha s červenohnědým monomerem NO2
N2O4 ⇌ 2 NO2; ΔH0 = 57,2 kJ.mol-1
Při bodu varu je obsah monomeru cca 0,1 %, při 100 °C 90 % a disociace je úplná nad 140 °C.
Obrázek 9.7. Ukázka rovnováhy oxidů dusnatého a dusičitého
Ukázka rovnováhy oxidů dusnatého a dusičitéhoPři teplotách blízkých 0 K byla prokázána i existence molekul ON-O-NO2. Tato strukturní forma může hrát určitou roli při autoionizaci oxidu dusičitého
N2O4 ⇌ NO+ + NO3–
Dimer N2O4 má planární strukturu příbuznou aniontu šťavelanovému C2O42− (rNN = 175 pm, rNO = 121 pm a úhel O-N-O = 134°). S malým ionizačním potenciálem oxidu dusičitého (9,91 eV) souvisí možnost existence nitrylových solí obsahujících kation NO2+.
S vodou reaguje NO2 i N2O4 za tvorby kyseliny dusičné
3 NO2 + H2O → 2 HNO3 + NO
Oxid dusičitý snadno vzniká oxidací oxidu dusnatého dikyslíkem
2 NO + O2 → 2 NO2
a laboratorně se připravuje termickým rozkladem dusičnanů těžkých kovů
2 Pb(NO3)2 → 2 PbO + 4 NO2 + O2
Lze ho využít jako rozpouštědlo při přípravě bezvodých dusičnanů kovů a nitrátokomplexů.
Oxid dusičný N2O5 je bezbarvá krystalická látka (b. t. 30 °C) tvořená v pevném stavu ionty NO2+ a NO3−. V roztocích a plynné fázi má povahu molekulární sloučeniny se symetrickou strukturou O2NONO2 a středovým úhlem NON blízkým 180° (krystalickou molekulovou formu lze získat prudkým ochlazením par na -180 °C).
 | 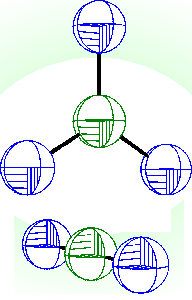 |
N2O5 | NO2+NO3– |
Snadno se rozkládá na oxid dusičitý a kyslík (někdy za výbuchu), s vodou poskytuje kyselinu dusičnou, s peroxidem vodíku ekvimolární směs kyseliny dusičné HNO3 a peroxodusičné HNO4. Nelze ho připravit přímou syntézou z prvků, ale jen dehydratací kyseliny dusičné oxidem fosforečným za nízké teploty
2 HNO3 + 1/2 P4O10 → 2/n (HPO3)n + N2O5
V silných bezvodých kyselinách se ionizuje za tvorby kationtu nitrylového NO2+, což umožňuje snadnou přípravu solí tohoto kationtu
N2O5 + HClO4 → NO2+ + ClO4– + HNO3
Kyselina didusná H2N2O2 je bílá krystalická látka v suchém stavu explozívní. Připravuje se reakcí kyseliny dusité s hydroxylaminem
HONH2 + ONOH → HON=NOH + H2O
Je slabou dvojsytnou kyselinou (pKa' = 7, pKa'' = 11). Alkalické didusnany vznikají redukcí vodných roztoků dusitanů nebo dusičnanů sodíkovým amalgamem. Z vodných roztoků lze volnou kyselinu izolovat vysrážením stříbrné soli a jejím následným rozkladem kyselinou chlorovodíkovou. V didusnanech má anion trans-konfiguraci (existence cis-izomeru se předpokládá v Na2N2O2 připraveném působením oxidu dusnatého na roztok sodíku v kapalném amoniaku).
V komplexech vystupuje jako můstkový nebo chelátový ligand.
Kyselina dusitá HNO2 se v plynné fázi získává reakcí oxidu dusitého s vodní parou
NO (g) + NO2 (g) + H2O (g) ⇌ 2 HNO2 (g)


Vodný roztok této středně silné kyseliny (pKa = 3,35) se získá reakcí dusitanů s neoxidujícími kyselinami. Kyselina dusitá má oxidační i redukční vlastnosti, oxiduje se na kyselinu dusičnou, redukuje na oxid dusnatý, oxid dusný, dusík, hydroxylamin nebo amoniak. Její soli se připravují termickým rozkladem dusičnanů
2 NaNO3 → 2 NaNO2 + O2
nebo jejich redukcí vhodným kovem
KNO3 + Pb → KNO2 + PbO
Jsou dobře rozpustné ve vodě (s výjimkou žlutého AgNO2). Alkalické dusitany se taví bez rozkladu, ostatní se rozkládají.
Anion NO2− je lomený (rNO = 113 až 124 pm a úhelONO = 116 až 132°, vazebné poměry jsou analogické jako v molekule ozonu), v komplexech se může uplatnit jako chelátový i můstkový ligand.

Mírně toxický dusitan sodný NaNO2 (přípustná dávka pro člověka je 8 g/den) se užívá při konzervaci masa a pro výrobu hydroxylaminu a k diazotaci primárních aromatických aminů na diazoniumchloridy, které dále slouží k výrobě azobarviv a léčiv
C6H5NH2 + HNO2 + HCl, aq → (C6H5NN)Cl + 2 H2O
Halogenidy nitrosylu NOX (X = F, Cl, Br; bezbarvý, oranžově žlutý a červený plyn) lze považovat za halogenderiváty kyseliny dusité. Molekuly NOX jsou lomené, jejich stabilita klesá od fluoridu k bromidu, všechny jsou vysoce reaktivní s výraznými oxidačními schopnostmi. Vodou se rozkládají na kyselinu dusitou a halogenovodíkovou. Připravují se přímou syntézou z oxidu dusnatého a příslušného halogenu. Chlorid nitrosylu NOCl je přítomen i ve směsi kyselin dusičné a chlorovodíkové v poměru 1:3, která se jako lučavka královská používá k rozpouštění zlata a platiny spojenému se vznikem ve vodě rozpustných komplexních kyselin H[AuCl4] resp. H2[PtCl6].
Kyselina dusičná HNO3 (b. t. – 41,6 °C, b. v. 82,6 °C s částečným rozkladem) je bezbarvá kapalina, která se světlem částečně rozkládá za uvolňování oxidu dusičitého.
S vodou se neomezeně mísí, zředěné roztoky jsou stabilní. Azeotropická směs obsahuje 68,4 % HNO3 (koncentrovaná kyselina dusičná), dva existující hydráty mají složení HNO3.H2O a HNO3.3H2O. Kyselina dusičná je silným oxidovadlem, které oxiduje kationty železnaté na železité, síru na oxid sírový a fosfor na kyselinu orthofosforečnou. Rozpouští neušlechtilé i ušlechtilé kovy (mimo zlata, platiny, rhodia, iridia, niobu a tantalu). Některé neušlechtilé kovy (železo, chrom, hliník) se v koncentrované kyselině dusičné pasivují. Bezvodou kyselinu lze vakuově vydestilovat ze směsi kyseliny dusičné s kyselinou sírovou (nebo s oxidem fosforečným).
Molekula HNO3 má v plynném stavu planární strukturu s absencí možnosti volné rotace kolem vazby N-O(H).

V bezvodé kyselině dusičné se ustavují autoprotolytické rovnováhy typu
2 HNO3 ⇌ H2NO3+ + NO3–
H2NO3+ + HNO3 ⇌ NO3– + H3O+ + NO2+
Kyselina dusičná je silnou kyselinou, (v 1 M roztoku ionizována z 93 %), v koncentrované kyselině sírové (nitrační směs v organické syntéze) ionizuje jako zásada
2 H2SO4 + HNO3 ⇌ NO2+ + 2 HSO4– + H3O+
Do konce minulého století se kyselina dusičná vyráběla výhradně reakcí koncentrované kyseliny sírové s dusičnany alkalických kovů. Současný postup je založen na katalytické oxidaci amoniaku na oxid dusnatý, jeho následné oxidací vzdušným kyslíkem na oxid dusičitý.

N2O4 reakcí s vodní parou poskytne ekvimolární směs kyseliny dusičné a dusité
N2O4 + H2O → HNO3 + HNO2
Za reakčních podmínek je kyselina dusitá nestabilní a podléhá disproporcionační reakci
3 HNO2 → HNO3 + 2 NO
Oxid dusnatý je přítomným kyslíkem převedem na oxid dusičitý a ten opět vstupuje do reakce s vodou. Výsledkem procesu je proto čistá kyselina dusičná, která je jednou ze tří nejdůležitějších anorganických oxokyselin. Používá se na výrobu hnojiv (80 % její produkce se spotřebuje na výrobu dusičnanu amonného), umělých hmot, výbušnin a léčiv.
Dusičnany lze připravit neutralizačními reakcemi nebo rozpouštěním kovů, jejich oxidů nebo uhličitanů v kyselině dusičné. Všechny jsou velmi dobře rozpustné ve vodě, při vyšších teplotách mají oxidační účinky.


Termicky se rozkládají na dusitany nebo až na oxidy kovů. Anion NO3− (rN-O = 124 pm) je planární, v komplexech může vystupovat jako jedno- až trojfunkční ligand s několika variacemi můstkového uplatnění.
Halogenidy nitrylu NO2X (X = F, Cl) jsou bezbarvé plyny, které lze považovat za halogenderiváty kyseliny dusičné. Mají trigonálně planární strukturu, vodou se rozkládají na kyselinu dusičnou a halogenovodíkovou. Je možno je připravit reakcemi