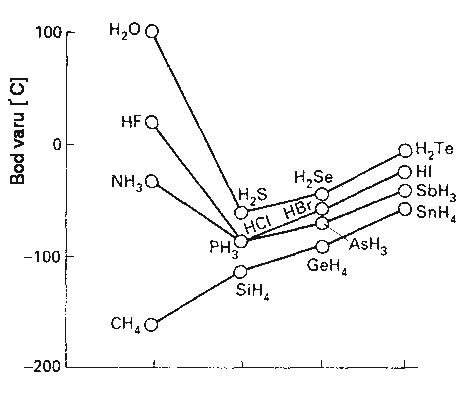
Všechny halogenovodíky HX jsou bezbarvé, ostře páchnoucí, snadno zkapalnitelné plyny. Polarita a pevnost vazby se od fluorovodíku k jodovodíku snižuje.
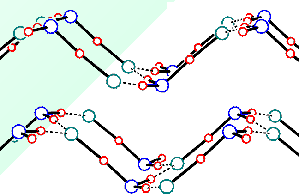
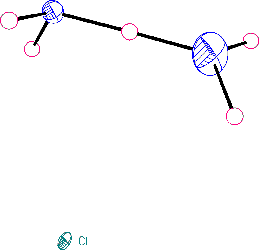
Bod varu fluorovodíku (19,5 °C) je vzhledem k jeho malé molekulové hmotnosti relativně vysoký. Příčinou je existence velmi pevných vodíkových můstků F-H...F v této látce. Molekuly fluorovodíku jsou asociovány ve všech skupenstvích (v parách existuje rovnováha mezi monomerem HF, řetězovitým dimerem (HF)2 a cyklickým hexamerem (HF)6, vodíkové vazby v kapalném fluorovodíku nemají charakter prostorové sítě jako ve vodě nebo kyselině fosforečné).
U ostatních halogenovodíků v plynné a kapalné fázi k asociaci nedochází, v jejich krystalových strukturách se uplatňují nepříliš pevně vázané řetězovité polymery. Kapalný fluorovodík je výborným rozpouštědlem mnoha fluoridů, rozpouštění jiných látek je zpravidla spojeno s jejich solvolýzou a představuje často používanou metodu přípravy bezvodých fluoridů kovů. Ostatní halogenovodíky se pro takové účely používají zřídka (nízké body varu, úzká oblast existence kapalné fáze). Halogenovodíky se připravují přímou syntézou z prvků, reakcí silných netěkavých kyselin s některými halogenidy kovů za zvýšené teploty
CaF2 + H2SO4 → 2 HF↑ + CaSO4
NaCl + H2SO4 → HCl↑ + NaHSO4
nebo hydrolýzou halogenidů fosforitých
PX3 + 3 H2O → 3 HX + H3PO3
Jodovodík se tvoří i reakcí sulfánu s vodnou suspenzí jodu (v plynné fázi reakce probíhá obráceně)
I2 + H2S roztok ⇌ (g) 2 HI + S
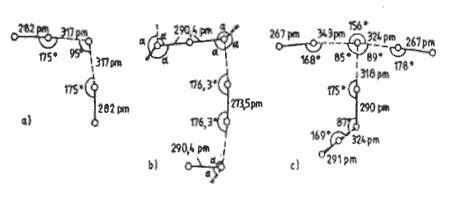
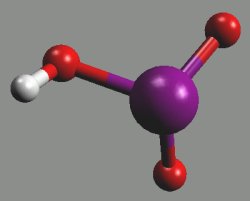
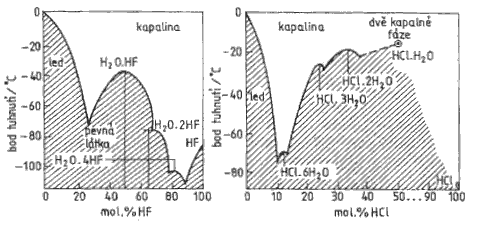
Vodné roztoky halogenovodíků se označují jako kyseliny halogenovodíkové (do prodeje přicházejí roztoky o koncentracích 40 % (HF), 36 % (HCl), 48 % (HBr) a 57 % (HI)). Všechny s vodou tvoří azeotropické směsi (o koncentracích 38 % (HF), 20 % (HCl), 48 % (HBr) a 57 % (HI)). Fluorovodík se s vodou prakticky neomezeně mísí a tvoří s ní tři krystalické sloučeniny nHF.H2O (n = 1, 2 a 4).
Hydráty jsou známy i u ostatních halogenovodíků, ale se stechiometrií HX.nH2O (X = Cl, Br, I; n ≤ 6).
Kyselina fluorovodíková HF je slabou kyselinou v důsledku existence iontových párů [(H3O)+F−] snižujících aktivitu oxoniových kationtů v roztoku. Ostatní halogenovodíkov kyseliny jsou silné a jejich síla se zvyšuje od kyseliny chlorovodíkové k jodovodíkové. Kyselina bromovodíková a jodovodíková jsou ve styku se vzduchem nestálé a uvolňují elementární halogen.
Halogenidy jsou sloučeniny halogenů s elektropozitivnějšími prvky. Fluoridy se od ostatních halogenidů odlišují jak strukturou, tak i charakterem vazby. Jsou známy fluoridy všech prvků mimo helia, neonu a argonu. Některé fluoridy nekovů jsou vysoce inertní (fluoridy uhličitý, dusitý, sírový), jiné naopak extrémně reaktivní (fluorid chloritý). Halogenidy (především iontové) jsou většinou rozpustné ve vodě (malé rozpustnosti halogenidů měďných, stříbrných, thallných, rtuťných a olovnatých se využívá k analytickým účelům) a z roztoku krystalují obvykle ve formě hydrátů, které se často barvou liší od bezvodých solí. Některé z nich nelze termicky dehydratovat, protože přitom podléhají hydrolýze (pak lze využít zahřívání hydrátů s thionylchloridem). Také některé halogenidy nekovů se snadno hydrolyzují (chloridy boritý, křemičitý), jiné jsou naopak vůči působení vody inertní (chlorid uhličitý, fluorid sírový). Soli ně kterých polyatomických aniontů (CN−, OCN−, SCN−, N) se halogenidům blízce podobají a tyto ionty se proto označují jako pseudohalogenidy. Anionty halogenidové se často uplatňují jako terminální nebo můstkové ligandy v komplexech. Podle struktury se halogenidy dělí do tří skupin.
Mezi iontové halogenidy patří většina fluoridů kovů, ostatní halogenidy alkalických kovů, hořčíku, kovů alkalických zemin a některých přechodných kovů (chlorid skanditý, bromid lanthanitý). Mají vysoké body tání a varu, se stoupající hodnotou pomě ru náboje k iontovému poloměru kovu se zvyšuje podíl kovalence ve vazbě (KCl < CaCl2 < ScCl3; TiCl4 je již typicky kovalentní sloučenina). Halogenidy alkalických kovů mají strukturu chloridu sodného nebo cesného. Fluoridy větších kationtů MII krystalují v mřížce fluoridu vápenatého, je-li kovový kation menší, uplatňuje se rutilová struktura.
V polymerních halogenidech jsou atomy halogenů a kationty kovu spojeny kovalentními vazbami do řetězců (Cu2+, Pd2+) nebo vrstev (Zn2+, Cd2+, Mn2+, Fe2+, Co2+, Ni2+). Tvoří je chloridy, bromidy a jodidy kovů (MII a MIII) se střední a vyšší elektronegativitou (1,5 až 2,2). Mají relativně nízké body tání a varu, jsou špatnými vodiči elektřiny. V plynné fázi obvykle tvoří monomerní nebo malé oligomerní molekuly (CdCl2, Al2 Cl6).

Molekulové halogenidy tvoří některé kovy ve vyšších oxidačních stupních (titan, cín, olovo, vanad, niob, molybden, wolfram, osmium), nekovy (uhlík, dusík, fosfor, síra) a polokovy (bor, křemík, arsen, antimon, selen, tellur). Atomy halogenů a kovu jsou spojeny kovalentními vazbami do malých molekul s charakterem daltonidů. Jsou špatnými vodiči elektřiny a obvykle snadno těkají.
K přípravě halogenidů se využívá reakcí prvků s elementárním halogenem
S + 3 F2→ SF6
2 Fe + 3 Cl2→ 2 FeCl3
Hg + I2→ HgI2


rozpouštění neušlechtilých kovů v halogenovodíkových kyselinách
Zn + 2 HCl → ZnCl2 + H2
reakcí oxidů a hydroxidů kovů nebo solí slabých kyselin s halogenovodíky
Ag2O + 2 HF → 2 AgF + H2O
KOH + HCl → KCl + H2O
CaCO3 + 2 HBr → CaBr2 + CO2 + H2O
působení halogenovodíkových kyselin nebo halogenidů alkalických kovů na roztoky solí kovů, jejichž halogenidy jsou nerozpustné
HCl + AgNO3 → AgCl↓ + HNO3
Pb(NO3)2 + 2 KI → PbI2↓ + 2 KNO3
zahřívání některých oxidů s uhlíkem v atmosféře chloru nebo par chloridu uhličitého
SiO2 + 2 C + 2 Cl2 → SiCl4 + 2 CO
2 BeO + CCl4 → 2 BeCl2 + CO2
nebo zahřívání oxidů nebo síranů se směsí chloru a dichlordisulfánu
4 Ln2O3 + 3 S2Cl2 + 9 Cl2 → 8 LnCl3 + 6 SO2 (Ln = lanthanoid)
Fluoridy lze připravit elektrolyticky nebo působením fluorovodíku na chloridy
CrCl3 + 3 HF → CrF3 + 3 HCl
TiCl4 + 4 HF → TiF4 + 4 HCl
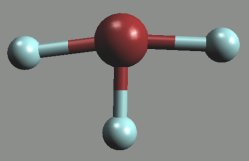
Difluorid kyslíku OF2 (b. v. -145 °C) je jedovatý, světle žlutý, neexplozívní plyn. Vzniká rychlým zaváděním fluoru do ≈ 2% vodného roztoku hydroxidu sodného
2 F2 + 2 NaOH → OF2 + 2 NaF + H2O
Molekula má lomený tvar (αFOF = 103,2°), vazby jsou málo polární.

OF2 je razantním oxidovadlem, s vodou reaguje pomalu. Při delším styku s roztokem hydroxidu alkalického kovu se rozkládá za tvorby dikyslíku a příslušného fluoridu.
Difluorid dikyslíku O2F2 byl připraven účinkem vysokonapěťového elektrického výboje na směs kyslíku a fluoru za nízkého tlaku a teploty. Strukturně je analogický peroxidu vodíku. Je nestabilní, rozkládá se již při -50 °C (τ1/2 = 3 hod.), fotolýzou snadno tvoří radikály •OF. S řadou látek exploduje, v přítomnosti akceptoru fluoridových iontů tvoří soli kationtu dioxygenylového O2+
O2F2 + BF3 → O2+BF4– + 1/2 F2
Difluorid tetrakyslíku O4F2 připravený analogicky je velmi nestabilní a rozkládá se už při -183 °C
Všechny oxidy chloru jsou nestálé, endotermické, často explozívní látky, které nelze připravit přímo z prvků. Některé z nich mají charakter krátce existujících radikálů (ClO), jiné nejsou zatím dostatečně charakterizovány (Cl2O3, ClO4).
Oxid chlorný Cl2O (b. v. 2 °C, nad bodem varu se rozkládá) je žlutohnědý plyn, který se velmi dobře se rozpouští ve vodě za vzniku kyseliny chlorné (je jejím anhydridem). Jeho molekula je lomená (rClO = 171 pm, αClOCl = 111°).
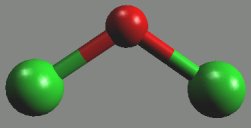
Je velmi silným oxidovadlem, které se připravuje reakcí chloru s oxidem rtuťnatým
2 Cl2 + 2 HgO → Cl2O + HgCl2.HgO
Oxid chloričitý ClO2 (b. v. 11 °C) je žlutozelený plyn kondenzující na hnědočervenou explozívní kapalinu. Lomená molekula (rCl-O = 147 pm, αOClO = 118°) má charakter radikálu, ale snahu tvořit dimer nejeví.
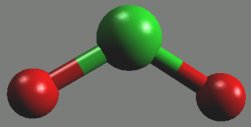
Je silným oxidovadlem, ve vodě se rozpouští na tmavozelený roztok, z něhož lze získat jeho krystalické hydráty ClO2.nH2O (n = 6 až 10). V alkalických vodných roztocích rychle hydrolyzuje na chloritan a chlorečnan, v neutrálních roztocích fotochemicky disproporcionuje na směs kyseliny chlorovodíkové a chlorečné. Připravuje se reakcí chlorečnanu draselného s kyselinou šťavelovou
2 KClO3 + 2(COOH)2 → 2 ClO2 + 2 CO2 + (COOK)2 + 2 H2O
nebo chlorečnanu stříbrného s chlorem
2 AgClO3 + Cl2 → 2 ClO2 + 2 AgCl + O2
nebo chlorečnanu draselného s kyselinou šťavelovou
2 KClO3 + 2 (COOH)2 → 2 ClO2 + 2 CO2 + (COOK)2 + 2 H2O
Za izomer ClO2 lze považovat velmi nestálý a dosud nedostatečně charakterizovaný chlorečnan chlorosylu ClOClO3.
Tmavočervený kapalný oxid chlorový Cl2O6 (b. t. 4 °C) je méně explozívní než oxid chlorný. V krystalickém stavu je tvořen ionty ClO2+ a ClO4−(chloristan chlorylu), v plynném skupenství existuje zřejmě rovnováha mezi monomerem ClO3 a dimerem Cl2O6.
Hydrolýzou poskytuje ekvimolární směs kyselin chlorečné a chloristé. Připravuje se působením ozonu na oxid chloričitý
2 ClO2 + 2 O3 → Cl2O6 + 2 O2
Oxid chloristý Cl2O7 (b. v. 83 °C) je bezbarvá olejovitá kapalina. Molekula je symetrická s můstkem Cl-O-Cl.
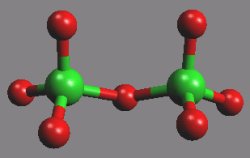
Je anhydridem kyseliny chloristé, jejíž dehydratací oxidem fosforečným při nízké teplotě vzniká. Je nejstálejším z oxidů chloru, přesto při zahřátí nebo nárazu vybuchuje.
Poměrně dobře jsou charakterizovány dva oxidy bromu – oxid bromný Br2O (hnědý) a oxid bromičitý BrO2 (žlutý). Oba jsou stálé jen při nízkých teplotách. Alkalickou hydrolýzou poskytuje oxid bromný bromnany, oxid bromičitý bromidy a bromičnany (na rozdíl od oxidu chloričitého, který tímto způsobem disproporcionuje na chloritany a chlorečnany). Oxid bromný vzniká působením par bromu na oxid rtuťnatý, oxid bromičitý se připravuje reakcí bromu s ozonem

Ze tří známých binárních sloučenin jodu s kyslíkem je nejlépe prostudován oxid jodičný I2O5, který jako jediný oxid halogenů vznikající exotermickou reakcí. Je znám již téměř 200 let (J. L. Gay-Lussac a H. Davy, 1813), avšak předpokládaná symetrická struktura jeho molekuly O2I-O-IO2 byla spolehlivě potvrzena poměrně nedávno (1970).

Termicky (nad 300 °C) se oxid jodičný rozkládá na jod a kyslík, s koncentrovanými kyselinami poskytuje soli jodosylu IO+. Připravuje se dehydratací kyseliny jodičné, kterou reakcí s vodou opět poskytuje. Je silným oxidovadlem, které lze použít pro kvantitativní stanovení oxidu uhelnatého
I2O5 + 5 CO → I2 + 5 CO2
I2O4 bývá formulován jako jodičnan jodosylu IO+IO3− a I4O9 jako jodičnan joditý IIII(IVO3)3. Strukturní data pro I2O4 ukázala, že má charakter řetězového polymeru obsahujícího kyslíkovými můstky spojené atomy jodu ve dvou oxidačních stavech. Sloučenina o složení IO3 také není oxidem jodovým, ale vrstevnatý polymer s IV a IVII v ekvimolárním poměru.
Kyselina fluorná HOF byla ve važitelném množství připravena fluorací ledu (1971). Její molekula je lomená (rHO = 96 pm, rOF = 144 pm a αHOF = 97°).

Těkavostí se podobná fluorovodíku, který často obsahuje jako příměs. Je nestálá, už za laboratorní teploty se rozkládá na fluorovodík a dikyslík (τ1/2 = 30 min.). S vodou rychle reaguje za tvorby peroxidu vodíku, fluorovodíku a dikyslíku.
Kyselina chlorná HClO vzniká spolu s kyselinou chlorovodíkovou reakcí chloru s vodou
Cl2 + 2 H2O ⇌ HClO + H3O+ + Cl–
Reakce je vratná a pro posun rovnováhy vpravo je třeba vázat anionty chloridové pomocí oxidu stříbrného nebo rtuťnatého
2 Cl2 + 2 HgO + H2O → 2 HClO + HgO.HgCl2
Kyselina chlorná je silným oxidačním činidlem oxidujícím chlorovodík na chlor, sirouhlík na oxidy uhličitý a sírový, sulfidy na sírany a soli chromité na chromany. Z roztoku ji nelze izolovat, rozkládá se zahřátím nebo fotolyticky na kyslík, chlor a kyselinu chlorečnou. Je velmi slabou kyselinou (pKa = 7,47). Chlornany MIClO a MII(ClO)2 vznikají zaváděním chloru do vodných roztoků příslušných hydroxidů nebo elektrolýzou roztoků chloridů (nejstálejší jsou chlornany lithný, vápenatý, strontnatý a barnatý). Patří k nejsilnějším oxidovadlům, při zvýšené teplotě disproporcionují na chloridy a chlorečnany. Používají se jako bělicí a desinfekční prostředky.
Kyselina bromná HBrO vzniká spolu s kyselinou bromovodíkovou reakcí bromu s vodou, rovnováha této reakce je však posunuta více vlevo než při analogické reakci chloru. Je slabší kyselinou než kyselina chlorná (pKa = 8,69). Bromnany MIBrO vznikají zaváděním bromu do vodných roztoků hydroxidů nebo elektrolýzou roztoků bromidů. Z roztoku krystalují hydratované soli stálé pouze do teploty 0 °C. Jsou silnými oxidovadly, při zvýšené teplotě disproporcionují na bromidy a bromičnany.
Kyselina jodná HIO se tvoří analogicky jako kyseliny chlorná a bromná a je v této trojici nejslabší kyselinou (pKa = 10,64) schopnou ionizace i jako velmi slabá zásada (pKb = 9,49)
HIO + H2O → I(H2O)+ + OH–
Působí oxidačně, je nestálá a snadno disproporcionuje na kyselinu jodičnou a jod. Analogicky se chovají i její soli jodnany MIIO.
Kyselina chloritá HClO2 je nejméně stálou oxokyselinou chloru existující jen ve zředěných vodných roztocích (kyselina bromitá a joditá, pokud vůbec existují, pak jen krátce ve zředěných vodných roztocích). Připravuje se rozkladem chloritanu barnatého kyselinou sírovou. Má silnější oxidační vlastnosti než kyselina chlorná a je i silnější kyselinou (pKa≈ 2).
Chloritany MIClO2 se připravují redukcí alkalického roztoku oxidu chloričitého peroxidem vodíku
2 ClO2 + O22– → 2 ClO2− + O2
Anion ClO2– je lomený, rClO = 156 pm a αOClO = 111°.

Spolu s chlorečnany vznikají reakcí oxidu chloričitého s roztoky hydroxidů. Zahříváním v roztocích chloritany disproporcionují na chlorečnany a chloridy
3 ClO2– → 2 ClO3– + Cl–
při nižších hodnotách pH (≈ 4) také na chloristany a chloridy
2 ClO2– → ClO4– + Cl–
Chloritany těžkých kovů jsou explozívní. Bromitany jsou velmi nestálé a možnost existence joditanů dosud nebyla spolehlivě potvrzena.
Kyselina chlorečná HClO3 vzniká rozkladem chlorečnanu barnatého kyselinou sírovou. Její koncentrace v roztoku může dosáhnout nejvýše 40 %, je silným oxidačním činidlem i silnou kyselinou. Chlorečnany MIClO3 se připravují disproporcionací chlornanů za tepla (zaváděním chloru do horkých roztoků hydroxidů alkalických kovů) nebo elektrolýzou horké solanky v elektrolyzérech bez diafragmy.
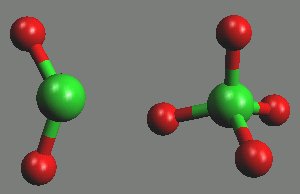
Anion ClO3− má tvar trigonální pyramidy (rClO = 148 pm, αOClO = 106°).

Chlorečnany jsou slabšími oxidovadly než chlornany a chloritany (přesto s hořlavými látkami tvoří výbušné směsi), zahříváním disproporcionují na chloridy a chloristany
4 KClO3 → 3 KClO4 + KCl
a současně se rozkládají na chloridy a kyslík
2 KClO3 → 2 KCl + 3 O2
Kyselina bromičná HBrO3 vzniká oxidací bromu ve vodném roztoku kyselinou chlornou
5 HClO + Br2 + H2O → 2 HBrO3 + 5 HCl
nebo rozkladem bromičnanu vápenatého kyselinou sírovou
Ba(BrO3)2 + H2SO4 → 2 HBrO3 + BaSO4
Podobá se kyselině chlorečné, její roztok lze zahustit na ≈ 50% koncentraci (při vyšších koncentracích nastává rozklad na brom a kyslík). Bromičnany MIBrO3 jsou blízce příbuzné chlorečnanům, průběh jejich termického rozkladu je ovlivněn kationtem (vedle kyslíku vzniká buď brom a oxid kovu anebo bromid kovu), disproporcionace na bromidy a bromistany je termodynamicky nevýhodná a proto neprobíhá.
Kyselina jodičná HIO3 je nejstálejší z oxokyselin jodu, kterou lze získat i v krystalickém stavu.
Připravuje se oxidací jodu ve vodném prostředí
3 I2 + 10 HNO3 → 6 HIO3 + 10 NO + 2 H2O
I2 + 5 Cl2 + 6 H2O → 2 HIO3 + 10 HCl
Dobře se rozpouští ve vodě, má slabší oxidační účinky než kyselina bromičná. Je silnou kyselinou (pKa = 0,77), ale slabší než kyseliny chlorečná a bromičná.
Jodičnany MIIO3 lze připravit analogicky jako bromičnany, jejich krystalizací z roztoků s nadbytkem kyseliny jodičné mohou vznikat i hydrogenjodičnany MI H(IO3)2 a MIH2(IO3)3. Disproporcionace na jodidy a jodistany je termodynamicky nevýhodná a proto neprobíhá, průběh a produkty termického rozkladu jsou analogické jako u bromičnanů. Vysoká stálost jodičnanů umožňuje vytěsnění lehčích halogenů z aniontů XO3− jodem
I2 + 2 XO3− → X2 + 2 IO3− (X = Cl, Br)
U některých redoxních reakcí jodičnanů (s nadbytkem siřičitanu nebo peroxidu vodíku) byl pozorován periodický (oscilující) průběh (střídavé zmodrání a odbarvování roztoku obsahujícího škrob indikuje periodické změny v přítomnosti volného jodu).
Kyselina chloristá HClO4 (b. t. -112 °C) je bezbarvá olejovitá kapalina, která se připravuje působením kyseliny sírové na chloristan draselný. Je nejstálejší oxokyselinou chloru, vakuovou destilací ji lze získat bezvodou (v tomto stavu s organickými látkami prudce exploduje).

Monohydrát kyseliny chloristé H3O+ClO4− je za laboratorní teploty krystalická látka. Jde o silné, ale ve vodném roztoku nepříliš razantní (vzhledem k vysoké kinetické aktivační bariéře) oxidovadlo a současně o jednu z nejsilnějších anorganických kyselin (pKa = -11).
Chloristany MIClO4 vznikají termickým rozkladem chlorečnanů, k jejich přípravě se však výlučně využívá elektrolytická oxidace chlorečnanů. Většina nepříliš reaktivních chloristanů je dobře rozpustná ve vodě (poměrně málo se rozpouštějí chloristany alkalických kovů a chloristan amonný). Žíháním se rozkládají na chloridy a kyslík. Anion chloristanový se zřídka uplatňuje jako ligand v komplexech.
Kyselina bromistá HBrO4 byla připravena z bromistanu sodného pomocí ionexu. Je schopna existence pouze v roztocích (rozkládat se začíná, překročí-li její koncentrace 55 %). Ve zředěném vodném roztoku je nepříliš účinným oxidovadlem a silnou kyselinou.
Bromistany MBrO4 lze připravit elektrolýzou bromičnanů nebo účinkem fluoridu xenonatého či elementárního fluoru na roztok bromičnanu (1969; předchozí neúspěchy pokusů o jejich přípravu byly dány faktem, že ozon a peroxodisírany zřejmě z kinetických důvodů nejsou schopny bromičnany na bromistany oxidovat, přestože podle hodnot redoxních potenciálů by tyto reakce měly probíhat). Bromistany jsou méně stálé než bromičnany, zatímco chloristany jsou naopak stálejší než chlorečnany.
Jsou známy čtyři řady jodistanů, které ve vodném prostředí představují rozsáhlý rovnovážný systém v němž probíhají reakce deprotonizační, dehydratační i agregační.
Kyselina pentahydrogenjodistá (orthojodistá) H5IO6 se připravuje anodickou oxidací kyseliny jodičné nebo působením koncentrované kyseliny dusičné na Ba5 (IO6)2. Tvoří bezbarvé krystaly dobře rozpustné ve vodě, které se termicky rozkládají na oxid jodičný, dikyslík a vodu.

Je silným oxidačním činidlem a nepříliš silnou kyselinou (pKa = 3,29), což je podmíněno vysokým počtem OH-skupin v její molekule. Normální soli kyseliny pentahydrogenjodisté se tvoří termickým rozkladem jodičnanů
5 Ba(IO3)2 → Ba5(IO6)2 + 4 I2 + 9 O2
Průmyslově se používá anodické oxidace jodičnanu sodného, při níž vzniká dihydrogenjodistan trisodný Na3H2IO6 (známy jsou i tetrahydrogensoli, NaH4IO6.H2O). Možná je i oxidace jodidů, jodu nebo jodičnanů v alkalickém roztoku chlorem
IO3− + 6 OH– + Cl2 → IO4– + 2 Cl– + 3 H2O
Anion IO65− je pravidelným oktaedrem, který je schopen jako chelátový ligand stabilizovat neobvykle vysoké oxidační stavy kovových kationtů (CuIII, AgIII, NiIV, MnIV).
Kyselinu hydrogenjodistou (metajodistou) HIO4 lze připravit opatrnou vakuovou dehydratací (100 °C) kyseliny pentahydrogenjodisté (další dehydratací nevzniká I2O7, ale uvolňuje se kyslík a tvoří se oxid jodičný). V roztoku přechází opět na H4IO64−. Její soli vznikají oxidací jodičnanů alkalických kovů v zásaditém prostředí chlornany
NaIO3 + NaClO → NaIO4 + NaCl
Kyselina heptahydrogentrijodistá H7I3O14 vzniká parciální dehydratací (120 °C) kyseliny pentahydrogenjodisté. Kyselina trihydrogenjodistá H3IO5 není ve volném stavu známa, připraveny byly pouze její soli (Ag3IO5).
Jsou známy čtyři typy interhalogenových sloučenin obecného vzorce XYn (X je těžší halogen než Y a n = 1, 3, 5, 7). Všechny jsou diamagnetické a tvoří je vždy sudý počet atomů halogenů. Fyzikální a chemické vlastnosti těchto látek jsou často průměrem vlastností komponent, které je tvoří. Připravují se přímou syntézou z prvků, o složení produktu rozhoduje poměr komponent v reakční směsi. Všechny jsou vysoce reaktivní a práce s nimi vyžaduje nejen speciální preparativní postupy, ale i nádoby ze speciálních materiálů (nikl, Monelův kov, teflon). Reaktivita fluoridů halogenů se snižuje v pořadí ClF3 > BrF5 > IF7 > ClF > BrF3 > IF5 > BrF > IF3 > IF. Při stejném stechiometrickém složení se u těžších halogenů reaktivita snižuje v pořadí Cl > Br > I a pro daný halogen reaktivita klesá v řadě XF5 > XF3 > XF.
Interhalogeny XY jsou vysoce reaktivní sloučeniny (v chemické syntéze nachází uplatnění nejčastěji fluorid chlorný ClF), jejichž termická stabilita se snižuje v řadě ClF > ICl ≈ IBr > BrCl > BrF ≈ IF.
Vodou a vodnými roztoky hydroxidů alkalických kovů se rozkládají
XY + 2 H2O → H3O+ + Y– + HXO
S halogenidovými anionty reagují jako Lewisovy kyseliny za tvorby aniontů polyhalogenidových
ClF + F– → ClF2–
Vůči některým fluoridům se chovají jako Lewisovy baze a tvoří kationty X2Y+
BF3 + 2 ClF → (Cl2F)+(BF4)–
Jejich taveniny vedou elektrický proud v důsledku ionizace
3 IX → I2X+ + IX, (X = Cl, Br)
Interhalogeny XY3 jsou známy čtyři. Fluorid chloritý ClF3 (jedna z nejreaktivnějších látek vůbec) a fluorid bromitý BrF3 jsou dobře charakterizované molekulové sloučeniny, fluorid joditý IF3 je extrémně nestabilní a dimerní chlorid joditý I2Cl6 je žlutá pevná látka snadno se rozkládající na chlorid jodný a chlor.
Podobně jako interhalogeny XY jsou i XY3 Lewisovými amfolyty, autoionizace je podle vodivostních měření u ClF3 nepatrná, u BrF3 zřetelná. Obě tyto látky se vyrábějí průmyslově (ClF3 byl experimentálně testován jako součást raketových paliv). Lze je využít i jako rozpouštědla, obvykle při reakcích, jichž se účastní.
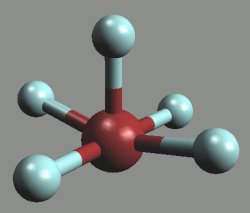
Z vyšších interhalogenů jsou známy pouze čtyři fluoridy (ClF5, BrF5, IF5 a IF7). Molekuly prvních tři mají tvar tetragonální pyramidy, molekula fluoridu jodistého IF7 je pentagonální bipyramidou.
 |  |
BrF5 | IF7 |
Acidobazické vlastnosti jsou analogické nižším homologům (tvorba iontů IF6+ a IF8− při reakcích IF7). Všechny se uplatňují jako fluorační činidla, s fluoridem jodičným lze jako s jedinou interhalogenovou sloučeninou pracovat i ve skleněných aparaturách.
Opatrnou hydrolýzou interhalogenových sloučenin, jejich reakcí se solemi oxokyselin nebo oxidy halogenů vznikají fluorid-oxidy halogenů. Bylo tak připraveno pět fluorid-oxidů chloru (od nestálého FClO až po téměř inertní FClO3), dva bromu a pět jodu. Převážně se jedná o velmi reaktivní látky s charakterem Lewisových amfolytů, které se strukturou i chemickým chováním blí zce podobají fluoridům halogenů.
Z polyhalogenidových aniontů je nejstálejší anion trijodidový I3−, větší částice existují v kombinacích s velkými kationty ([(CH3)4N]I5, RbIFCl3, RbI9). Anion I82− má tvar písmene Z, největším dosud známým polyjodidovým aniontem je planární (vysoce symetrická) částice I164−.
Termická stabilita triatomických polyhalogenidových iontů vzrůstá v pořadí Br2Cl− < BrCl2− < Br3− < I2Br− < ICl2− < IBr2− < I3− (Stabilita obecně vzrůstá s velikostí centrálního atomu a symetrií částice). Polyhalogenidové anionty se obvykle připravují adicí halogenidového aniontu k interhalogenu. Cesná sůl aniontu obsahujícího tři různé halogeny byla připravena reakcí
CsBr + ICl → CsClBrI
Kationty XY2n− vznikají reakcemi interhalogenů s akceptory halogenidových aniontů. Jejich zbarvení se prohlubuje se zvyšující se atomovou hmotností halogenů. Tříatomové částice jsou lomené, pětiatomové mají tvar písmene T a pro sedmiatomové je obvyklé oktaedrické uspořádání. Existují rovněž kationty X2+, v případě jodu známé (1966) v jeho modrých roztocích v oleu nebo kyselině fluorosírové (dimerizace I2+na I42+ v HSO3F se projeví změnou barvy z modré na červenou). Podařilo se připravit i soli tříatomových a pětiatomových částic X3+ (X = Cl, Br, I) a X5+ (X = Br, I). Kationty X3+ jsou na rozdíl od aniontů trihalogenových X3− lomené a částice X5+ jsou planární (středová trojice atomů X tvoří přímku a vazby k oběma koncovým atomům X, které jsou vůči sobě v trans-poloze, s ní svírají úhel ≈ 100°).
![Anion [H4MnVI(IO3)3 ] 7−](resources/IO6.jpg)