Výzkum
Předmětem našeho výzkumu je hledání odpovědí na následující otázky:
- Jaké jsou funkce telomer při zajištění genetické stability buněk?
- Jaký je strukturně-funkční vztah molekulárních komponent telomer?
- Co je podstatou specifických interakcí proteinů a nukleových kyselin?
Při výzkumu používáme lidské proteinové komplexy a srovnáváme je s analogickými biomolekulárními soustavami v rostlinných a kvasinkových modelových organismů, což umožňuje mapovat vývoj účinných molekulárních mechanismů při zachování a přenosu genetické informace.
Telomery jako molekulární hodiny života buňky
Telomery jsou nukleoproteinové komplexy, které tvoří konce chromozomů. Telomery zajišťují integritu genetické informace. Lidské telomery sestávají z DNA tvořené z tandemových repetic TTAGGG a asociovaných proteinů. Díky telomerám je vyřešen problém replikace zaostávajícího řetězce DNA. Navíc, speciální lasovité struktury vytvářené telomerami zabraňují nechtěnému rozpoznávání konců chromozomů jako dvouřetězcových zlomů.
 V somatických buňkách při každém buněčném dělení dochází ke zkracování telomerické DNA. Zkrácení telomer pod určitou délku vede k senescenci a apoptóze. Zkracování telomer může být odvráceno telomorázou, reverzní RNA polymerázou, která prodlužuje konce chromozomů. Zatímco v somatických buňkách je telomeráza zpravidla neaktivní, v nádorových a zárodečných buňkách je telomeráza aktivní. Telomeráza přispívá k „nesmrtelnosti“ rychle se dělících buněk.
V somatických buňkách při každém buněčném dělení dochází ke zkracování telomerické DNA. Zkrácení telomer pod určitou délku vede k senescenci a apoptóze. Zkracování telomer může být odvráceno telomorázou, reverzní RNA polymerázou, která prodlužuje konce chromozomů. Zatímco v somatických buňkách je telomeráza zpravidla neaktivní, v nádorových a zárodečných buňkách je telomeráza aktivní. Telomeráza přispívá k „nesmrtelnosti“ rychle se dělících buněk.
Kdybychom byly schopni ovlivňovat aktivitu telomerázy v nádorech, přispělo by to k účinnější léčbě rakovinových onemocnění. Aby mohl být nalezen nejvhodnější způsob inhibice telomerázy, je nutno pochopit mechanismus účinku telomerázy a popsat detailně funkce multiproteinových komplexů, které se podílejí na regulaci přístupu telomerázy ke koncům chromozomů.
Ochranný proteinový komplex telomer – shelterin
Přístup telomerázy ke koncům chromozomů je účinně řízen proteinovým komplexem, nazývaným shelterin. Shelterin je tvořen šesti základními proteiny, které chrání konce chromozomů před rekombinací, fúzováním konců a degradací. Ukazuje se, že shelterin je dynamický proteinový komplex se schopností měnit prostorovou strukturu 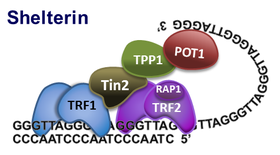 telomerické DNA v součinnosti s dalšími transkripčními faktory.
telomerické DNA v součinnosti s dalšími transkripčními faktory.
K přípravě proteinových komponent shelterinu používáme metody molekulární exprese v bakteriálních kmenech. Jednotlivé proteiny jsou využívány při následných studiích, jejichž cílem je popsat jak afinitu specifických proteinů k DNA, tak vzájemnou afinitu jednotlivých komponent sheterinu. Získané znalosti by měly přispět k pochopení dynamiky vzniku shelterinu a nalezení kroku, který je při sestavení komplexu limitující a tedy vhodným objektem pro budoucí vývoj farmakologických aplikací.
Kvantifikace interakcí biomolekul
Při charakterizaci vazby proteinů na nukleové kyseliny a vzájemných proteinových interakcí využíváme kvantitativní biofyzikální přístupy. Pro stanovení vazebné afinity proteinu na fluorescenčně značený oligonukleotid je využíváno měření anisotropie fluorescence (AF). Principem měření je změna rychlosti rotace značených oligonukleotidů v roztoku po vytvoření objemnějšího komplexu protein-oligonukleotid. Výsledkem je vazebná křivka propisující postupnou vazbu proteinu, ze které lze určit vazebnou afinitu biomolekul.
„Surface plasmon resonance“ (SPR) je metoda založená na fotodetekci vzájemné vazby molekul v reálném čase na povrchu mikrofluidního detekčního čipu. Jedna z molekul je imobilizována na povrchu čipu. Druhá molekula je přítomna v roztoku proudícím přes čip. SPR signál je dán změnou refrakčního indexu v blízkosti povrchu čipu. Refrakční index je přímo úměrný množství navázaných molekul. Ze záznamu SPR lze určit kinetiku a afinitu vazby.
Kombinace metod FA a SPR byla s výhodou využita pro stanovení vazebného mechanismu nově nalezených proteinů obsahujících „single-myb-histon domain“ motiv. Tyto proteiny byly identifikovány v genomu Arabidopis thaliana na základě sekvenční podobnosti s proteiny lidského Shelterinu.
Kvantitativní přístupy také pomáhají odhalovat mechanismus rozpoznání nukleových kyselin specifickými proteiny, které se podílejí na přenosu genetické informace prostřednictvím RNA. Více se o mechanismu rozpoznáváni RNA můžete dozvědět na stránkách spolupracující laboratoře Stefl Lab.
Související publikace
Nečasová I, Janoušková E, Klumpler T, Hofr C.Basic domain of telomere guardian TRF2 reduces D-loop unwinding whereas Rap1 restores it. Nucleic Acids Res. 2017 Sep 13. doi: 10.1093/nar/gkx812. IF 10.2
Janoušková E, Nečasová I, Pavloušková J, Zimmermann M, Hluchý M, Marini V, Nováková M, Hofr C. Human Rap1 modulates TRF2 attraction to telomeric DNA. Nucleic Acids Res. 2015 Mar 11;43(5):2691-700. IF 10.2
Hofr C, Sultesová P, Zimmermann M, Mozgová I, Procházková Schrumpfová P, Wimmerová M, Fajkus J. Single-Myb-histone proteins from Arabidopsis thaliana: a quantitative study of telomere-binding specificity and kinetics. Biochem J. 2009;419:221-8. IF 5.2
Stefl R, Oberstrass FC, Hood JL, Jourdan M, Zimmermann M, Skrisovska L, Maris C, Peng L, Hofr C, Emeson RB, Allain FH. The solution structure of the ADAR2 dsRBM-RNA complex reveals a sequencespecific readout of the minor groove. Cell. 2010;143:225-37. IF 31.2
