Reprodukční vývoj rostlin
Pohlavní rozmnožování rostlin zajišťují květy, které jsou charakteristickým znakem krytosemenných rostlin. Typický oboupohlavný (hermafroditní) květ krytosemenných rostlin tvoří sterilní květní obaly a reprodukční orgány. Tyto orgány jsou organizovány do kruhů. Obr. 3.3 ukazuje uspořádání květních orgánů do čtyř kruhů u A. thaliana. Vnější orgány (perianth) u rostlin tvoří lístky okvětní nebo rozlišené lístky kališní (sepala) a korunní (petala). K reprodukčním orgánům patří tyčinky (stamen), které zajišťují tvorbu samčích mikrospor a plodolisty (carpel) s vajíčky, která obsahují samičí megaspory.
Vegetativní meristém stonku tvoří dvě až tři vrstvy buněk. Buňky vrstvy L1 se dělí antiklinálně a jsou základem epidermálních struktur. Buňky vrstvy L2 popř. L3 jsou základem vnitřních pletiv. Různé endogenní faktory i signály z vnějšího prostředí (teplota, délka dne) spouští přechod z nedeterminovaného vegetativního růstu stonku na determinovaný generativní růst. Jednotlivé orgány květu jsou odvozeny z buněk vegetativního apikálního meristému po jeho přeměně v meristém květenství. Již v raných fázích je květní meristém schopen založit všechny květní orgány a skupiny buněk neboli primordia se diferencují v jednotlivé květní orgány (obr. 3.1).
Proces tvorby květů lze rozdělit do čtyř etap:
- Indukce kvetení, tj. přepnutí z neorganizovaného vegetativního růstu do fáze organizovaného generativního růstu.
- Přeměna vegetativního meristému v meristém květenství. S tím souvisí pozdější tvorba květních primordií, laterálních orgánů a lodyžních lístků.
- Vlastní tvorba květu. Přeměna meristému květenství v meristém květní a s tím související tvorba prekurzorů květních orgánů a jejich další diferenciace.
- Funkční fáze kvetení začíná tehdy, jestliže jsou květní orgány funkční, tzn. mají-li odpovídající strukturu. Dochází ke zrání reprodukčních orgánů, k opylení a oplození.
Geny determinující tyto čtyři fáze vývoje květu lze rozdělit do odpovídajících skupin:
- geny regulující přechod z vegetativního růstu do generativního,
- geny podmiňující tvorbu meristémů květenství,
- geny regulující tvorbu a identitu květních orgánů,
- geny regulující růst květních orgánů a jejich funkčnost.
Rozlišujeme dva typy květenství:
- květenství nedeterminované (racemózní) – „otevřené“, u něhož se na konci osy nevytváří terminální květ, protože terminální meristém květenství zůstává zachován a pokračuje ve tvorbě determinovaných květních meristémů a také primordií laterálních výhonů a lodyžních listů. Př. Arabidopsis, Antirrhinum.
- květenství determinované (cymózní) – „zavřené“, které tvoří pouze jeden květ na konci osy (terminální květ). Př. tabák, petúnie.
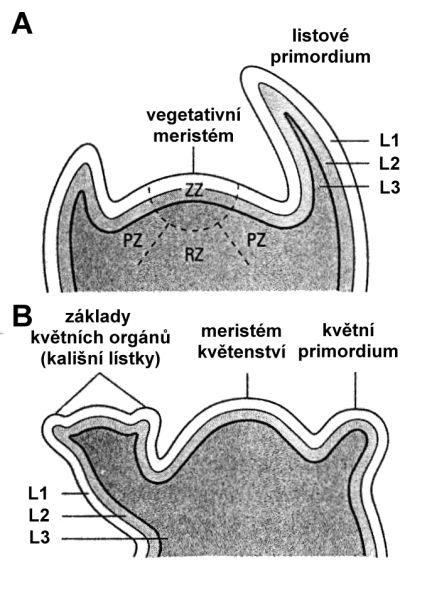
Obr. 3.1 A/ Průřez vegetativním vrcholem stonku. B/ Přeměna vegetativního meristému v květní meristém (L1, L2, L3 – jednotlivé meristematické vrstvy).
(Zdroj: Westhoff et al., 1998)
Geny regulující přechod z vegetativního růstu do generativního
Přechod rostlin do fáze generativního růstu je podmíněn geneticky, ale významnou úlohu hrají i vlivy vnějšího prostředí, jako je délka dne nebo chladové působení a působení giberelinů. Fotoperiodická kontrola kvetení je zprostředkována interakcí fotoreceptorů a endogenními cirkadiálními rytmy. Rostliny mají podle osvětlení dva základní morfogenetické programy:
- fotomorfogeneze – morfogeneze na světle,
- skotomorfogeneze – morfogeneze ve tmě.
Fotomorfogeneze je složitý proces, který zahrnuje více fotoreceptorů a cest přenosu signálu. U A. thaliana byly popsány mutace řady genů, které se účastní různých složek tohoto procesu. Jsou to především dvě základní skupiny mutací, které se vyznačují ve tmě obdobnou morfogenezí jako na světle: det – de/ethiolated a cop – constitutive photomorphogenesis. Každá z těchto typů mutací se vyskytuje v několika různých lokusech.
Tyto geny kódují proteiny, které se účastní přenosu signálu a jejich recesivní neaktivní mutace působí v homozygotním stavu změny exprese mnoha genů.
Jedním z charakteristických znaků morfogeneze klíčních rostlin ve tmě (skotomorfogeneze) je prodlužování hypokotylu. U některých specifických typů mutací A. thaliana dochází k prodlužování hypokotylu i na světle. Takovéto mutace jsou označovány hy. Mutace ve třech lokusech, hy1, hy2 a hy6 jsou mutace syntézy chromoforu fytochromů. Mutace hy3 je mutace genu pro apoprotein fytochromu B a mutace hy8 je mutace genu pro apoprotein fytochromu A. Změny se týkají světlolabilních i světlostabilních proteinů a mohou být reparovány dodáváním prekurzoru chromoforu.
Základní představa přenosu světelného morforegulačního signálu
Světelný signál působí přes změnu konformace fytochromů (fotoreceptorů) a dalších světlosenzitivních proteinů. Tyto proteiny pak působí změny konformace dalších proteinů. Jedná se o kaskádu několika typů proteinů. Kaskáda zahrnuje také nízkomolekulární signální látky, které umožňují přenos signálu do dalších buněk a pletiv rostliny. Je tedy třeba se zabývat těmito otázkami:
- Biochemickou analýzou fotoreceptorů.
- Identifikací sekvencí DNA, působících v cis a trans-aktivačních faktorech, které řídí aktivitu podřízených genů regulovaných světlem.
- Genetickou analýzou drah působení fytohormonů a cest přenosu signálu, které ovládají vývoj chloroplastů.
Vývoj chloroplastů zahrnuje časově řízenou biosyntézu jejich komponent a vyžaduje koordinovanou expresi jaderných a chloroplastových genů. K počátečním stadiím vývoje chloroplastů z proplastidů dochází v průběhu tvorby mezofylových buněk z nediferencovaných meristematických buněk. K iniciaci tohoto procesu jsou nutné signály červeného nebo modrého světla. Pro další fáze je nutný silný tok bílého světla. Rozeznáváme čtyři stadia vývoje chloroplastů:
- Na konci prvého stadia vývoje chloroplastů v dělících se buňkách v průběhu vývoje listů je současně skončena většina dělení mezofylových buněk.
- Ve druhém stadiu, stadiu "výstavby" chloroplastů, dochází ke zvyšování počtu chloroplastů v buňce a ke zvyšování objemu chloroplastů. Pokračuje růst listů, ale spočívá většinou ve zvyšování objemu buněk. Dochází k vysokému stupni exprese chloroplastových genů.
- Třetí fáze vývoje chloroplastů je udržovací fáze. Fotosyntetická kapacita je udržována na stálé úrovni, která je určena světlem. Dochází ke střednímu stupni exprese genů kódovaných světlem.
- Poslední fází je senescence. Počet i objem chloroplastů klesá a exprese genů regulovaných světlem klesá jen asi na 10 % maxima.
Jiný je vývoj chloroplastů ve tmě, skotomorfogeneze. Jestliže dochází k vývoji ve tmě, proplastidy kotyledonů začínají vývoj v chloroplasty, ale vývoj skončí o etioloplastů, pro které je charakteristický nepravidelný tvar a centrální parakrystalické prolamelární tělísko. Nedochází k žádné nebo dochází jen k velmi nízké expresi genů regulovaných světlem. Jestliže jsou etiolované rostliny přeneseny na světlo, z etioloplastů se vyvíjejí chloroplasty.
Rostliny mají akceptorové proteiny (receptory), které procházejí dvěma konformačními stavy a tyto stavy se mění na základě přijetí kvant světelného záření určité vlnové délky. Byly prokázány čtyři hlavní typy fotoreceptorů:
- Citlivé na červené/dlouhé červené záření (600–700 nm), fytochromy (PHY),
- Citlivé na modré, případně modré/UV záření (400–500 nm), kryptochromy (CRY),
- Citlivé na modré a UV-A záření, fototropiny (PHOT),
- Citlivé na UV-B záření, dosud neidentifikované fotoreceptory.
Primárním receptorem červeného a dlouhého červeného záření jsou nejlépe prostudované fytochromy. Jsou to rozpustné chromoproteiny, které tvoří dimery, skládající se ze dvou stejných polypeptidů 120-127kD, z nichž každý je kovalentně připojen k tetrapyrolovému chromoforu. Tento pigmentproteinový komplex může procházet reverzibilně, na základě fotoindukce, dvěma stavy a má dvě možné formy:
- Formu absorbující červené světlo, Pr (Amax 666–668 nm),
- Formu absorbující dlouhé červené záření, Pfr (Amax 730–734 nm).
Pfr je fyziologicky aktivní forma a již nízké intenzity červeného světla mění Pr na Pfr a aktivuje odpověď.
První typ apoproteinů, který se označuje jako typ A, je kódován genem označovaným u A. thaliana gen PHYA. Fytochrom se hromadí ve tmě a na světle se rychle rozkládá. Kromě toho na světle dochází i k rychlému odbourání již syntetizované odpovídající mRNA a poklesu další transkripce. Odlišným typem fytochromu je typ B, který je světlostabilní a ani jeho biosyntéza není regulována světlem. Jeho apoprotein je kódován genem PHYB. Tento fytochrom řídí především odpovědi na konec dne, jako je stimulace prodlužování stonku dlouhým červeným zářením.
U A. thaliana byly klonovány geny pro další tři apoproteiny fytochromů, PHYC, PHYD, PHYE, ale jejich biologická funkce zatím není prostudována. Celkem tedy bylo identifikováno pět genů pro fytochromy.
Primární mechanizmus změny konformace fytochromů není znám, ale podílí se na něm fosforylace. Existují proteinkinázy, které jsou v komplexu s fytochromy. Aktivované fytochromy jsou translokovány z cytoplasmy do jádra. Zde interagují s transkripčními faktory a tak regulují světlem indukovanou transkripci dalších genů: PHYA je v cytoplazmě autofosforylován a funguje jako kináza, která fosforyluje Phytochrom Kinase Substrat1 (PKS1). PHYA může interagovat s proteinovou fosfatázou (FyPP). FyPP defosforyluje PHYA prostřednictvím konformačních změn a aktivovaný PHYA je v této formě translokován do jádra. V jádře PHYA a PHYB interagují s transkripčním faktorem PIF3 (Phytochrome Interacting Factor3), který umožňuje vazbu na promotory genů regulovaných světlem. Tyto promotory obsahují motivy LRE umožňující tuto vazbu. Kináza CKII zprostředkovává fosforylaci transkripčního faktoru HY5 (Elongated hypocotyl in light5), který je další klíčovou složkou fytochromové signalizační kaskády.
Co se týče druhých poslů, předpokládá se, že hlavními z nich jsou heterotrimerické G-proteiny, i když definitivně to zatím prokázáno nebylo. Další prvky, které navazují v této regulační kaskádě, jsou již vidlicovitě rozvětvené. Je to jednak systém Ca++ – kalmodulin a jednak cGMP. Systém vápníku způsobuje především stimulaci vývoje chloroplastů. Systém cGMP se uplatňuje především při aktivaci enzymu chalkonsyntázy a drah syntézy fotoprotektivních flavonoidů a antokyanů, ale současně s prvním systémem se také podílí na regulaci vývoje chloroplastů. Obě dráhy druhých poslů mají v prvních fázích vývoje klíčních rostlin vztah vzájemné inhibice. Je důležité, aby se nahromadil dostatek fotoprotektivních látek dříve, než bude zahájena intenzivní fotosyntéza. Jakmile však došlo k akumulaci fotoprotektivních látek a fotosyntéza běží, jejich další rychlá syntéza již není třeba. Po kroku aktivace heterotrimerních G-proteinů dochází nejprve k aktivaci cGMP a je krátkodobě inhibována aktivace Ca-kalmodulinového systému, pak se rovnováha přesune směrem k Ca-kalmodulinovému systému a ve třetí fázi jsou obě dráhy aktivovány rovnoměrně.
Cesta mezi aktivací druhých poslů a uvedených cílových genů má ještě své mezistupně. Těmito mezistupni jsou aktivace genů skupiny DET a COP.
Geny pro negativní regulaci fotomorfogeneze
Morfogeneze ve tmě – skotomorfogeneze se u klíčních rostlin liší v několika zásadních skutečnostech od morfogeneze na světle. Ve tmě dochází k silnému prodlužování hypokotylu, děložní lístky předčasně ukončují svůj vývoj, nedochází k vývoji pravých listů a nedochází k přeměně proplastidů na chloroplasty. Na genetické úrovni dochází k represi četných genů a genetických systémů. Tato represe musí být podmíněna aktivitou některých regulačních genů, jejichž produkty se připojují na specifické promotorové sekvence dalších genů a brání jejich aktivaci. Jestliže je skotomorfogeneze podmíněna aktivitou určitých genů, musí existovat mutace, u kterých došlo k inaktivaci těchto genů a které se budou ve tmě fenotypově projevovat fotomorfogenetickým vývojem. Byly skutečně zjištěny mutace takovýchto genů. Jeden z nich byl nazván COP (CONSTITUTIVE PHOTOMORPHOGENETIC). Recesivní mutanty tohoto genu podmiňují normální růst a vývoj děložních lístků ve tmě. Později bylo zjištěno, že mutace s obdobným fenotypovým projevem vznikají u genů na různých lokusech genomu. V takovýchto genů bylo popsáno v různých laboratořích původně 11 (COP1, COP2, COP3, COP4, COP8, COP9, COP10 a COP11), ale o některých z nich bylo zjištěno, že jsou vzájemně alelické. V současné době je známo 8 různých lokusů. Například gen COP1 je lokalizován na 2. chromozómu, v poloze asi 27 cM. Jsou popsány jeho různé mutované alely, jako cop1-1, cop1-2, cop1-3 a cop1-4.
Poněkud jiný fenotypový vliv mají mutace lokusů DET1, DET2 a DET3 (DE/ETHIOLATED). U těchto mutantů dochází ve tmě nejen k normálnímu vývoji kotyledonů, ale také k vývoji chloroplastů a pletiv listového mesofylu. Na světle jsou však tyto rostliny světle zelené a mají sníženou apikální dominanci. Zvláště byl studován lokus DET1 a zdá se, že právě ten řídí syntézu hlavního regulačního proteinu, který podmiňuje negativní regulaci fotomorfogeneze. Tento protein je lokalizován v jádře, ale neváže se přímo na DNA. Jeho potlačující funkce na transkripci genů aktivovaných světlem však může být obecnější povahy a může spočívat například ve vlivu na nukleozomovou strukturu chromatinu.
Na negativní regulaci fotomorfogeneze se podílejí také geny skupiny FSC – FUSCA (fuscus znamená purpurově červený), jejichž recesivní mutace podmiňují červené, anthokyanové zbarvení embryí a klíčních rostlin, které brzy ustávají ve vývoji. Podrobnou genetickou analýzou bylo zjištěno, že některé z dříve popsaných lokusů COP a DET jsou identické s lokusy FSC. V současné době se proto hovoří o regulačním komplexu COP/DET/FUS. Protein COP9 v buňkách existuje jako velký komplex monomerů, jehož tvorba a stabilita vyžadují spoluúčast proteinů COP8 a COP11. Protein COP1 má vysoký stupeň homologie s faktorem TAFII80 drozofily, který je součástí komplexu TFIID, a ten podmiňuje iniciaci transkripce u drozofily. COP1 je jaderný protein, který zřejmě podmiňuje represi transkripce genů aktivovaných světlem. Gen COP1 je aktivní ve tmě, zatímco na světle je jeho aktivita potlačena.
Na aktivaci těchto genů se kromě fytochromů podílejí ještě receptory modrého světla. Jejich existence je nepochybná z hlediska biologických účinků, ale zatím nebyly izolovány. Sekundární poslové mění nějakým způsobem komplex proteinů, který je kódován geny COP8, COP9 a COP11. Tento komplex pak působí aktivaci genů DET1 a COP1 a tyto geny působí jako faktory, které vyvolávají další aktivace genů, které se podílejí na syntéze fotoprotektivních látek a na vývoji chloroplastů. Tento regulační řetězec má v sobě ještě řadu neznámých prvků a teprve v průběhu dalších let bude upřesněn a potvrzen.
Konečným vlivem těchto negativních regulátorů transkripce je potlačení aktivity velké řady genů, podílejících se na fotosyntéze, syntéze fotoprotektivních látek a morfogenetickém vývoji typickém pro rostliny na světle. Promotory takovýchto genů mají jednak specifické sekvenční úseky (boxy) pro pozitivní regulaci světlem a negativní regulaci tmou. Signály negativní regulace tmou jsou zřejmě součástmi popsaného systému regulačních genů a jejich mutací.
Co se týče signálů pozitivní regulace světlem jsou zatím dobře známy specifické promotorové úseky označené LRE (Light Regulatory Elements). Byly popsány u genů genových rodin kódujících například menší podjednotku enzymu fotosyntézy ribulózabisfosfátkarboxylázy (geny rbcS) nebo geny pro proteiny světlosběrného komplexu cab – chlorophyll a/b binding. Tato pozitivní regulace světlem je pravděpodobně zprostředkována dalšími, zatím neidentifikovanými geny tohoto komplexu.
Geny autonomní a vernalizační dráhy regulující přechod z vegetativního do generativního růstu
Bylo identifikováno více než 80 lokusů tzv. autonomní dráhy, které řídí dobu do kvetení. Příkladem jsou geny FLC a FRI determinující pozdní kvetení. Ke genům pro rané kvetení patří gen FCA. Další geny regulující přechod z vegetativního do generativního růstu lze rozdělit do tří skupin: geny kódující biosyntézu giberelinů, geny fytochromů a geny kódující vernalizační reakci. Kyselina giberelová udržuje homeostazi ve vývoji květů v různých podmínkách vnějšího prostředí. Gen FLC může blokovat účinek kyseliny giberelové v apexu buď regulací exprese genů biosyntézy kyseliny giberelové, nebo ovlivněním genů přenosu signálu. Fytochromy kontrolují kvetení prostřednictvím délky dne.
U A. thaliana je přechod z vegetativní do generativní fáze charakterizován ukončením tvorby listů v listové růžici a rychlou tvorbou květních primordií. Standardní genotypy mají v podmínkách dlouhého dne růžici s 9 listy a vykvétají za 23 dní. Mutantní rostliny s pozdním kvetením (fca) vykvetou za 47 dní a listová růžice má 29 listů. U některých genotypů je možné kvetení iniciovat vernalizací, tzn. vystavením semen (po vysetí) nízkým teplotám 4ºC po dobu 8 týdnů. Mutantní rostliny fca po vernalizaci vykvetou za 16 dní a mají 8 listů v růžici. Tento pokus dokazuje, že exprese genu FCA je ovlivňována vernalizací. Produkty genů VRN1 a VRN2 blokují expresi genu pro pozdní kvetení FLC.
Geny podmiňující tvorbu meristémů květenství
U homozygotních mutantů tfl1 (terminal flower1) se meristém květenství přeměňuje v květní meristém a květy se tvoří předčasně. Gen TFL1 kóduje zachování meristému květenství.
Gen LEAFY (LFY) plní důležitou funkci při zakládání květních meristémů a při regulaci exprese genů kvetení. Mutace lfy determinuje zpoždění ve tvorbě květních meristémů a homozygotní mutanti často vytvářejí místo květů listy. Produktem tohoto genu je transkripční faktor.
U homozygotních mutantů pin (pin formed) se netvoří květní pupeny nebo se tvoří deformované květy.
Geny regulující tvorbu a identitu květních orgánů
Homeotické mutace způsobují přeměnu jednoho květního orgánu v jiný a tento odlišný fenotyp je kódován geny kontrolujícími funkci květních orgánů. Většina genů této skupiny byla identifikována prostřednictvím homeotických mutací.
Gen APETALA1 (AP1) má dvojí funkci: kóduje přeměnu meristému květenství v květní meristém a tvorbu primordií kališních lístků. K dalším homeotickým genům patří geny AP3 (APETALA3), AG (AGAMOUS), PI (PISTILLATA) a SUP (SUPERMAN) (tab. 3.1). Na obr. 3.2 je znázorněná časová a prostorová regulace exprese genů této skupiny.
Geny regulující růst květních orgánů a jejich zrání
Geny poslední fáze vývoje květů zajišťují tvorbu samčího a samičího gametofytu, tvorbu gamet a přípravu na oplozeni. Některé geny této skupiny (AT, APT, SIN1) jsou uvedeny v tab. 3.1.
Geny regulující tvorbu květu u Arabidopsis
A. thaliana a Antirrhinum majus mají řadu genů homologních. Některé geny byly již klonovány a na základě vydedukované sekvence aminokyselin a proteinů, které jsou těmito geny kódovány, byla u některých určena i jejich předpokládaná funkce. Sledováním mutantního fenotypu, jak u jednoduchých, tak u vícenásobných mutantů, byly získány informace o interakcích těchto genů. Všechny tyto studie vedou k pochopení genetické kontroly tvorby a vývoje květu u dvouděložných rostlin. V tab. 3.1 jsou uvedeny některé mutace A. thaliana ovlivňující tvorbu květu.
| Gen A. thaliana | Mutantní fenotyp | Předpokládaná funkce na molekulární úrovni |
| Geny regulující přechod z vegetativního do generativního růstu | ||
| FLOWERING TIME (FCA) | Pozdní kvetení | Neurčeno |
| GIBERRELLIN1 (GA1) | Pozdní kvetení | Poruchy v biosyntéze giberelinu |
| PHYTOCHROMEA (PHYA) | Dlouhý hypokotyl | Apoprotein fytochromu A |
| LONG HYPOCOTYL3 (HY3, PHYB) | Rané kvetení, dlouhý hypo-kotyl | Apoprotein fytochromu B |
| LONG HYPOCOTYL2 (HY2) | Rané kvetení, dlouhý hypo-kotyl | Biosyntéza fytochromu chromo-foru |
| Geny podmiňující tvorbu meristémů květenství | ||
| TERMINAL FLOWER (TFL) | Přeměna meristému květen-ství v květní meristém | Negativní regulace lfy, ap1, ap2 |
| LEAFY (LFY) | Částečná přeměna meristé-mu květenství v květní meristém | Transkripční faktor |
| APETALA1 (AP1) | Tvorba axilárních květů, homeotická přeměna kališ-ních lístků v listy | Transkripční faktor, box MADS |
| APETALA2 (AP2) | Homeotická přeměna kališních lístků v listy a korunních lístků v tyčinky | Negativní regulace ag |
| PIN FORMED (PIN) | Netvoří se květní pupeny nebo deformované květy | Složka transportního systému auxinů |
| Geny regulující tvorbu a identitu květních orgánů | ||
| APETALA3 (AP3) | Homeotická přeměna korunních lístků na kališní lístky a tyčinek v plodolisty | Transkripční faktor, box MADS |
| AGAMOUS (AG) | Homeotická přeměna ty-činek v korunní lístky, plodolistů v kališní lístky, nedeterminovaný květní meristém | Transkripční faktor, box MADS |
| PISTILLATA (PI) | Homeotická přeměna ko-runních lístků v kališní a tyčinek v plodolisty | Transkripční faktor, box MADS |
| SUPERMAN (SUP) | Větší počet tyčinek, malý pestík | Regulace exprese pi a ap3 |
| Geny regulující růst květních orgánů a jejich zrání | ||
| ANTHERLESS (AT) | Tyčinky bez prašníků | Neurčeno |
| ADENINE PHOSPHORIBOSYL-TRANSFERASE (APT) | Tvorba nefunkčního pylu | Adenin fosforibosyl transferáza |
| SHORT INTEGUMENTS (SIN1) | Abortující vajíčka | Neurčeno |
Regulace genové exprese během vývoje květů, ABC model
U Arabidopsis a Antirrhinum bylo doposud získáno mnoho homeotických mutantů. U většiny z nich jsou mutací ovlivněny vždy dva sousední kruhy květních orgánů (obr. 3.3). To vedlo k domněnce, že existují 3 skupiny genů, které kódují květní orgánovou identitu (skupina A, B, C). Funkce genů skupiny A ovlivňuje vnější části květů, tj. kruh tvořící kališní a korunní lístky. Geny skupiny B regulují vytváření střední části květů (kruh tvořící korunní lístky a tyčinky). Geny skupiny C regulují vytváření vnitřní části květu (kruh tvořený tyčinkami a plodolisty). Na základě těchto poznatků byl vytvořen tzv. ABC model, který je znázorněn na obr. 3.3.
Ztráta funkce genů skupiny A má za následek tvorbu plodolistů místo kališních lístků v kruhu 1 a tvorbu tyčinek místo korunních lístků v kruhu 2. To je př. mutace apetala1 a apetala2 u A. thaliana. Ztráta funkce genů skupiny B má za následek náhradu korunních lístků za kališní a náhradu tyčinek za plodolisty. Příkladem jsou mutace apetala3 a pistillata u A. thaliana. Při ztrátě funkce genů skupiny C se tvoří korunní lístky místo tyčinek a lístky kališní místo plodolistů. Př. je mutace agamous A. thaliana.
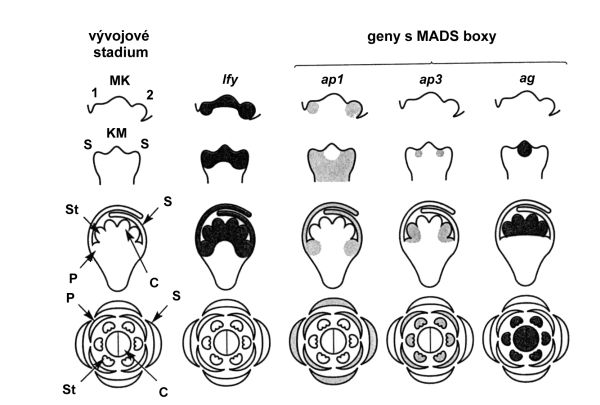
Obr. 3.2 Časová a prostorová regulace tvorby květního meristému a exprese genů orgánové identity u Arabidopsis thaliana (MK – meristém květenství, KM – květní meristém, S – sepala, kališní lístky, P – petala, korunní lístky, St – tyčinky, C – plodolist, lfy – leafy, ap1 – apetala1, ap3 – apetala3, ag – agamous).
(Zdroj: Hughes, 1996)

Obr. 3.3 ABC model stavby květu objasňující expresi homeotických genů tří skupin.
Genetická analýza dvojnásobných mutantů potvrdila, že exprese genů skupiny B je nezávislá na genech A a C. To neplatí pro geny skupin A a C. Fenotypy mutantů bez funkčních genů C mají zvýšenou funkci genů A a naopak. Geny skupiny A a C fungují antagonisticky.
Další revizí modelu ABC je zahrnutí negativního regulátoru SUP funkce genů B (PI a AP3). SUP je zahrnut do negativní regulace genů skupiny B, epigenetické regulace a reguluje komunikaci mezi kruhy (spojení mezi kruhy 3 a 4).
Sekvenční podobnost květních proteinů s transkripčními faktory živočichů a hub umožňuje učinit určité závěry o jejich funkcích. MCM1 kvasinek a savčí SRF interagují s podobnými vazebnými oblastmi určitých promotorů. Rostlinné faktory MADS boxů (MCM1, AGAMOUS, DEFICIENS, SRF) se také váží s těmito sekvencemi.
On-line prezentace
Ke kapitole Reprodukční vývoj rostlin.
ÚEB Biol, Přírodovědecká fakulta, Masarykova univerzita |
Návrat na úvodní stránku webu, přístupnost |
| Servisní středisko pro e-learning na MU
| Fakulta informatiky Masarykovy univerzity, 2013
Centrum interaktivních a multimediálních studijních opor pro inovaci výuky a efektivní učení | CZ.1.07/2.2.00/28.0041

