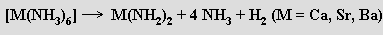
Vápník, stroncium, baryum a radium se označují skupinovým názvem kovy alkalických zemin (název souvisí s příbuzností vlastností jejich oxidů a hydroxidů s analogickými sloučeninami alkalických kovů). Sloučeniny vápníku jsou používány už od starověku (vápno, sádra), minerály stroncia a barya byly prostudovány koncem 18. století. Kovy připravil elektrolyticky H. Davy (1808). Radium izolovali manželé Curieovi (1898) zpracováním tunového množství smolince (z 10 tun této uranové rudy lze získat 1 mg radia; jeho pojmenování vzniklo z latinského rádius = paprsek).
V přírodě se kovy alkalických zemin vyskytují jen ve sloučeninách. Pátým nejrozšířenějším prvkem je vápník (4,66 %), stroncium a baryum jsou zastoupeny méně (0,39 %), radium nepatrně (10-6 ppm). Vápník je častou součástí křemičitanových a fosforečnanových (apatity) minerálů. Čistý makrokrystalický uhličitan vápenatý CaCO3 je islandský vápenec, jeho znečištěnými formami jsou mramor, křída a travertin. Síran vápenatý tvoří minerály sádrovec CaSO4.2H2O a anhydrit CaSO4, fluorid vápenatý CaF2 je znám jako kazivec. Stroncium a baryum se nacházejí v podobě síranů (celestin SrSO4 a baryt BaSO4) a uhličitanů (stroncianit SrCO3 a witherit BaCO3). Všechny izotopy radia, které se vyskytuje v uranových rudách, jsou radioaktivní. Vápník je důležitým biogenním prvkem.
Stříbrobílé kovy alkalických zemin mají tvrdost srovnatelnou s olovem a body tání menší než 1000 °C. Vápník krystaluje do 450 °C v kubické plošně centrované struktuře, při vyšších teplotách přechází na hexagonální modifikaci. Stroncium má plošně centrovanou, baryum tělesně centrovanou kubickou mřížku. Všechny jsou neušlechtilé kovy s poměrně velkými zápornými hodnotami standardních redoxních potenciálů. Charakteristické barvení plamene jejich těkavými sloučeninami (vápník cihlově červeně, stroncium karmínově červeně, baryum zeleně a radium karmínově červeně) se využívá k jejich kvalitativnímu důkazu i kvantitativnímu stanovení.
Podobně jako beryllium a hořčík preferují i kovy alkalických zemin oxidační stupeň +II. Nízké hodnoty elektronegativity a první i druhé ionizační energie způsobují, že se v jejich sloučeninách setkáváme převážně s iontovou vazbou (což je významný rozdíl proti sloučeninám beryllia a hořčíku). Atomové i iontové poloměry jsou poměrně velké, kovalentní interakce je vzácným jevem. Schopnost tvořit komplexy je u kovů alkalických zemin velmi malá, koordinují je téměř výlučně ligandy s donorovými atomy kyslíku.
Kovy alkalických zemin jsou méně reaktivní než alkalické kovy. Na vzduchu se pokrývají vrstvičkou oxidu s příměsí peroxidu a nitridu, s vodou reagují pomaleji než alkalické kovy. Vápenaté soli tvoří mnohem méně hydrátů než odpovídající soli hořečnaté a u strontnatých a barnatých solí je tvorba hydrátů ještě řidší. Rozpustné soli stroncia a především barya jsou jedovaté. Těžší kovy alkalických zemin mají tendenci tvořit vedle oxidů i stabilní peroxidy. Rozpustnost řady solí (fluoridy, uhličitany, sírany) je podstatně menší než rozpustnost analogických sloučenin alkalických kovů. Chování vůči kapalnému amoniaku je u obou skupin prvků podobné. Odpařením modročerných roztoků lze získat amminkomplexy [M(NH3)6], které se stáním rozkládají na amidy
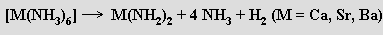
Soli oxokyselin s kationty kovů alkalických zemin jsou, podobně jako soli alkalických kovů, bezbarvé, nezpůsobuje-li zbarvení aniont. Mnohem větší počet solí než u alkalických kovů je ve vodě málo nebo nepatrně rozpustných (uhličitany MIICO3). Na rozdíl od beryllia a hořčíku nejsou známy hydroxidouhličitany kovů alkalických zemin. Reakcí uhličitanů s roztokem oxidu uhličitého vznikají rozpustné hydrogenuhličitany schopné existence pouze v roztoku obsahujícím nadbytek oxidu uhličitého.
Vápník, stroncium a baryum jsou vyráběny v mnohem menších množstvích než hořčík. K přípravě vápníku se nejčastěji využívá elektrolýzy roztaveného chloridu vápenatého (je možné použít i jeho redukce sodíkem). Používá se do speciálních slitin a jako redukční činidlo při přípravě jiných kovů (chrom, zirkonium, thorium, uran). Použití vápenatých sloučenin je velmi široké a různorodé (sklářství, ve stavebnictví vápno, sádra, cihly a cementy, v keramickém průmyslu porcelán a kamenina). Baryum a stroncium se připravují redukcí oxidů hliníkem nebo elektrolýzou tavenin chloridů. Oba kovy nemají významnější praktické využití. Strontnaté soli jsou používány v pyrotechnice, síran barnatý se uplatňuje jako kontrastní látka v medicíně a k záchytu rentgenových paprsků.