2.3.1 Typy chemických vzorců
Podle potřeby použití lze chemické vzorce zapisovat různými způsoby, které se liší mírou informací o struktuře uvažované látky.Stechiometrický vzorec (empirický) vyjadřuje stechiometrické složení dané sloučeniny, tj. určuje, které atomy a v jakém poměru jsou ve sloučenině obsaženy. Počet sloučených atomů se vyznačuje číselným indexem vpravo dole za značkou prvku. Číslice 1 se zpravidla neuvádí. Vzorec se obvykle uzavírá do složených závorek.
Příklady:
| {CH2} | Zápis znamená, že v molekule dané sloučeniny je vázán uhlík s vodíkem v poměru počtu atomů 1:2, tedy např. C2H4 nebo C3H6 nebo C20H40 atd. Uvedený zápis tedy odpovídá jakémukoliv cykloalkanu nebo alkenu. Skutečnost, že nemůže jít o molekulu s molekulovým vzorcem (viz dále) CH2, však z tohoto zápisu neplyne. |
| {P2O5} | Zápis znamená, že v molekule dané sloučeniny je vázán fosfor s kyslíkem v poměru počtu atomů 2:5, tedy např. P2O5 nebo P4O10. |
Molekulový vzorec (souhrnný) vyjadřuje nejen stechiometrické složení sloučeniny, ale i její relativní molekulovou hmotnost, tedy přesné počty vázaných atomů. Umožňuje odlišit polymerní formy sloučenin. V mnoha případech je shodný se vzorcem stechiometrickým.
Příklady:
| molekulový vzorec | chemický název | stechiometrický (empirický) vzorec |
| NO2 | (monomerní) oxid dusičitý | {NO2} |
| N2O4 | dimerní oxid dusičitý | {NO2} |
| P2O5 | monomerní oxid fosforečný | {P2O5} |
| P4O10 | dimerní oxid fosforečný | {P2O5} |
| H2O | voda | {H2O} |
| NaCl | chlorid sodný | {NaCl} |
Racionální (funkční) vzorec umožňuje zdůraznit přítomnost charakteristických atomových skupin, tzv. funkčních skupin v dané sloučenině. Představuje zjednodušenou formu strukturního vzorce. Při jejich používání je třeba dodržovat určitá pravidla:
Funkční skupiny je možno pro větší přehlednost:
- uzavírat do kulatých závorek, např.: Ca(OH)2, CH3(CH2)3OH (NH2)2
- oddělovat vazebnou čárkou, např.: HO–Ca–OH, CH3–CH2–CH2–CH2–OH, H2N–NH2
- oddělovat tečkou, např.: HO·Ca·OH, CH3·CH2·CH2·CH2·OH, H2N·NH2
Je-li funkční skupina, molekula nebo ion komplexní, uvádí se v hranatých závorkách, např.:
- K2[PtCl6], K3[Fe(CN)6]
Vzorec solvatující molekuly v krystalosolvátu se od vzorce základní sloučeniny odděluje tečkou, která se čte „plus“ nebo „krystaluje s“. Počet molekul se vyjádří arabskou číslicí před vzorcem (obvykle se od něj neodděluje mezerou). Analogicky se píší i vzorce adičních sloučenin a klathrátů (viz dále). Např.:
CuSO4 · 5 H2O 8 Kr · 46 H2O NaBO2 · H2O2 NH3 · C6H6 · Ni(CN)2
Strukturní (konstituční) vzorec zobrazuje, které atomy jsou navzájem spojeny, zpravidla však neudává prostorové uspořádání molekuly a nemusí uvádět ani násobnost vazeb.
Příklady:
| Typ vzorce (Název) | stechiometrický | molekulový | funkční | strukturní |
cyklobutan |
{CH2} |
C4H8 |
(CH2)4 |
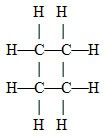 |
2-buten (but-2-en) |
{CH2} |
C4H8 |
CH3CHCHCH3 |
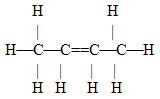 |
peroxid vodíku |
{HO} |
H2O2 |
HO–OH |
|
kyselina sírová |
{H2SO4} |
H2SO4 |
H2SO4 |
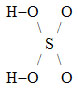 |
Jeho často užívanou formou je elektronový strukturní vzorec, který graficky vyjadřuje uspořádání valenčních elektronů (vazebných i nevazebných) v atomu, iontu nebo molekule. Parciální náboje na atomech spojených kovalentní vazbou se vyznačují znaménky:
![]()
![]()
![]()
![]()
Kovalentní vazbu symbolizují čárky — (jednoduchá vazba), = (dvojná vazba), ≡ (trojná vazba) mezi sloučenými atomy.
Příklady:
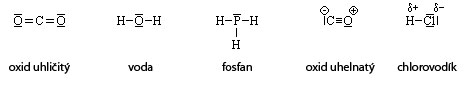
Geometrický (konfigurační) vzorec znázorňuje prostorové uspořádání atomů, iontů nebo molekul.
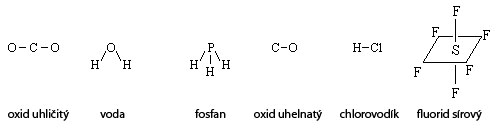
Krystalochemický (koordinační) vzorec vyjadřuje koordinační čísla, tj. počet atomů, iontů nebo molekul, které bezprostředně obklopují určitý atom v krystalové struktuře. Koordinační čísla se zapisují ve tvaru zlomku (jejich podělením dostáváme odpovídající koeficient ve stechiometrickém vzorci). Čitatel udává koordinační číslo prvního atomu (nebo iontu či molekuly), jmenovatel udává koordinační číslo druhého atomu (nebo iontu či molekuly). Význam koeficientů si vysvětlíme na příkladech:
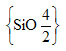 |
4/2 = 2, stechiometrický vzorec dané sloučeniny je tedy {SiO2}. Koordinační číslo Si je 4, atom Si je tedy obklopován čtyřmi atomy O. Koordinační číslo O je 2, atom O je tedy obklopován dvěma atomy Si. |
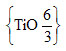 |
6/3 = 2, stechiometrický vzorec dané sloučeniny je tedy {TiO2}. Koordinační číslo Ti je 6, atom Ti je tedy obklopován šesti atomy O. Koordinační číslo O je 3, atom O je tedy obklopován třemi atomy Ti. |
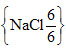 |
6/6 = 1, stechiometrický vzorec dané sloučeniny je tedy {NaCl}. Koordinační číslo Na je 6, atom Na je tedy obklopován šesti atomy Cl. Koordinační číslo Cl je 6, atom Cl je tedy obklopován šesti atomy Na. |
PdF, Pedagogická fakulta, Masarykova univerzita
Návrat na úvodní stránku webu, nahoru
Technická spolupráce:
Servisní středisko pro e-learning na MU
Fakulta informatiky Masarykovy univerzity, 2009
