Oxidace a redukce
Oxidačně redukční reakce (redoxní reakce) jsou reakce, při kterých dochází k přenosu elektronů mezi reagujícími látkami. Jsou doprovázeny změnou oxidačního čísla reagujících částic. Kdykoliv se nějaká částice (atom, molekula, ion) oxiduje, odevzdává elektrony a zvyšuje své oxidační číslo. Naopak při redukci částice elektrony přijímá a její oxidační číslo se snižuje.
Jednoduchým příkladem oxidoredukčního děje může být reakce mezi zinkem a měďnatými ionty, která probíhá při ponoření zinku do roztoku síranu měďnatého:
Zn (s) + Cu2+ (aq) → Cu (s) + Zn2+ (aq)
V této reakci Zn (redukovaná forma, oxidační číslo 0) elektrony poskytuje, je redukčním činidlem a při reakci se oxiduje. Cu2+ (oxidovaná forma mědi, oxidační číslo +2) elektrony přijímá a redukuje se. Dvojice látek, které se liší oxidačním číslem stejného prvku, v našem případě Cu2+/Cu nebo Zn2+/Zn, se nazývá redoxní pár. Uvedenou redoxní reakci můžeme rozdělit na dva dílčí děje, poloreakce:
oxidace: Zn → Zn2+ + 2 e-
redukce: Cu2+ + 2 e- → Cu
Oxidace a redukce tedy probíhá vždy současně, zatímco jedna látka elektrony odevzdává, druhá je přijímá.
Změna oxidačního čísla není při oxidoredukčních reakcích často tak zjevná jak v předchozím příkladu, zejména u organických sloučenin. U organických sloučenin poznáme oxidaci podle toho, že probíhá nejčastěji formou dehydrogenace (odstranění dvou atomů vodíku ze sloučeniny) nebo formou oxygenace (navázání kyslíku). Obdobně redukce sloučeniny je spojena s její hydrogenací nebo deoxygenací.
Typickou oxidoredukční reakcí je spalování methanu nebo uhlíku:
CH4 + 2 O2 → CO2 + 2 H2O
C + O2 → CO2
Uhlík se v těchto reakcích oxiduje a kyslík redukuje.
K velmi běžným oxidacím v organické chemii a při biochemických pochodech patří např. přeměna alkoholové skupiny na aldehydovou (dehydrogenace), nebo přeměna aldehydové skupiny na karboxylovou (oxygenace). Příkladem dehydrogenace (oxidace) probíhajícím v našem organismu je např. vratná dehydrogenace kyseliny mléčné (laktátu) na kyselinu pyrohroznovou (pyruvát). Jako oxidační činidlo slouží kofaktor NAD+, který se při reakci redukuje na NADH.
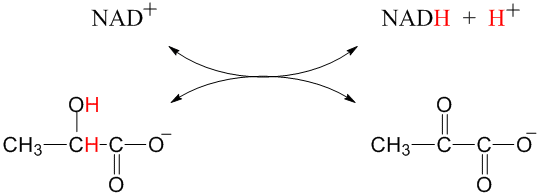
laktát (redukovaná forma) pyruvát (oxidovaná forma)
Biochemicky významné redoxní systémy
V průběhu metabolismu se vyskytuje řada reakcí, které mají má charakter oxidoredukčního děje. Jsou katalyzovány enzymy, které se nazývají oxidoreduktasy.
Principem odbourávání základních živin (lipidy, sacharidy a bílkoviny) je jejich postupná oxidace, která se nejčastěji odehrává formou dehydrogenace. V tomto odbourání lze rozpoznat analogii s pochodem spalování uhlíku nebo methanu (hoření), které, jak ze zkušenosti víme, jsou významným zdrojem energie. Výsledné produkty spalování organických látek a produkty postupné oxidace uhlíkatého skeletu živin v organismech jsou stejné, CO2 a H2O. Rozdíl mezi spalováním a postupnou oxidací živin je však v tom, že užitečná energie (ΔG) uvolněná procesem oxidace při biochemických procesech se uvolňuje postupně a je proto maximálně využita.
Vodíkové atomy nebo elektrony odebírané při oxidaci substrátům jsou navazovány na kofaktory příslušných oxidoreduktas. Typickými kofaktory jsou NAD+ (nikotinamidadenindinukleotid), FAD (flavinadenindinukleotid). Postupnou oxidací je uhlíkatý skelet základních živin za aerobních podmínek převeden na oxid uhličitý a vodu. Vodíkové atomy navázané na kofaktorech (tzv. redukční ekvivalenty) jsou směrovány do dýchacího řetězce lokalizovaného na vnitřní membráně mitochondrií. Při procesu buněčné respirace se zde generuje hlavní podíl buněčné energie a ukládá se ve formě ATP.
Literatura:
Jiří Dostál, Hana Paulová, Jiří Slanina, Eva Táborská: Biochemie pro posluchače bakalářských oborů (Brno, 2009).

Copyright © 2011, Biochemický ústav, Lékařská fakulta, Masarykova univerzita
Správce stránky: jrslanina(zavináč)med(tečka)muni(tečka)cz
Stránky vznikly s podporou FOND ROZVOJE VYSOKÝCH ŠKOL, projekt č. 2482/2011