Gramovo barvení, negativní barvení, nativní preparát
Cíl cvičení
Barvení a pozorování mikroskopických preparátů.
Úvodní slovo
Nativní preparát
Při pozorování suspenze nativního preparátu buňky nikdy nefixujeme. Preparát je nebarvený, slouží ke zjištění skutečného tvaru a struktury buněk neporušených fixací a barvením. Využívá se při pozorování růstu, množení a pohybu bakterií. Význam má při studiu buněčných útvarů, které se obtížně barví, např. spor. Pro pozorování struktur se využívá jasné pole, fázový nebo Nomarského kontrast.
Fixace preparátu
Podstatou fixace je vysrážení buněčných koloidů, zejména bílkovin. Fixací buňky lépe přilnou ke sklíčku, nespláchnou se aplikací barviva či rozpouštědla a lépe přijímají barvivo. Preparát se fixuje až ve chvíli, kdy je nátěr suchý, aby nedošlo k uvaření buněk. Fixace se provádí 3x protažením podložního skla s nátěrem buněk, který je umístěn na horní straně sklíčka, nesvítivou částí plamene. Pokud byly buňky kultivovány v tekutém cukerném prostředí, je nutné buňky od média separovat centrifugací a následně je promýt vodou či pufrem. Buňky kvasinek a vláknitých hub jsou větší než buňky bakterií, tepelná fixace může pozměnit jejich tvar. Proto se většinou fixují chemikáliemi. Fixace i barvení mírně buňky deformují, jejich charakteristický tvar zůstává. Pro měření přesné velikosti buněk se využívá nefixovaný preparát negativně obarvený (obarvení okolí buňky).
Barvené preparáty
Slouží ke zjištění typu buněčné stěny, tvaru buněk a uspořádání jejich shluků, přítomnosti a uložení endospor, přítomnosti pouzder a vnitřních buněčných struktur (inkluzí) a životaschopnosti buněk. Pro určení morfologie buňky a charakteristických shluků stačí jednoduché barvení buněčné stěny (např. krystalovou violetí) bez rozlišování grampozitivního či gramnegativního typu. Vitální barvení je barvením mrtvých buněk, protože mrtvé buňky přijímají barvivo nebo ho efluxními systémy nevylučují. Struktury buňky se rozlišují diferenciačním barvením, a to jak vnitřní a vnější morfologické útvary (endospory, pouzdra, buněčné stěny), tak chemické složky (volutin, glykogen, škrob). Diagnostické barvení napomáhá identifikaci bakterií (např. Gramovo, acidorezistentní barvení karbolfuchsinem, barvení dle Giemsy). Při negativním barvení se buňky nefixují ani nebarví, obarveno je pouze jejich okolí (např. tuší, nigrosinem). Využívá se pro měření přesné velikosti buněk nedeformovaných fixací a barvením.
Preparát se před barvením fixuje vždy kromě barvení negativního a vitálního testu. K barvení se používají zředěné vodné roztoky organických barviv, obvykle soli. Bazická barviva mají barevný kationt, kyselá aniont. Při barvení bakterií se většinou používají bazická barviva (např. krystalová violeť, metylenová modř, safranin, bazický fuchsin, malachitová zeleň). Barvení lze zvýraznit mořením buněk (např. fenolem, taninem), při kterém má mořidlo roli prostředníka s vyšší afinitou k buňce a zároveň k barvivu, než je afinita buňky k samotnému barvivu.
Gramovo barvení
Gramovo barvení je jednou z nejdůležitějších diagnostických metod při identifikaci bakterií. Rozlišuje skupinu grampozitivních (barví se modrofialově) a gramnegativních buněk (barví se červenorůžově) a udává některé fyziologické a chemické vlastnosti buňky. Podstata rozdílného chování při Gramově barvení nebyla dosud uspokojivě objasněna, s největší pravděpodobností se uplatňují rozdíly ve složení buněčné stěny obou skupin bakterií. Jde o barvení fixovaného preparátu krystalovou violetí a následné moření buněk jódem v roztoku KI. Vzniká komplex barvivo-jód-buněčná stěna. Rozdíl při barvení vzniká při promývání preparátu organickým rozpouštědlem (acetonem nebo alkoholem). U gramnegativních buněk odbarvovací činidlo rozpustí vnější lipopolysacharidovou vrstvu, komplex krystalové violeti s jódem se vymyje přes tenkou vrstvu peptidoglykanu a buňky se odbarví, naopak grampozitivní bakterie si zbarvení ponechávají. Pro zvýraznění rozdílu se gramnegativní bakterie dobarvují jiným kontrastním barvivem (např. bazickým safraninem, karbolfuchsinem) a barví se do červena, růžova. Grampozitivní buňky mají v buněčné stěně navázánu krystalovou violeť, která se alkoholem nevyplavila a zůstávají zbarveny do modra, modrofialova. Chyby, které mohou nastat při barvení, jsou: příliš silný nátěr buněk na sklíčku; uvaření buněk při fixaci; příliš dlouhé odbarvování buněk alkoholem.
Gramovo barvení je do jisté míry ovlivněno fyziologickým stavem buněk, stářím kultury a složením kultivačního média. Pro barvení se využívají buňky staré 24 hodin. Buňky mohou ztratit svoji grampozitivitu např. mechanickým poškozením, UV zářením, působením kyselin, zásad či rozpouštědel. Mikroorganizmy, které se někdy barví pozitivně a někdy negativně, označujeme jako gramlabilní/gramvariabilní. Některé bakteriální rody Gramovým barvením nelze obarvit, jsou to rody bez buněčné stěny (mykoplazmata), spirálovité bakterie a silně acidorezistentní rody (mykobakterie); např. Mycobacterium bovis, M. tuberculosis, M. avium, M. intracellulare, M. kansasii, M. leprae, M. marinum, a dále patogenní Borrelia burgdorferi, B. recurrentis, Bartonella henselae, Chlamydia trachomatis, C. pneumoniae, Chlamydophila psittaci, Coxiella burnetii, Ehrlichia chaffeensis, Anaplasma phagocytophilum, Legionella spp., Leptospira spp., Rickettsia rickettsii, Orientia tsutsugamushi, Treponema pallidum.
Buněčná stěna bakterií
Buňky gramnegativního typu (obr. 65B) mají buněčnou stěnu složenou z vnější lipopolysacharidové membrány a vnitřní relativně tenké peptidoglykanové (zhruba 5–10 % buněčné stěny) vrstvy obsahující kyselinu muramovou. Spojení mezi peptidoglykanem a vnější membránou zajišťují lipoproteiny. Lipopolysacharidy jsou složeny z lipidu A, jaderného (též základního, dřeňového) polysacharidu a O-antigenu (též O-řetězec). Vnější membrána slouží jako ochranná bariéra před vnějším prostředím, brání prostupu látek nebo postup alespoň zpomaluje (žlučové soli, antibiotika, jedy, atd.).
V buněčné stěně grampozitivního typu (obr. 65A) chybí vnější membrána a peptidoglykanová vrstva je poměrně tlustá. Někteří zástupci mohou mít jako složku buněčné stěny kyselinu teichoovou, lipoteichoovou anebo neutrální polysacharidy, u několika zástupců jsou ve stěně přítomny mykolové kyseliny.
Zvláštní skupinou jsou bakterie bez buněčné stěny, tzv. mykoplazmata, které nejsou schopny syntetizovat prekurzory peptidoglykanu. Buňky jsou obklopeny pouze cytoplazmatickou membránou.
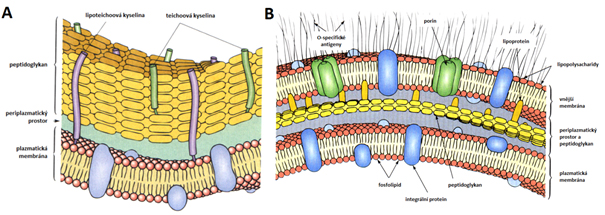
(Prescott a kol., 1996, upraveno).
Negativní barvení
Negativním barvením se obarví okolí buněk, nikoli buňky samotné. Velikost ani tvar buňky není deformovaný fixací a barvivem. Využívá se pro měření přesné velikosti a tvaru bakteriální buňky, pro stanovení pouzder, kapsul a slizu.
Vlastnosti vybraných mikroorganizmů
- Haloarcula
- extrémně pleomorfní tyčky, většinou plochého průměru a tvaru trojúhelníků a čtvercových nebo nepravidelných disků; gramnegativní; extrémně halofilní (2–5,2 M NaCl); bakterioruberiny a žluté pigmenty
- Haloferax
- extrémně pleomorfní, většinou tvar plochých disků nebo pohárků; gramnegativní; kolonie s mukózním vzhledem, extrémně halofilní (1,5–4,5 M NaCl); bakterioruberiny a žluté pigmenty
- Sporosarcina
- kulaté či oválné buňky uspořádané jako diplokoky, tetrády nebo krychlovité balíčky; grampozitivní; pohyblivé několika bičíky; tvorba spor; krémově až oranžově zbarvené kolonie
- Leuconostoc
- sférické či ovoidní buňky uspořádané po dvou či v řetízcích, občas jako krátké tyčky v dlouhých řetízcích; grampozitivní
- Azotobacter
- velké ovoidní a pleomorfní buňky, jednotlivě, po dvou, v nepravidelných shlucích či řetízcích; tvorba cyst; gramnegativní
- Yarrowia lipolytica
- kvasinky, rozmnožování vegetativně pučením; pseudohyfy i pravé hyfy; jednotlivé vejčité nebo kulovité asky vyrůstající laterálně nebo terminálně; barví se jako grampozitivní bakterie
- Saccharomyces cerevisiae
- kvasinky, elipsoidní, kulovité někdy i protáhlé buňky; v některých případech tvoří větvené pseudomycelium; pravé mycelium nevytváří; rozmnožování pučením; haplo‑diplobiotický životní cyklus, spory diploidních kmenů po1-4 v asku; barví se jako grampozitivní bakterie
Seznam přístrojů, materiálu a mikroorganizmů
Pomůcky a chemikálie
- Krystalová violeť, Lugolův roztok, safranin
- Nigrosin, Kongo červeň, metylenová modř, HCl
Mikroorganizmy
- Bacily, G+ tyčky různé tvary (48 hodinová kultura se sporami - fázový kontrast)
- Bacillus thuringiensis CCM 19
- Bacillus sphaericus CCM 1615
- Bacillus mycoides CCM 145
- Bacillus cereus CCM 2010
- Bacillus megaterium CCM 2007
- Bacillus subtilis CCM 2216
- G+ koky, krátké tyčky
- Azotobacter vinelandii CCM 289 - slizovité kolonie, pouzdra
- Leuconostoc mesenteroides CCM 1803 – řetízky, pouzdra, sliz
- Sporosarcina ureae CCM 860
- Staphylococcus aureus
- Micrococcus luteus CCM 169
- G- tyčky
- Serratia marcescens CCM 303
- Escherichia coli CCM 3954
- Pseudomonas putida
- Archaea
- Haloarcula hispanica CCM 3601T
- Haloferax mediterranei CCM 3361T
- Eukaryota
- Saccharomyces cerevisiae
- Yarrowia lipolytica
Postup
Nativní preparát
- Doprostřed podložního sklíčka nanést kapku sterilní destilované vody.
- Ožehnutou, vychladlou očkovací kličkou vnést do kapky malé množství kultury, rozmíchat. Kultury stačí nepatrné množství, aby preparát nebyl hustý.
- Kapka se neroztírá, překrývá se krycím sklíčkem tak, aby v preparátu nebyly vzduchové bublinky (nepřikládat svrchu na kapku, ale nejprve jednou hranou, nepřitlačovat).
- Přebytečnou kapalinu odsát filtračním papírem.
- Buňky z tekutého média pozorovat přímo v médiu bez ředění v kapce vody.
- Pro nativní preparát zvolit objektiv s fázovým kontrastem (Ph).
- Preparát pozorovat do 5 minut z důvodu rychlého vysychání.
Jednoduché bavení
- Zaschlý nátěr buněk na sklíčku fixovat plamenem.
- Ponořit do roztoku krystalové violeti nebo safraninu na 15–20 sekund.
- Opláchnout slabým proudem vody, usušit a pozorovat při zvětšení 1000x.
Gramovo barvení (obr. 66)
- Doprostřed podložního sklíčka nanést kapku sterilní destilované vody.
- Ožehnutou, vychladlou očkovací kličkou vnést do kapky malé množství kultury.
- Suspenzi z kultury rozetřít po sklíčku, nechat dobře zaschnout a fixovat plamenem (několikrát sklíčko protáhnout plamenem).
- Preparát ponořit do roztoku krystalové violeti na 30 sekund, opláchnout vodou.
- Preparát ponořit do Lugolova roztoku na 30 sekund, opláchnout vodou.
- Preparát převrstvit etanolem/acetonem, maximálně na 15–20 sekund, opláchnout vodou.
- Preparát ponořit do safraninu na 1 minutu (takto se dobarví pouze buňky gramnegativní, u kterých došlo k vyplavení krystalové violeti; safraninem však dobarvujeme každý preparát, i když předpokládáme přítomnost grampozitivních buněk – předem nevíme, o jaký typ buněčné stěny se v preparátu jedná).
- Preparát osušit mezi dvěma filtračními papíry a pozorovat při zvětšení 1000x v jasném poli (objektiv BF).
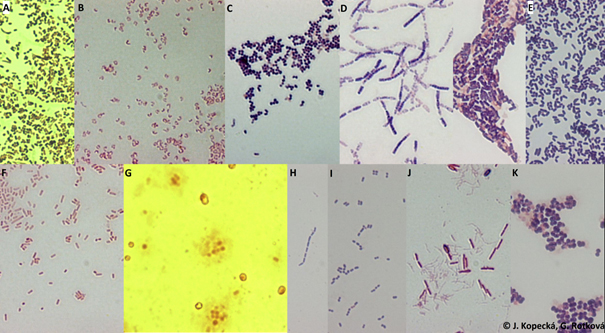
Acinetobacter grimontii (A), Arthrobacter sp. (B), Bacillus mycoides (C), B. subtilis (D), Corynebacterium glutamicum (E), Escherichia coli (F), Haloarcula hispanica (G), Lactobacillus casei (H), Leuconostoc mesenteroides (I), Paenibacillus polymyxa (J), Sporosarcina ureae (H) (archiv autorek)
Negativní barvení nigrosinem
- Asepticky přenést buňky do kapky destilované vody na podložním sklíčku, přidat kapku nigrosinu.
- Kapky smíchat kličkou a rozetřít jemným tahem druhého sklíčka (přiloženého pod úhlem 45˚ po celé ploše podložního skla), nechat zaschnout na vzduchu.
- Pozorovat při zvětšení 1000x s imerzí.
Hodnocení
V preparátu jsou viditelné neobarvené buňky na šedém pozadí (obr. 67). Porovnat mezi preparáty tvar a velikost buněk různých druhů jednoho bakteriálního rodu. Výsledek ovlivňuje tloušťka vrstvy barviva (silný nános může po zaschnutí praskat) a koncentrace barviva.
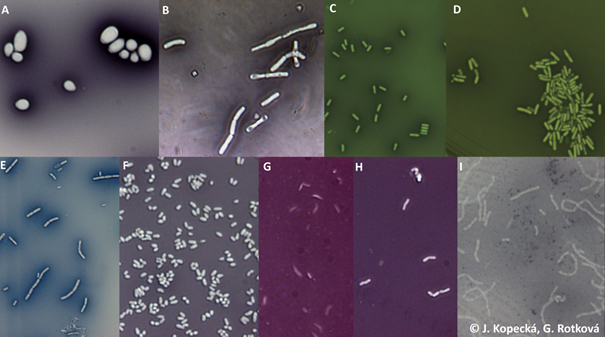
Saccharomyces cerevisiae (A), Bacillus cereus (B), B. subtilis (C), B. subtilis (D), Bacillus sp. (E), Corynebacterium glutamicum (F), Haloferax mediterranei (G), Lactobacillus brevis (H), Lactobacillus casei (I) (archiv autorek)
Negativní barvení Kongo červení
- Asepticky přenést buňky do malé kapky Kongo červeně na podložním sklíčku.
- Rozetřít jemným tahem druhého sklíčka (přiloženého pod úhlem 45˚ po celé ploše podložního skla) a nechat zaschnout na vzduchu.
- Opláchnout 1 % HCl, ihned slít, neoplachovat, případně dosušit filtračním papírem.
- Pozorovat při zvětšení 1000x s imerzí.
Nativní preparát pro pozorování tvaru a umístění spor rodu Bacillus
(fázový a Nomarského kontrast, obr. 68 a 69)
- Do kapky sterilní destilované vody na podložním sklíčku nanést kulturu, rozmíchat a překrýt krycím sklíčkem (nepřikládat svrchu na kapku, ale nejprve jednou hranou, nepřitlačovat).
- Buňky z tekutého média pozorovat přímo v bujónu bez ředění v kapce vody.
- Ihned pozorovat při fázovém kontrastu (objektiv 60x nebo 100x), preparát rychle vysychá.
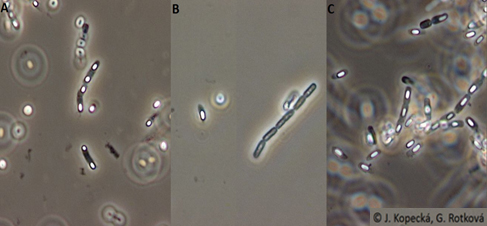
Bacillus megaterium (A), B. mycoides (B), B. pumilus (C) (archiv autorek)
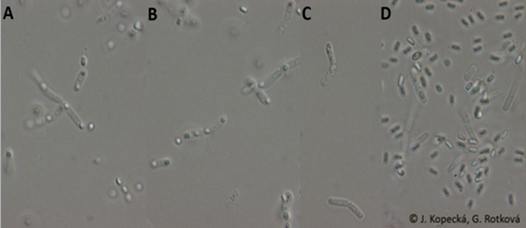
Bacillus megaterium (A), B. megaterium (B), B. mycoides (C), B. pumilus (D) (archiv autorek)
Zhodnocení cvičení
- Všímáme si tvaru buněk, spor, poměru šířky a délky buněk, a zda je patrné vyklenutí buněk způsobené endosporami.
Další informace k této problematice najdete v následující literatuře
- Prescott L., M., Harley J. P., Klein D. A., Microbiology, WCB, Dubuque, 1996, ISBN 0-697-29390-4.
- Sedláček I., Taxonomie prokaryot, Masarykova univerzita, Brno, 2007, ISBN 80-210-4207-9.
Kontrolní otázky
- Vysvětlete pojmy bakteriální druh a bakteriální kultura.
- Jmenujte alespoň 4 barviva používaná v mikrobiologii.
- Doplňte tabulku:
| Cílová struktura | Typ barvení |
|---|---|
| Buněčná stěna | |
| Tvar buňky, endospory, pohyb | |
| Skutečný tvar a velikost, pouzdro, kapsule | |
| Pouzdro | |
| Spora |