Pohyb buněk
Cíl cvičení
- Pozorovat pohyb buněk mikroskopicky a makroskopicky pohyb kultur na misce.
- Sledovat pohyb bičíků ve visuté kapce.
- Obarvit bičíky a pozorovat v jasném poli a při fázovém kontrastu.
- Očkovat polotekuté médium – na misky i do zkumavek.
Úvodní slovo
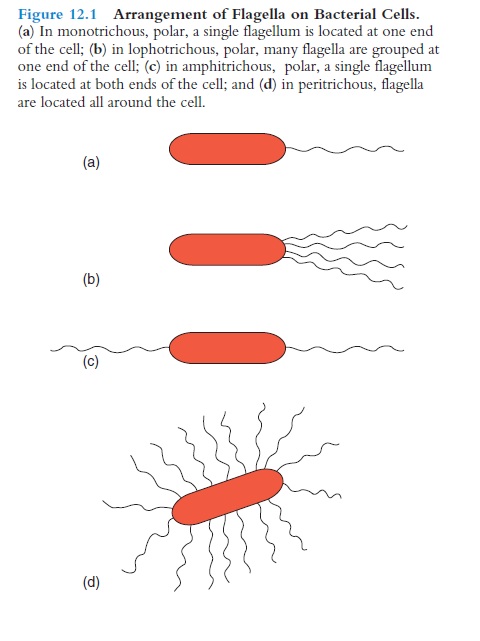
Většina pohyblivých bakterií se pohybuje pomocí bičíku, který je ukotven na vnější části plazmatické membrány a v buněčné stěně. Bičík má v průměru zhruba 20 nm a je 15–20 µm dlouhý. Bičík je mikroskopicky viditelný až po obarvení, které zvětší jeho tloušťku. Umístění bičíku na buňce může být různé (obr. 74).
Bakteriální bičík je složen ze tří základních částí. Nejdelší část tvoří vlákno, bazální tělo je usazeno v buňce a s vláknem je spojeno háčkem. Vlákno je duté a pevné, složené pouze z jediného proteinu, flagelinu. Rozdíly ve stavbě bičíku u gramnegativních a grampozitivních bakterií jsou znázorněny na obr. 75.

Směr rotace bičíku určuje povahu pohybu bakterie (obr. 76). Kromě pohybu pomocí bičíku se bakterie přirozeně pohybují Brownovým pohybem. Spirochety a helikální bakterie se mohou pohybovat slizem díky tzv. axiálnímu filamentu. Dalším typem pohybu bakterií je klouzavý pohyb, např. u cyanobakterií, některých druhů myxobakterií a mykoplazmat. Ačkoli nemají žádné viditelné struktury spjaté s klouzavým pohybem, mohou dosahovat rychlosti až 3 µm za sekundu.

Vlastnosti vybraných mikroorganizmů
- Bacillus
- rovné tyčky po dvojicích nebo v řetízcích se zakulacenými nebo čtvercovými konci; grampozitivní; peritrichální; tvorba endospor
- Pseudomonas
- gramnegativní; rovné či mírně zakřivené tyčky; jeden či několik polárních bičíků
- Proteus
- gramnegativní; rovné tyčky; peritrichální bičíky
- E. coli
- gramnegativní; jednotlivé tyčky či ve dvojicích; peritrichální bičíky
Seznam přístrojů, materiálu a mikroorganizmů
Mikroorganizmy
mladé kultury (4 nebo 16 hodinové)
Bacillus cereus CCM 2010
Pseudomonas fluorescens CCM 2115T
Proteus vulgaris CCM 1799
Escherichia coli CCM 3954
Micrococcus luteus CCM 169 – pro srovnání nativního preparátu, nepohyblivý
Postup
Při pozorování bičíků se nesmí pracovat se skleněnými předměty (krom sklíček), protože snadno ulamují bičíky. Pracovat s mladými kulturami 4-16 hodin starými vždy z tekutého média, staré buňky odhazují bičíky.
Pozorování pohybu bičíku
Visutá kapka
- Připravit nativní preparát, kapku suspenze buněk z média pipetovat na podložní sklo.
- Nepřekrývat krycím sklem, pozorování objektivem 20x při Nomarského kontrastu, nezanořovat!
- Pro vitalitu buněk je důležitý dostatek kyslíku, citlivější buňky se hýbou jen nahoře.
- Nutno opatrně přiostřovat na horní část kapky.
Barvení bičíků (obr. 77)
Barva obsahuje mořidlo tanin, které se obalí kolem bičíku, zvětší jeho průměr a zviditelní ho.
Barvička na barvení bičíků: roztok I (10 dílů) a II (1 díl), uchovávat zamraženou
Roztok I: 10 ml 5% vodného roztoku fenolu, 2 g taninu, 10 ml KAl(SO4)2 * 12 H2O
Roztok II: nasycený roztok krystalové violeti (12 g) v etanolu (10 ml, 96%)
- Připravit nativní preparát na odmaštěné podložní sklo a opatrně překrýt krycím sklem.
- Vedle krycího sklíčka kápnout barvičku pro barvení bičíků.
- Barvičku prosát filtračním papírem a preparát pozorovat při zvětšení 1000x s imerzí.

Pozorování pohybu na agaru pro testování pohybu
Médium obsahuje nízké procentuální množství agaru, polotekuté médium (nižší viskozita prostředí).
Složení média: 100 ml demineralizované vody, 0,1 g kvasničného extraktu, 0,01 g K2HPO3, 0,2 g agaru.
- Na agar se očkuje jen do středu misky, aby se rozrůstala 1 kolonie.
- Kličku s kulturou zanořit ve středu misky do agaru.
- Pohyblivé kultury udělají rozrůstající se kruh, někdy vlnící se. Nepohyblivé rostou jen v místě vpichu do určité velikosti.
- Výsledky za 3-5 dní. S miskou se nesmí hýbat.
U rodu Proteus lze využít jak tuhé (fenomén příbojové vlny, plazivý nárůst), tak polotekuté médium (plavání buněk v médiu).
Složení Luria-Bertani swarming média s 0,7 % agarem: 100 ml destilované vody, 1 g enzymatického hydrolyzátu kaseinu, 0,5 g kvasničného extraktu, 1 g NaCl, 0,7 g agaru.
Zhodnocení cvičení
- Pozorujeme pohyb bakterií ve visuté kapce a pohyb bakterií na miskách ve formě mohutně se rozrůstajících kolonií.
- Pomocí obarvených bičíků pozorujeme rozdíly mezi různými bakteriemi (monotricha, peritricha).
Další informace k této problematice najdete v následující literatuře
- Prescott L., M., Harley J. P., Klein D. A., Microbiology, WCB, Dubuque, 1996, ISBN 0-697-29390-4.
- Sedláček I., Taxonomie prokaryot, Masarykova univerzita, Brno, 2007, ISBN 80-210-4207-9.
Kontrolní otázky
- Co jsou to inkluze?
- Popište typy pohybu: Brownův pohyb, pohyb pomocí bičíků a klouzavý pohyb.
- Popište rozdíly ve složení bičíku u grampozitivních a gramnegativních bakterií.
- Z jakého proteinu je složen bakteriální bičík?
- Čím lze zviditelnit bakteriální bičík pro světelnou mikroskopii?
- Proč se při pozorování bičíků nepoužívají skleněné pomůcky?