Přírodovědecká fakulta Masarykovy univerzity
prof. RNDr. Jiřina Hofmanová, CSc.
Nádorové onemocnění, úvod a základní pojmy
Pacienti trpící nádorovým onemocněním (rakovinou) se cítí jako napadeni nějakou neznámou mimozemskou silou. Ve skutečnosti však toto onemocnění vzniká z naší vlastní tkáně. Existuje řada důkazů, že nádor je obecně odvozen od jedné buňky, která se dramaticky mění po sérii genetických změn.
Zdravá buňka má definovaný tvar a strukturu a prosperuje mezi uspořádanými okolními buňkami. Odpovídá na podněty ze svého okolí a dává vznik dceřinným buňkám jen tehdy, jestliže rovnováha stimulačních a inhibičních signálů z okolí upřednostní buněčné dělení. Avšak v procesu replikace DNA a dělení existuje stálá hrozba vzniku mutací, náhodných změn, které mohou tento regulační cyklus porušovat. Jedna mutace může způsobit, že buňka, která vypadá normálně a je méně citlivá na vnější signály se může příležitostně začít nekontrolovaná dělit. Akumulace genetických změn v důsledku genetické nestability může způsobit, že se dceřinná buňka stane zcela hluchou k externím signálům a vykazuje znaky malignity.
Znamená to, že buňka ztrácí přesný tvar a hranice, nereaguje na růstově inhibiční signály a získává schopnost nekontrolovaně se dělit. Vznikající masa nejen stlačuje a poškozuje zdravou tkáň ve svém sousedství, ale může dále překonávat bariéry jednotlivých orgánů a metastazovat, což znamená, že kolonizuje vzdálené tkáně. Nádor se stává zhoubným (maligním).
Nádory vznikají z naší vlastní tkáně. Avšak je to nová a abnormální tkáň v mnohobuněčném organismu, která v tomto organismu nemá fyziologickou funkci a roste neregulovaným způsobem. Představuje geneticky podmíněný abnormální přírůstek buněčné tkáňové hmoty klonálního charakteru. Růst nádoru není v koordinaci s růstem okolních tkání a rovnovážným stavem organismu.
Studie v průběhu několika desítek posledních let znamenaly velký pokrok v identifikaci nejhlubších základů celého procesu vzniku a rozvoje nádorového onemocnění, tj. těch na buněčné a molekulární úrovni.
Ve skutečnosti pojem „rakovina“ odpovídá více než sto formám této choroby. Téměř všechny tkáně v těle mohou podlehnout tomuto onemocnění. Asi 30 trilionů buněk v normálním zdravém organismu žije ve složitém vzájemně propojeném svazku a reguluje navzájem své chování včetně proliferace (dělení). Tato spolupráce buněk zajišťuje, že každá tkáň těla udržuje svou odpovídající velikost a architekturu.
Nádorové buňky naopak ničí toto schéma, stávají se hluchými k obvyklé kontrole proliferace a vytvářejí si svůj vlastní vnitřní program reprodukce. Kromě toho mají ještě nebezpečnější vlastnost – schopnost migrovat a tvořit masu ve vzdálených částech těla. Nádory z takovýchto buněk se stávají čím dál agresivnější a jsou letální, jestliže rozrušují tkáně a orgány důležité pro přežití organismu jako celku.
Ukázalo se, že nádor vzniká ze společné buňky, ve které byl – většinou desítky let před vznikem viditelného nádoru – zahájen program neregulovaného dělení. Maligní transformace (přeměna) buňky probíhá přes akumulaci mutací ve specifických třídách genů. Právě tyto geny mohou poskytnout klíč k porozumění procesů v kořenech lidské rakoviny.
Existují dvě třídy genů, které dohromady tvoří jen malou část celé genetické výbavy, ale hrají hlavní úlohu v zahájení procesu tvorby nádoru. Ve své normální konfiguraci řídí životní cyklus buňky, tj. sled dějů, při kterých se buňka zvětšuje a dělí.
Protoonkogeny podporují tento růst, kdežto nádorově supresorové geny jej inhibují. Jestliže mutují nebo jsou aktivovány, stávají se protoonkogeny karcinogenními onkogeny, které vedou k nadměrné proliferaci. Mutace způsobuje, že protoonkogen většinou poskytuje příliš mnoho růst stimulujícího proteinu nebo jeho nadměrně aktivní formu. Naopak nádorově supresorové geny přispívají k rakovině, jestliže jsou mutací inaktivovány.
Pro vývoj nádoru se musí mutace vyskytnout ve více růst kontrolujících genech. Změněné formy jiných tříd genů se pak mohou také účastnit na vzniku malignity tím, že umožní proliferující buňce být invazívní a dostat se do jiných částí těla.
V normální buňce je rovnováha stimulačních a inhibičních signálů pečlivě regulována, protože to souvisí s regulací buněčného cyklu, který je rozhodující pro buněčnou proliferaci a diferenciaci. V nádorové buňce je v důsledku změn v signálních drahách organisace buněčného cyklu narušena.
Buňka je vybavena také zpětnovazebními mechanizmy, které mohou působit proti neobvyklým změnám v procesu buněčného dělení. Patří k nim např. apoptóza, schopnost buňky spáchat za určitých podmínek „sebevraždu“, tj. jestliže její základní komponenty jsou porušeny nebo jestliže je její kontrolní systém deregulován. Tak působí např. poškození chromozomální DNA. V tomto procesu se účastní také specifické geny např. p53 nebo bcl-2. Mutace těchto genů pak způsobují poruchy apoptózy. Bylo zjištěno, že neschopnost apoptózy přispívá ke vzniku nádorů a k jejich rezistenci k terapii.
Druhým obranným mechanizmem proti neustálé proliferaci je vestavěný buněčný mechanizmus, který sčítá a limituje celkový počet dělení buňky, buňka stárne a hyne. Molekulárním nástrojem tohoto sčítaní jsou segmenty DNA na koncích chromozómů tzv. telomery. Ty se při každém dělení zkracují a když dosáhnou kritické délky dochází k stárnutí a krizi. Jestliže tento sčítací systém funguje v nádorové buňce řádně, její nadměrná proliferace je přerušena předtím, než je nádor příliš velký. Aktivací genu, který kóduje enzym telomerázu, který není u většiny normálních buněk aktivní, ale funguje v nádorových buňkách, však dochází k obnově telomerických segmentů a to umožňuje buňce se nekonečně množit, tj. stát se nesmrtelnou (imortalizovanou).
Většinou trvá desítky let než se v prekarcinogenní populaci nasbírá dostatek mutací k malignímu růstu. U některých jedinců je však tato doba silně zkrácena. To je vysvětlováno dědičností některých genů způsobujících rakovinu. Jestliže rodičovská zárodečná buňka obsahuje mutaci, tak u potomka je tato mutace přítomna ve všech buňkách těla a pravděpodobnost vzniku nádoru je vysoká.
Historie
Historie nádorového onemocnění začala popisnými (epidemiologickými) poznatky a spadá do konce 18 stol. V r. 1775 byla popsána rakovina šourku u kominíků a souvislost onemocnění s výskytem škodlivin v sazích. V r. 1848 byl pozorován zvýšený výskyt rakoviny prsu u jeptišek a vysloven pravděpodobný předpoklad souvislosti s bezdětností a nekojením. V r. 1902 byla objevena škodlivost působení RTG paprsků a vzniku rakoviny. Počátkem. 20. stol. byl popsán rovněž rodinný výskyt nádorů. Pro poznání příčin nádorového onemocnění měl velký význam v r. 1910 objev viru Rousova sarkomu, kterým lze infikovat a přenášet nádor u kuřat.
Postupně se rozvíjela odvětví, která zásadním způsobem přispěla k poznání mechanizmů vzniku a rozvoje nádorového onemocnění. Díky studiu nádorových virů a metodám přenosu DNA (transformace, transfekce) byly poznány protoonkogeny, onkogeny i nádorově supresorové geny. Biochemie umožnila studium onkoproteinů, jejich lokalizace a interakce. Buněčná biologie, molekulární biologie a genetika přispěla ke studiu molekulárních mechanizmů řídících růst buněk, buněčné dělení, k izolaci, charakterizaci, cílené expresi a funkčním testům eukaryotických genů.
Pojem „rakovina“ odpovídá více než sto formám této choroby. Téměř všechny tkáně v těle mohou podlehnout malignitě. Asi 30 trilionů buněk v normálním zdravém organismu žije ve složitém vzájemně propojeném svazku, regulujíc vzájemně svou proliferaci. Tato spolupráce buněk zajišťuje, že každá tkáň těla udržuje svou velikost a architekturu. Nádorové buňky naopak ničí toto schéma, stávají se hluchými k obvyklé kontrole proliferace a vytvářejí si svůj vlastní vnitřní program reprodukce. Kromě toho mají ještě nebezpečnější vlastnost – schopnost migrovat a tvořit masu ve vzdálených částech těla. Nádory z takovýchto buněk jsou čím dál agresivnější a stávají se letální, jestliže rozrušují tkáně a orgány důležité pro přežití organismu jako celku.
Názvosloví
Název rakovina je ekvivalentem anglického „cancer“ a německého „der Krebs“ a v užším smyslu je názvem pouze pro karcinomy (nádory epiteliálního původu). Název je odvozen od řeckého slova karkinos – rak nebo onkos – krab. Věda o nádorech se pak nazývá onkologie a onkologická onemocnění jsou ekvivalentem nádorových onemocnění. Pro proces vzniku a rozvoje nádorového onemocnění se užívá označení karcinogeneze, kancerogeneze, onkogeneze nebo tumorigeneze.
Mutace
dědičná genetická změna v buňce (vzniká bodovou mutací, delecí nebo inzercí jednoho či více nukleotidů, amplifikací segmentů DNA, inverzí, translokací nebo získáním či ztrátou chromozómu). Základem je změna genetického materiálu v buňce, nikoli změna v jeho expresi.Epigenetická změna
je změna v genové expresi beze změny v sekvenci DNA nebo genetického obsahu buňky (zejména změny metylace DNA a acetylace histonů).Iniciovaná buňka
je mutovaná buňka se schopností stát se nádorovou nebo maligní.Benigní nádor
je lokální rozrůstání iniciované buňky.Maligní (zhoubný) nádor
je nádor se schopností vrůstat do tkání a rozšiřovat se do vzdálených míst.Termín Neoplasie (nový růst)
se používá pro celý rozsah benigního i maligního chování buněk.
Kritéria dělení nádorů
podle míry nebezpečí je dělíme na
Benigní nádory
připomínají zralou tkáň, ale buňky se neúměrně namnoží. Jsou ostře ohraničeny od okolní tkáně.Maligní nádory
U maligních nádorů se buňky vracejí do embryonálního stádia, vykazují různé stupně zralosti, infiltrují do okolních tkání a krevní nebo lymfatickou cestou se dostávají do vzdálených míst, kde tvoří sekundární nádory – metastázy.
podle tkáně, kde vznikají (tab. 1)
- karcinomy,
- sarkomy,
- leukémie,
- lymfomy,
- blastomy.
Tab.1 Základní klasifikace nádorů
| Výchozí tkáň | Zralé benigní buňky (nezhoubné) | Nezralé maligní buňky (zhoubné) | |
| epitel | povrchový | papilom | karcinom |
| žlázový | adenom | adenokarcinom | |
| Pojivo | kolagenní | fibrom | fibrosarkom |
| tukové | lipom | liposarkom | |
| chrupavka | chondrom | chondrosarkom | |
| kost | osteom | osteosarkom | |
| Sval | myom | myosarkom | |
| Cévní | angiom | angiosarkom | |
| Krvetvorná lymfatická | mononukleóza? | leukemie lymfom, myelom | |
| Nervová | centrální | gliom | glioblastom |
| periferní | ganglioneurom pargangliom | neuroblastom maligní paragangliom | |
| Zárodečná | gonadoblastom | seminom dysgerminom | |
| teratom zralý | teratom nezralý | ||
Vznik a rozvoj nádorového onemocnění
Podle teorie „nádorové kmenové buňky“ je nádor obecně odvozen od jedné buňky, která se dramaticky mění po sérii genetických změn. Zdravá buňka má definovaný tvar a strukturu a prosperuje mezi uspořádanými okolními buňkami. Odpovídá na podněty ze svého okolí a dává vznik dceřinným buňkám jen tehdy, jestliže rovnováha stimulačních a inhibičních signálů z okolí upřednostní buněčné dělení.
Avšak v procesu replikace nebo dělení existuje stálá hrozba vzniku mutací, náhodných změn, které mohou tento regulační cyklus porušovat. Jedna mutace může způsobit, že buňka, která vypadá normálně a je méně citlivá na vnější signály se může příležitostně začít nekontrolovaně dělit.
Akumulace genetických změn v důsledku genetické nestability může způsobit, že se dceřinná buňka stane zcela hluchou k externím signálům a vykazuje znaky malignity. Buňka ztrácí přesný tvar a hranice, nereaguje na růstově inhibiční signály a získává schopnost nekontrolovaně se dělit.
Vznikající masa stlačuje a poškozuje zdravou tkáň ve svém sousedství a může dále překonávat bariéry jednotlivých orgánů a metastázovat, což znamená, že kolonizuje vzdálené tkáně.
Většina benigních i maligních nádorů je složena z heterogenní směsi dediferencovaných buněk vzniklých z jediné buňky. Epidemiologické studie předpokládají, že nádorové onemocnění je způsobeno kombinací faktorů genetických a faktorů okolního prostředí. Výskyt je ovlivněn prostředím (polutanty, chemické látky, viry), životním stylem (kouření, alkohol), výživou (přítomnost antioxidačních faktorů, vitamínů, vlákniny, tuků). Předpokládá se, že vznik a rozvoj zejména některých typů nádorových onemocnění je až z 80 % ovlivněn faktory prostředí. Zbývajících 20 % je přičítáno dědičným složkám a spontánním mutacím.
Průběh onemocnění je velmi různý. Liší se podle typu nádoru, věku pacienta i způsobu léčení. Zhoubné nádory jsou u lidí velmi časté, v civilizovaných zemích jsou na druhém místě příčin úmrtí. Nádory však trpí i jiné živočišné druhy. Myši mají téměř všechny typy nádorů, které nalézáme u člověka, a proto jsou často využívány v experimentální oblasti. Jinak nádory nacházíme i u drůbeže, koček, psů, opic, plazů a dokonce i hmyzu.
Vznik a rozvoj nádorového onemocnění – karcinogeneze (kancerogeneze, ontogeneze, tumorigeneze) – je vícestupňovitý proces, který je výsledkem interakce genetických a epigenetických změn vyskytujících se hlavně u kmenových a prekurzorových buněk různých typů. Za vývoj nádoru jsou zodpovědné:
genetické změny – mutace
epigenetické změny a negenotoxické mechanizmy
ovlivňující expresi genů (především změny metylace DNA a acetylace histonů a dále ovlivnění mechanizmů přenosu signálů regulujících buněčný cyklus, proliferaci, diferenciaci a smrt buněk apoptózou, inhibice mezibuněčné komunikace atd.).
Základem celého procesu karcinogeneze je indukce mutací, tj. fáze iniciace. Dochází ke změnám genetického materiálu buňky, které nevratně mění normální buňku v preneoplastickou. Ve fázi rozvojové – promoční dochází k preferovanému klonálnímu růstu preneoplastických nebo neoplastických buněk po působení tzv. nádorově promočních podnětů (regenerace po odstranění části buněčné populace nebo po smrti buněk, růstové signály, působení vnějších signálů – látky z diety, chemické a a fyzikální faktory). Fáze je zpočátku vratná, později nevratná. Přechodná fáze konverze či transformace zahrnuje změny fenotypu a vznik maligního klonu.
Progrese představuje pozdější fáze vývoje nádoru a je charakterizována akumulací dalších mutací, zejména změnami počtu chromozómů a jejich přestavbami, což je spojeno se vzrůstající rychlostí proliferace, invazivitou a vznikem metastáz. Dochází tak k nevratnému přechodu preneoplastické populace v neoplastickou, z benigního do maligního stádia (obr. 1-1).
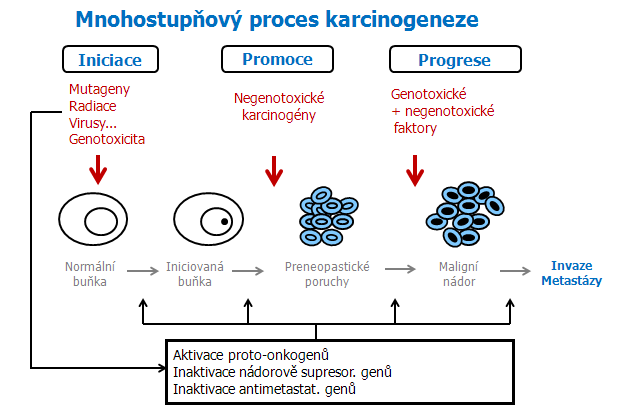
Obr. 1-1 Mnohostupňový proces karcinogeneze
Nádorové onemocnění vzniká v zásadě porušením homeostázy na úrovni buněk a buněčných populací. Homeostáza v tkáních je udržována integrovaným systémem komunikačních mechanizmů (mimo-, vnitro- a mezibuněčných) a reguluje chování buněk především s ohledem na schopnost proliferace, diferenciace, adaptivní odpovědi a apoptózy.
Iniciované preneoplastické buňky jsou udržovány v latentním stavu v důsledku působení těchto "přirozených" regulačních mechanizmů. V podpůrné (promoční) fázi rozvoje nádorů se uplatňují látky působící negenotoxickými (nebo epigenetickými) mechanizmy, které způsobují změny chování buněk v důsledku deregulace zmíněných procesů. Zásahy, které vedou ke změnám v expresi genů a k poruchám homeostázy se odehrávají v buňce na různých úrovních a různými mechanizmy.
Základními znaky nádorové populace jsou pak zejména ztráta kontaktní inhibice a kontroly růstu, ztráta schopnosti terminální diferenciace, ztráta schopnosti apoptózy a snížení nebo inhibice mezibuněčné komunikace.
Mechanizmy karcinogeneze, buněčná transformace
Mechanizmus karcinogeneze zahrnuje přímé interakce s DNA a změny v expresi genů. Zatímco iniciace a progrese zahrnují strukturální změny v DNA, promoce je charakterizována nestálými změnami v proliferaci iniciovaných buněk a jejich potomstva a reverzibilními změnami v genové expresi. Strukturální změny genomu iniciované buňky jsou kvalitativně odlišné od změn v progresivním stadiu. V iniciačním stadiu dochází k jednoduchým záměnám bazí nebo malým delecím v kritických genech, zejména tzv. protoonkogenech, což stačí k přeměně normální buňky v iniciovanou. V progresivním stadiu dochází k velkým změnám v genomu, jako jsou chromozomální translokace, delece, inzerce a amplifikace genů.
Přítomnost jedné nebo více iniciovaných buněk ve tkáních s určitým stupněm replikace je obecným jevem. K fixaci iniciované buňky je třeba alespoň jedno kolo buněčného dělení (podobné fixaci mutace). Protože iniciační podněty jsou součástí prostředí (radiační pozadí, kontaminace potravin, látky v ovzduší), je mnoho zdrojů spontánního vzniku iniciovaných buněk. Takové pozadí iniciovaných buněk je pak zdrojem pro neoplastické poruchy, které se vyvíjejí po chronickém působení promočních látek (obr. 1-2).
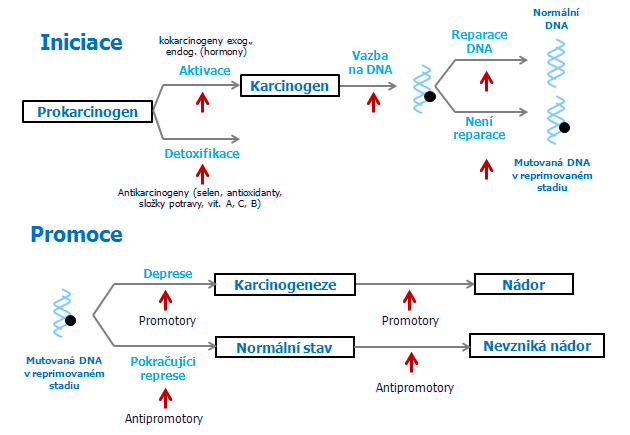
Obr. 1-2 Iniciace a promoce
Abnormality v karyotypu, které jsou znakem progresivního stadia se mohou vyskytovat v populacích s rychlostí proliferace převyšující normál, tedy takových, které jsou ve stadiu promoce a obzvláště, jestliže jejich genom je již změněn mutací. Tak se obě „genetická“ stadia karcinogeneze – iniciace a progrese – mohou vyskytovat nahodile a mezistádium promoce (indukované exogenně nebo endogenně) může sloužit k realizaci potenciálu pro neoplastický vývoj těchto spontánních procesů.
Změna genetické informace v buňce je obecně nazývána buněčnou tranformací. Může vzniknout spontánně nebo je indukována viry, chemickými látkami nebo fyzikálními faktory. Transformované buňky se liší od normálních buněk v metabolických a růstových vlastnostech, v požadavcích na růstové faktory a výživu, na fyzikální podmínky růstu, kultivační povrch (mohou růst i v třírozměrné formě), liší se v antigenních vlastnostech, morfologicky atd. Nemusí však nutně tvořit nádory v organismu.
Maligní transformací pak nazýváme přeměnu buňky s normálními růstovými vlastnostmi na buňku s vlastnostmi buňky maligní (zhoubné). Buňka ztrácí schopnost produkovat nebo odpovídat na specifické růstové signály (tj. růstové faktory a inhibiční faktory) nebo na ně odpovídá jinak, či produkuje vlastní odlišné signály (transformující růstové faktory). (obr. 1-3)
Normální buňky rostou v umělé kultuře in vitro spořádaně v jediné vrstvě a jejich množení se zastaví, když pokryjí dno nádoby. Existuje u nich tzv. kontaktní inhibice růstu. Tuto vlastnost nádorové buňky postrádají, rostou pořád dál i přes sebe, chovají se chaoticky a neuspořádaně. Nádorové buňky jsou "nesmrtelné", to znamená, že je lze neomezeně množit (obr. 1-4).
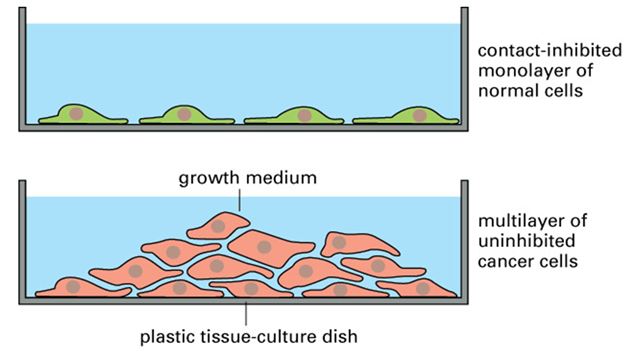
Obr. 1-4 Ztráta kontaktní inhibice v buněčné kultuře
(Figure 23–25. Molecular Biology of the Cell, 4th Edition)
Denzitně závislá kontrola růstu transformovaných buněk může být porušena ztrátou závislosti na koncentraci nebo přítomnosti pozitivních růstových faktorů séra. U negativních faktorů může být tato kontrola narušena buď ztrátou schopnosti transformovaných buněk tyto inhibitory produkovat, nebo ztrátou schopnosti na ně reagovat. Je tedy narušena takto realizovaná negativní zpětná vazba.
Kontrola růstu normálních savčích buněk zahrnuje interakce řady nespecifických i specifických růstových signálů. Při maligní transformaci dochází ke změnám v produkci i příjmu specifických růstových signálů zprostředkovaných proteiny v roli růstových stimulátorů nebo inhibitorů. Tyto podněty působí proti sobě nebo působí aditivně. Růst je tedy výslednicí interakce pozitivních a negativních signálů.
Změny v produkci a příjmu pozitivních a negativních signálů, které jsou výsledkem působení karcinogenních činitelů na genetický materiál buňky, mohou být startovací silou dalších fyziologicko – morfologických změn. Dereprese nesprávných genových sekvencí vede pak procesem kaskádovitých katastrof k rozvoji široké škály změn a je velmi těžké definovat změnu primární.
Existuje mnoho stupňů a úrovní, na kterých může být růst ovlivňován. Je to kombinace přímých a nepřímých mechanizmů, tj. průniku regulačních růstových faktorů do buněk za současného uvolnění vnitrobuněčných mediátorů modifikujících a zprostředkujících rozšíření růstového signálu v buňkách.
Některé změny chování transformovaných buněk mají úzký vztah k membránovým vlastnostem, což se projevuje v komunikaci buněk, především ve snížené schopnosti komunikace pomocí mezerovitých spojení (gap junction) - viz dále. Maligní změny mohou být dále spojeny i se ztrátou specifity komunikace.
Může tedy existovat mnoho úrovní vzniku nekontrolovaného nádorového růstu. Poznání těchto úrovní regulace se jeví jako hlavní směr poznání příčin nekontrolovaného růstu u jednotlivých typů nádorů.
Ztráta produkce růstových inhibitorů a reaktivity na ně a ztráta požadavků na růstové faktory u maligně transformovaných buněk jsou zřejmě primární děje v procesu maligní transformace onkogenními viry, chemickými karcinogeny a zářením.
Teorie karcinogeneze obsahuje koncept autokrinní růstové deregulace, zastavené diferenciace a imortalizace. V souvislosti s poznáním, že v onkogenním procesu jsou stejně důležité ztráta negativních signálů a indukce pozitivních signálů, byly identifikovány nádorově supresorové geny a onkogeny. V poslední době je kladen důraz na novou třídu onkogenů, tzv. represory apoptózy. Je velmi pravděpodobné, že všechny lidské typy rakoviny zahrnují mechanizmus potlačení apoptózy. V souvislosti s tím se objevil i termín „anti-cellular senescence factors“, tj. faktory působící proti stárnutí buňky.
Kontrolní otázky k tématu
Jak lze charakterizovat nádorovou tkáň?
Jak se liší benigní a maligní nádor?
Jaký je rozdíl mezi mutací a epigenetickou změnou?
Jaké základní fáze rozeznáváme v procesu karcinogeneze a čím jsou charakterizovány?
Jaké jsou zásadní rozdíly mezi iniciační a promoční fází?
Ve kterých fázích a jak se rozhoduje o pokračování nádorového procesu?
Jaké jsou základní znaky nádorové populace?
Co rozumíte pod pojmem buněčná transformace a maligní transformace?
Jak je v zásadě zajišťována rovnováha (homeostáza) v buněčných populacích?
V jakém smyslu se z hlediska růstových signálů mění nádorová populace?
V jaké tkáni vznikají karcinomy a v jaké sarkomy?
Vyjmenujte faktory, které mohou způsobit iniciaci buňky.
Co znamená kontaktní inhibice růstu buněk?
ÚEB Biol, Přírodovědecká fakulta, Masarykova univerzita |
Návrat na úvodní stránku webu, přístupnost |
| Servisní středisko pro e-learning na MU
| Fakulta informatiky Masarykovy univerzity, 2012–2013
Centrum interaktivních a multimediálních studijních opor pro inovaci výuky a efektivní učení | CZ.1.07/2.2.00/28.0041