Přírodovědecká fakulta Masarykovy univerzity
prof. RNDr. Jiřina Hofmanová, CSc.
Invazivita a tvorba metastáz
Metastatická kaskáda
Metastázy jsou definovány jako tvorba progresívně rostoucích sekundárních nádorových fokusů v místech nespojených s primárním nádorem.
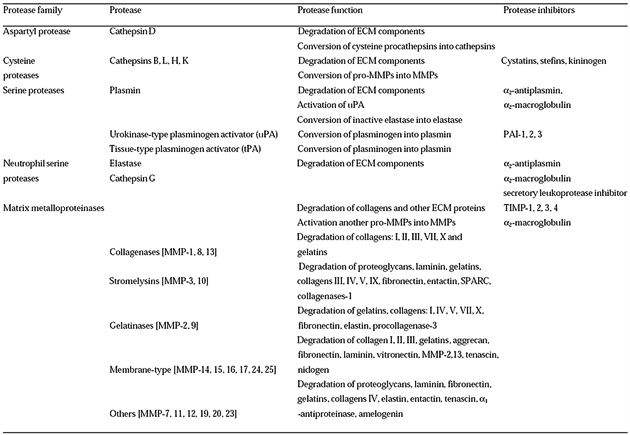
Vývoj klinicky významných metastáz vyžaduje u nádorových buněk dovršení série definovaných kroků označovaných jako metastatická kaskáda (obr. 10-1), která zahrnuje:
- uvolnění buňky (od okolních buněk a mimobuněčné matrix),
- překonání bazální membrány v epitelech,
- překonání bazální membrány a endotelu cév,
- přenos krevním (lymfatickým) řečištěm,
- překonání endotelu a bazálních membrán v jiné lokalitě,
- uchycení v nové tkáni,
- přežívání, proliferace,
- vznik mikro- a makrometastáz vedoucí k letalitě onemocnění.
Obr. 10-1 Proces vzniku metastáz
(Figure 23-15. Molecular Biology of the Cell, 4th Edition.)
Byla objevena řada genů a proteinů, které regulují metastatickou schopnost buněk a které musí být koordinovaně exprimovány. Naproti tomu existují tzv. supresorové geny pro metastázy, které zabraňují tvorbě spontánních makroskopických metastáz, aniž by ovlivňovaly růst primárního nádoru. Tyto geny tvoří zvláštní třídu odlišnou od onkogenů a nádorově supresorových genů a ztráta jejich funkce umožňuje tvorbu metastáz. Jedním z prvních objevených genů je nm23.
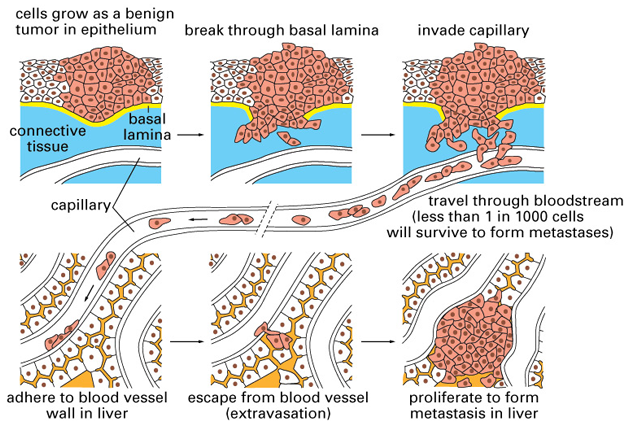
Vytvoření primárního nádoru vyžaduje řadu molekulárních a buněčných změn, které buňce umožní obejít normální mechanizmy kontroly růstu a ovlivňovat lokální prostředí. Nádorová progrese a získání schopnosti tvořit metastázy vyžaduje další změny v genové expresi, které završí maligní fenotyp (obr. 10-2). Důležitou roli hrají zejména enzymy degradující proteiny a adhezívní molekuly. Po invazi do sousedících tkání jsou nádorové buňky přes cévní a lymfatické cesty rozesety a putují individuálně nebo ve shlucích. Na vhodném sekundárním místě se zastavují ať už z důvodů své velikosti nebo po vazbě na specifické molekuly v daném orgánu nebo tkáni. Pro vytvoření metastáz je také zásadní, aby uvolněné nádorové buňky přežívaly a proliferovaly v cévách nebo v obklopující tkáni. Tvorba klinicky důležitých metastáz závisí na dovršení každého kroku kaskády. Celý proces progrese může trvat řadu měsíců nebo dokonce let.
Obr. 10-2 Benigní versus maligní nádory
(Figure 23-3. Molecular Biology of the Cell, 4th Edition.)
Pro uvolnění buněk z nádorové masy i pro jejich uchycení a tvorbu metastáz ve vzdálené tkáni jsou důležité poruchy exprese a funkce molekul zajišťujících jak vzájemné buněčné vazby (kadheriny) tak vazby k ECM (integriny). Uvolněná buňka bez příslušných vazeb za normálních okolností není schopna přežít. Její přežití pak umožňují poruchy regulace apoptózy.
Aby mohly proliferovat, musí být přežívající rozeseté nádorové buňky schopny zahájit pro buňku odpovídající a na kontextu závislé signální kaskády, které jim umožní nejen přežívat, ale zahájit buněčný cyklus a dělit se. Toto přežití a následný růst dovoluje pouze určité prostředí. Kritické jsou pro přežití mezibuněčné interakce se stromatem a ostatními nádorovými buňkami. Ty zahrnují aktivaci na adhezi závislých drah, kde se uplatňují zejména molekuly kadherinů a integrinů.
Přechod od mikro- k makroskopickým metastázám bývá také spojen s projevem tzv. angiogenního fenotypu. Vaskularizace (tvorba nových cév v nádoru) je posledním krokem metastatické kolonizace.
Metodické základy současného výzkumu
Výzkum je zaměřen zejména na poznání a úspěšné klonování předpokládaných metastatických genů a manipulace s jejich expresí nebo funkcí genových produktů. Existují tři nejobecněji používané testy metastatického procesu:
- Test na spontánní metastázy in vivo, kdy jsou nádorové buňky subkutánně injikovány do syngenních nebo imunodeficientních zvířat, což napodobuje přirozenou situaci.
- Test na experimentální metastázy in vivo, kdy jsou nádorové buňky injikovány intravenózně. Tento test odhaduje schopnost buněk opustit krevní řečiště a kolonizovat specifické tkáně.
- Test invazivity in vitro s využitím buněčných kultur, kdy jsou nádorové buňky umístěny na povrch matrix (tvořené např. z kuřecí srdeční nebo chorioalantoidní membrány či umělé membrány) a sleduje se migrace tímto materiálem.
Poznatky o povrchových a vnitrobuněčných regulačních molekulách účastnících se metastatického procesu jsou vodítkem pro nové terapeutické přístupy. Využívají se např. specifické monoklonální protilátky proti proteinům účastnícím se metastatického procesu nebo „antisense“ techniky zaměřené na vyblokování činnosti specifických genů.
Úloha buněčných adhezí v metastatickém procesu
V mnohobuněčném organismu hrají klíčovou úlohu buněčné kontakty a s nimi spojená výměna signálů (informací). Toto je zásadní jak v embryogenezi tak i při udržování tkáňové integrity a funkce orgánů dospělého organizmu. V normální tkáni jsou buňky spojeny jak navzájem, tak s nerozpustnou směsí proteinů vyplňujících prostor mezi nimi – tzv. mimobuněčnou matrix (ECM). To platí především pro epiteliální tkáně, kde existuje vrstva buněk tvořících povrchy kůže a řady orgánů (plíce, zažívací trakt atd.), z nichž vzniká většina nádorů.
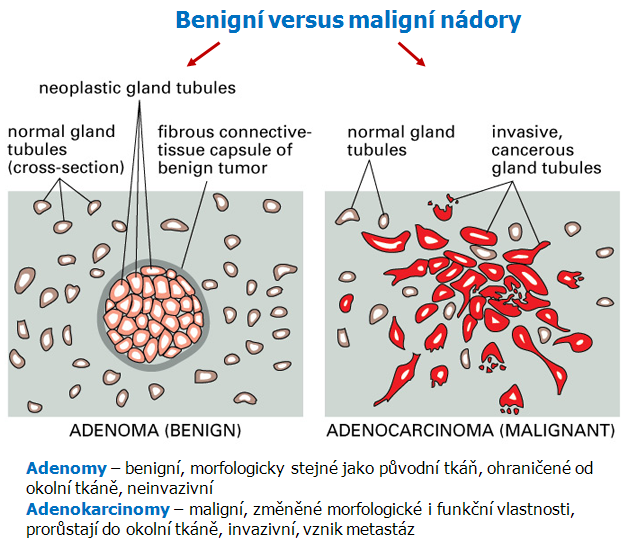
Adhezívní molekuly (Cell Adhesion Molecules – CAM) jsou děleny do 4 základních skupin v závislosti na jejich biochemických a strukturálních vlastnostech: selektiny, imunoglobulinová supergenová rodina (ICAM), kadheriny a integriny (obr. 10-3).
Obr. 10-3 „Junctional“ a „nonjunctional“ adhezívní mechanizmy živočišných buněk pro vzájemnou vazbu a pro vazbu k extracelulární matrix
(Figure 19-32. Molecular Biology of the Cell, 4th Edition.)
Buňky se navzájem dotýkají prostřednictvím řady povrchových molekul. Tzv. „juxtacrine signaling“ vyžaduje těsnou blízkost buněk a hlavní třídou molekul zprostředkujících buněčnou adhezi jsou kadheriny. Jak se buňky dotýkají, kadheriny se sdružují a spojují prostřednictvím jejich cytoplazmatických domén a s nimi spojených proteinů, zejména kateninů s cytoskeletonem. Prvním krokem je interakce mezi mimobuněčnými kadherinovými doménami sousedních buněk. Před sdružením se kadherin spojuje s cytoplazmatickým proteinem beta-kateninem, vinkulinem nebo plakoglobinem (gamma katenin). Kromě spojování kadherinů a stabilizace adhezívních spojů, zprostředkovává beta-katenin a plakoglobin také interakce mezi kadheriny a jinými membránovými receptorovými proteiny, jmenovitě s receptorem pro EGF (obr. 10-4).
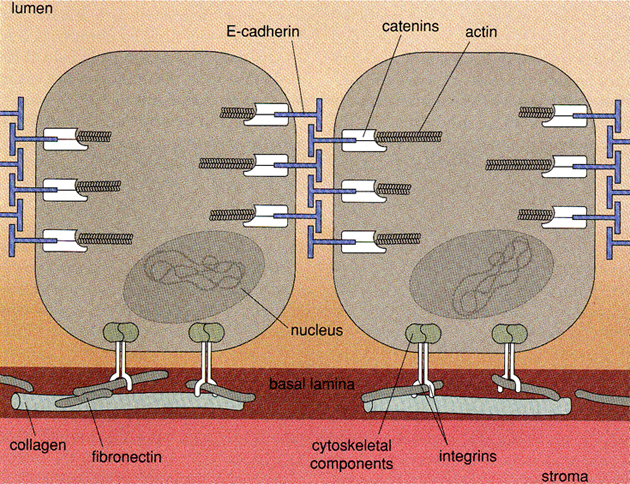
Obr. 10-4 Síť proteinových spojů u normálních epiteliálních buněk
(Van Noorden Cj.J.F. et al., American Scientist 1998 : 130)
S pomocí tkáňových kultur bylo zjištěno, že manipulací např s E-kadherinem lze výrazně ovlivnit invazívní schopnost nádorových buněk. Introdukce expresního vektoru pro E-kadherin do metastázujících nádorových buněk neexprimujících E-kadherin zabraňuje invazivitě i tvorbě spontánních metastáz. Naopak „antisense“ nukleotidy pro E-kadherin mohou vyvolat schopnost tvorby metastáz u neinvazívních nádorových buněk.
E-kadherin, vinkulin a katenin tak byly identifikovány jako supresorové geny pro metastázy. Ukazuje se, že pro aktivitu kadherinových a kateninových proteinů je potřeba celá řada signálních systémů, což je předmětem současného výzkumu (modely Drosophila a Xenopus laevis). Ve složité informační smyčce signálů předávaných sousedními buňkami existuje zpětnovazebné spojení, tj. předávané signály mohou zpětně regulovat komponenty adheze.
Adhezívní schopnost k ECM umožňuje buňkám přežívat a proliferovat. Jak se ukázalo, kultivované buňky se nedělí dokud nejsou přichyceny k povrchu, což je vlastnost zvaná závislost na podkladu (anchorage dependence). Tento vztah je zprostředkován integriny. Integriny jsou skupinou buněčných adhezívních receptorů představovaných dvěma nekovalentně spojenými jednotkami alfa a beta, které mohou heterodimerizovat ve více než 20 kombinacích. Bylo prokázáno, že neuchycené buňky přestávají proliferovat, protože dochází k inaktivaci komplexu cyklinE-cdk2. Kromě toho podléhají buňky také apoptóze. Aby buňky přežívaly, je nutné, aby ECM, ke které adherují, nesla určitou oblat, tzv. „area code“, a buňky musí exprimovat příslušné integriny.
Migrace a invaze buněk
Metastatická schopnost nádorových buněk, tj. schopnost rozsevu do vzdálených míst v organizmu, je složitý několikastupňový proces, je odrazem stupně malignity a je většinou příčinou letality onemocnění. Buňky se musí uvolnit z mateřské tkáně a od ostatních nádorových buněk, musí překonat tzv. bazální membránu (v epitelech) a následně bazální membránu obklopující krevní cévy. Po překonání vrstvy endoteliálních buněk je buňka v krevním řečišti a může být přenesena kamkoli do těla (obr. 10-5, 10-6, 10-7). V klinice existují metody jak detekovat nádorové buňky v krvi. Tato včasná diagnóza – detekce mikrometastáz – ještě před vytvořením samotných metastáz je velmi důležitá pro včasnou a vhodnou terapii.
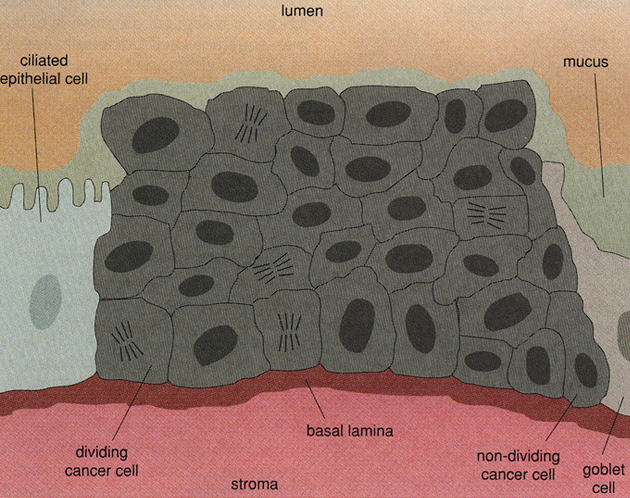
Obr. 10-5 Karcinom in situ
(Van Noorden Cj.J.F. et al., American Scientist 1998 : 130)
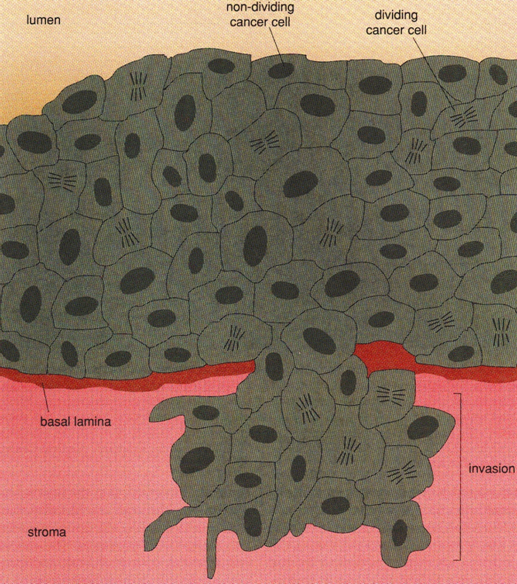
Obr. 10-6 Malignita – buňky pronikají přes bazální laminu a stroma
(Van Noorden Cj.J.F. et al., American Scientist 1998 : 130)
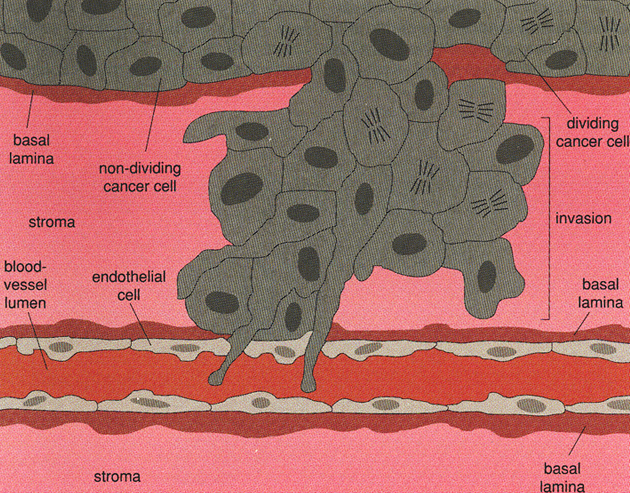
Obr. 10-7 Invaze do krevních a lymfatických cév
– narušení endotelové bariéry
(Van Noorden Cj.J.F. et al., American Scientist 1998 : 130)
Úloha apoptózy
Mechanizmem udržujícím integritu tkáně indukovaným po ztrátě uchycení nebo při neodpovídajícím uchycení je apoptóza – anoikis („detachment induced apoptosis“). Buňky normálně nemohou odplout do jiné tkáně a tam růst. Nádorové buňky musí tyto mechanizmy porušit a na tomto procesu se opět podílejí mutované verze normálních genů – onkogeny. Proteiny kódované onkogeny předávají falešné zprávy do jádra buňky, která se pak chová nepatřičně. Závislost na podkladu je však jen jednou z překážek, kterou musí nádorová buňka překonat (obr. 10-8). Během své migrace se buňka musí ubránit řadě obranných mechanizmů a tak jen asi 1 z 10 000 nádorových buněk uspěje a vytvoří metastázu. Studium krevního oběhu vysvětluje také, proč různé nádory metastázují především do specifických orgánů (obr. 10-9). Cirkulující nádorová buňka přechází do nejbližších dostupných cév. Krev odcházející z většiny orgánů směřuje do plic (plicní metastázy), jen ze střeva jde nejdříve do jater (jaterní metastázy). Nádory prostaty často metastázují do stehenní kosti. Jinak jsou běžné metastázy v lymfatických uzlinách.
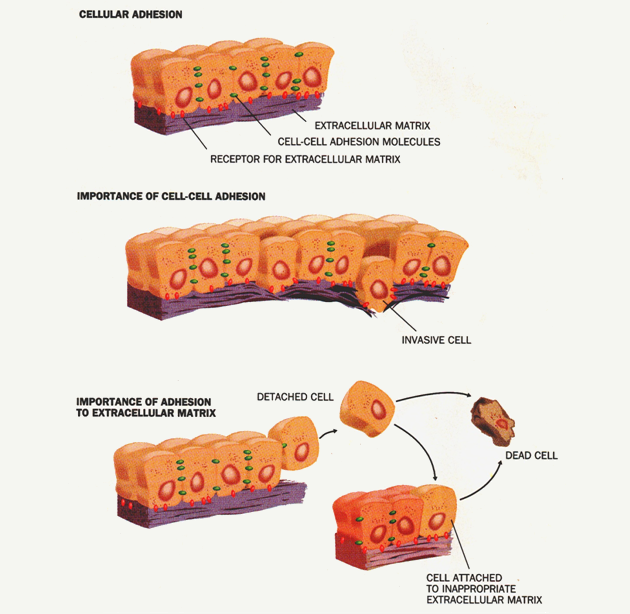
Obr. 10-8 Adheze buněk
Uvolněná buňka bez příslušných vazeb za normálních okolností není schopna přežít.
Přežití umožňují poruchy regulace apoptózy – anoikis („detachment-induced apoptosis“).
(Ruoslahti E., Scientific American 1996 : 72)

Obr. 10-9 Adheze nádorových buněk na cévní stěny ve vzdálených tkáních
(Van Noorden Cj.J.F. et al., American Scientist 1998 : 130)
Hypotéza „docking a locking“
Interakce nádorových buněk s cévními endoteliálními buňkami může být rozdělena do počáteční fáze slabé adheze („docking“) a pozdější fáze pevné adheze („locking“) (obr. 10-10). Volné putující nádorové buňky nejdříve tvoří volné vazby s endotelem, pak po něm rolují a vytvářejí pevné vazby. Každá fáze je zprostředkovaná specifickými adhezívními molekulami a přechod je zprostředkován širokou škálou bioaktivních mediátorů (cytokiny, chemokiny a bioaktivní lipidy) produkovaných aktivovanými nádorovými i hostitelskými buňkami (platelety, leukocyty, endoteliální buňky atd.). Slabé vazby jsou zajišťovány povrchovými uhlovodíky, pevnějších vazeb se pak účastní inducibilní adhezívní molekuly (zejména E-selektin, ICAM, VCAM) a pevnější adheze nádorových buněk jsou zprostředkovány v základu integrinovými receptory. Integriny jsou hlavními přenašeči signálu pro následné molekulární děje (uvolnění od endoteliálních buněk, interakce s ECM, proteolýza, pohyb buněk a invaze) (obr. 10-11).
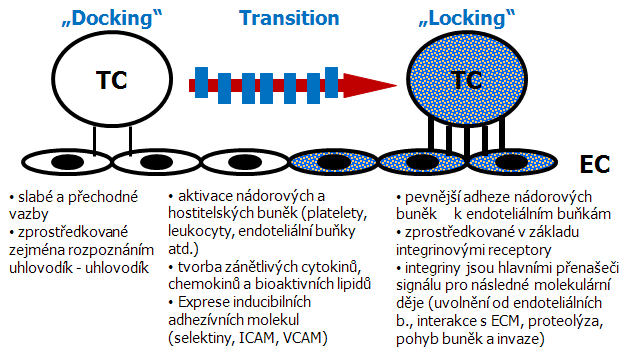
Obr. 10-10 Hypotéza „docking a locking“
(Honn K.V. et al., Cancer Metastasis Rev 1994 : 365)

Obr. 10-11 Interakce nádorové buňky s endotelem
(Iiizumi M. et al., Microvascular Res 2007 : 114)
Prostup buněk endotelem
Po vytvoření pevné vazby zahajují nádorové buňky, tzv. diapedezu – prostup endotelem v několika krocích (obr. 10-12):
- migrují mezi spoji endoteliálních buněk (paracelulární diapedeza),
- tvoří mozaikovitou chimerickou vrstvu obou typů buněk,
- pronikají skrz endoteliální buňky ve velké vakuole (transcelulární diapedeza).
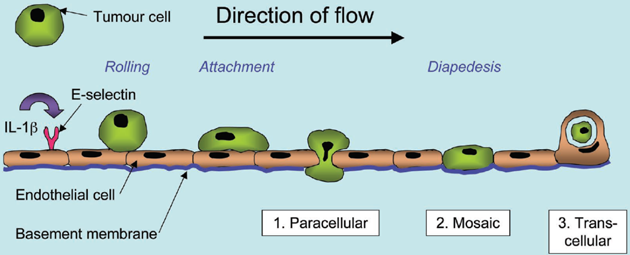
Obr. 10-12 Prostup (diapedeze) nádorových buněk kolonu endotelem
(Woodward J. Cell Adhesion & Migration 2008 : 151)
Uchycení buněk v nové tkáni
V konečném stadiu musí buňka překonat kromě bariéry endotelu stěny cév, bazální membránu v nové tkáni, musí se zde uchytit a začít se dělit (obr. 10-13). Na těchto procesech se podílí řada molekul. Jsou to zejména proteázy degradující matrix – metaloproteinázy. Tyto enzymy exprimují především bílé krvinky, které normálně musí překonávat membránové bariéry. U jiných buněk jsou exprimovány málo a funguje zde systém zahrnující inhibitory metaloproteináz Dále jsou to receptory pro endoteliální buňky, vazebné proteiny, faktory motility a jejich receptory, receptory pro růstové faktory (odpověď na nové mikroprostředí) atd.
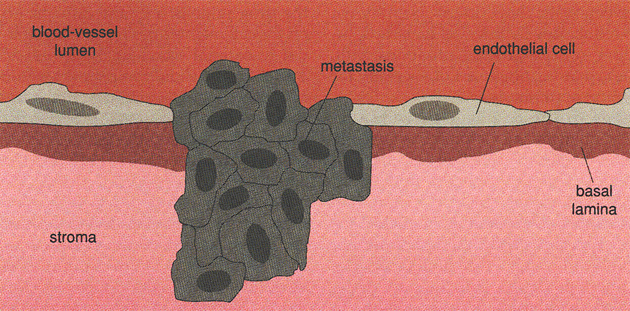
Obr. 10-13 Metastatická nádorová buňka proniká přes endotelovou bariéru do tkáně, uchytí se, začne se dělit a tvoří sekundární nádor
(Van Noorden Cj.J.F. et al., American Scientist 1998 : 130)
Poruchy proteolytické – antiproteolytické rovnováhy hrají důležitou roli v degradaci tkání. Během nádorového růstu a tvorby metastáz je kontrola proteolytické aktivity narušena.
Systémy následujících proteolytických enzymů fungují v kooperaci (obr. 10-14):
- Lyzozomální proteázy – aspartyl a cystein proteázy – katepsiny
- Serinové proteázy – plasminogen, plasminogenové aktivátory
- Metaloproteinázy
Plasminogenové aktivátory (PA) jsou serinové proteázy, které přeměňují plasminogen na plasmin. Plasmin degraduje různé složky ECM včetně fibrinu, fibronektinu, lamininu atd. Plasmin také aktivuje několik typů metaloproteináz.
Rodina matrix metaloproteináz (MMP) má asi 16 členů, z nichž většina jsou rozpustné sekretované enzymy nebo transmembránové proteiny schopné digesce ECM nebo komponent bazální membrány. Představují různé typy enzymů podle struktury a substrátové specifity (kolagenázy, gelatinázy, stromelysiny). Jsou exprimovány jako latentní enzymy s podobnou strukturou domén. Některé také obsahují transmembránovou doménu a jsou lokalizovány na buněčném povrchu.
PA a MMP jsou sekretovány spolu se svými inhibitory (za normálních podmínek nízká hladina), což zajišťuje přísnou kontrolu lokální proteolytické aktivity a je tak zachována normální struktura tkání.
Aktivita PA i MMP je kontrolována na několika úrovních:
- exprese se zvyšuje působením angiogenních růstových faktorů a cytokinů,
- pro-MMP a pro-PA mohou být proteolyticky aktivovány,
- MMP, plasmin a PA jsou regulovány tkáňovými inhibitory MMP (TIMP).
Existuje řada důkazů, že tato kontrola je během nádorového růstu a tvorby metastáz narušena. U mnoha typů nádorů (kolorekta, prsu, žaludku, moč. měchýře, prostaty) byla detekována vysoká aktivita MMP. Byla také nalezena dobrá korelace mezi množstvím MMP a agresivitou a invazivitou nádoru.
V invazívním procesu hrají také důležitou roli oxidativní změny biologicky aktivních proteinů, které jsou závislé na typu a koncentraci reaktivních kyslíkových metabolitů (ROS).
Oxidativní modifikace struktury proteolytických enzymů a jejich inhibitorů vede k porušení rovnováhy. Tyto změny zpětně pak podporují další produkci ROS granulocyty a makrofágy (obr. 10-15 a 10-16).
Vše vede ke zvýšené proteolýze a destrukci ECM.
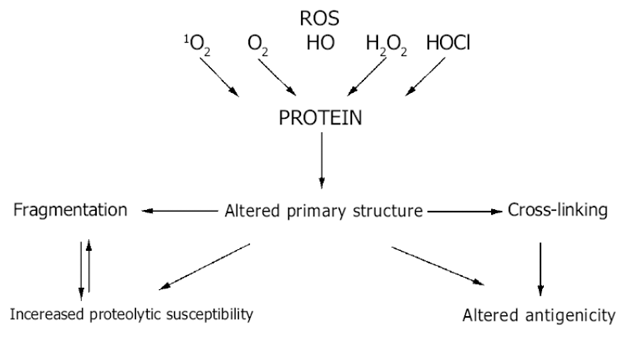
Obr. 10-15 Reaktivní metabolity kyslíku (ROS) v proteolytické – antiproteolytické rovnováze 1
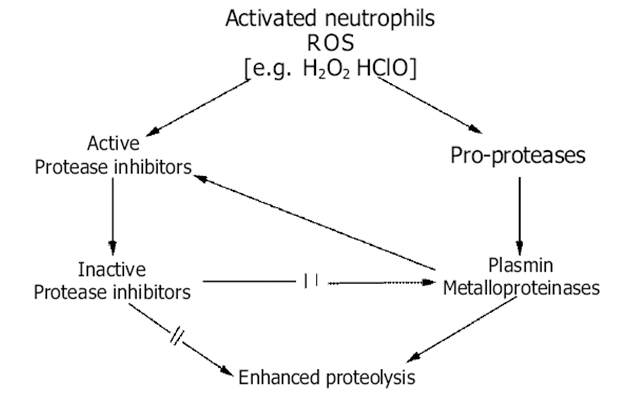
Obr. 10-16 Reaktivní metabolity kyslíku (ROS) v proteolytické – antiproteolytické rovnováze 2
Interakce s ECM
Migrující buňky musí navázat také nové kontakty s komponentami matrix. Tyto kontakty jsou umožňovány dalšími povrchovými adhezívními molekulami důležitými pro usídlení buněk v nové tkáni. Patří k nim především hyaluronan (velký glykosaminoglycan) regulující buněčnou motilitu, chemotaxi, invazi, proliferaci, tvar a metabolické funkce. Významná je exprese specifických receptorů pro hyaluronan, která podporuje vznik metastáz (obr. 10-17). Patří k nim CD44, pleomorfní receptor, který váže též fibronektin, laminin a jiné ligandy. CD44 byl objeven jako leukocytární antigen umožňující usídlení (homing) lymfocytů. Pomocí specifických monoklonálních protilátek byl pak detekován u metastázujících buněk, kterým umožňuje transendoteliální migraci a kolonizaci tkání (obr. 10-18). Předpokládá se, že metastázující buňky tak využívají genetický program lymfocytů a makrofágů – jediných migrujících buněk v normálním dospělém organizmu. Jako další takové molekuly byly detekovány specifické selektiny a integriny (obr. 10-19). Nádorové buňky mění složení integrinů na svém povrchu během progrese (obr. 10-20). Je-li pomocí specifických peptidů blokována interakce s ligandem, je blokována invaze in vitro i tvorba experimentálních metastáz.
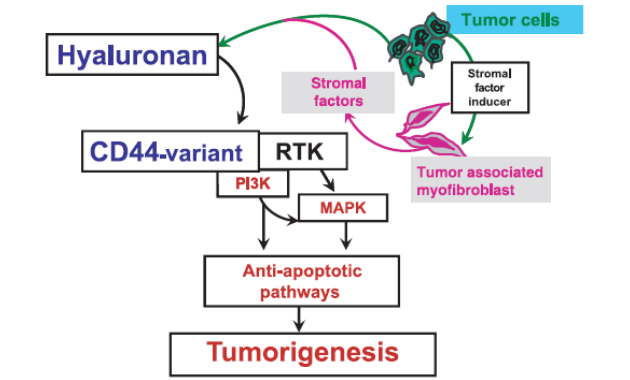
Model interakce mezi nádorovými (epiteliálními) buňkami a s nádorem spojenými stromálními myofibroblasty. Tyto buňky navzájem ovlivňují svůj vývoj. Extracelulární doména CD44- variant obsahující sekvence pro CD44 - varianty a jejich interakce s hyaluronanem je potřebná k na stromálních faktorech závislé aktivaci receptorových tyrozin kináz (RTK jako je hepatocyte growth factor/Met) a dalších antiapoptických signálů zahrnujících PI3K/Akt a MAPK. Hyaluronan produkovaný stromálními myofibroblasty a syntetizovaný v reakci na stromální faktory (HGF) a CD44- varianty odvozené od nádorových buněk a RTK se podílejí na rozvoji nádoru.
(Misra S et al., FEBS J 2011 : 1429)
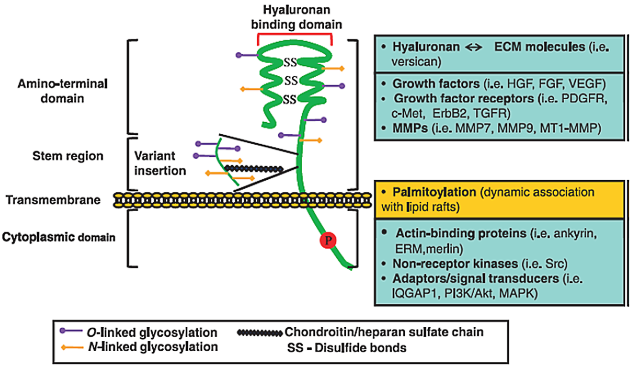
Struktura, vazebné domény a interakce CD44. Ektodoména CD44 obsahuje vazebný motiv pro hyaluronan a je označena chondroitin/heparan sulfátem. Obojí ovlivňují vazebnou kapacitu hyaluronanu a umožňují interakce s růstovými faktory, jejich receptory a metaloproteinázami (MMP). Transmembránové i cytoplazmatické domény podléhají mnohanásobným posttranslačním modifikacím včetně palmitoylace a fosforylace na cysteinových a serinových zbytcích, což podporuje vazbu proteinů s klíčovou funkcí v organizaci cytoskeletu a signálování. ErbB2 (epidermal growth factor receptor; ERM, ezrin-radixin-moesin; FGF, fibroblast growth factor; HGF, hepatocyte growth factor; IQGAP1, IQ motif obsahující GTPasu aktivující protein; MAPK, mitogen activating protein kinase; PI3K, phosphoinositide 3- kinase; PDGFR, platelet-derived growth factor; TGFR, transforming growth factor receptor; VEGF, vascular endothelial growth factor.
(Misra S et al., FEBS J 2011 : 1429)
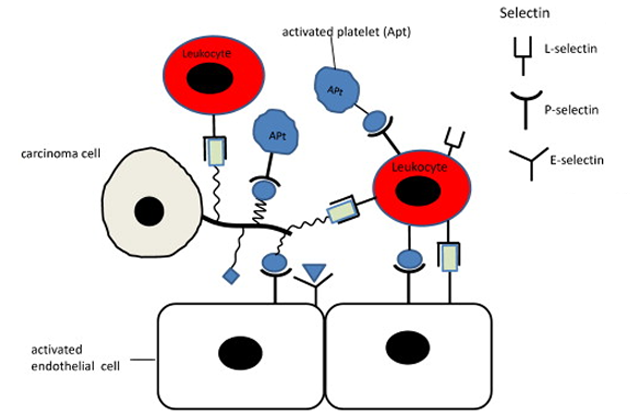
Obr. 10-19 P-, E- and L-selektiny u aktivovaných endotheliálních buněk a leukocytů se vážou ke specifických nádorovým ligandům
(Rambaruth N.D.S. a Dwek M.V., Acta Histochemica 2011 : 591)
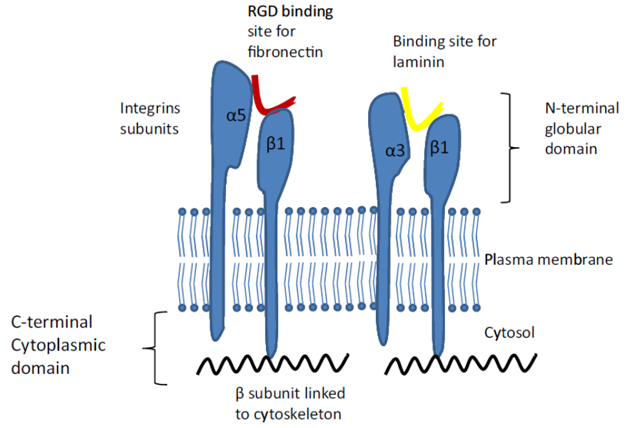
Obr. 10-20 Interakce mezi buňkami a ECM
Vazebná místa integrinů pro složky ECM (fibronektin, laminin)
(Rambaruth N.D.S. a Dwek M.V., Acta Histochemica 2011 : 591)
Povrchové a transmembránové molekuly jako CD44 a integriny nezpůsobují jen vzájemný buněčný kontakt nebo kontakt s ECM, ale zajišťují též přenos signálu do nitra buňky po navázání ligandu (obr. 10-21). To má za následek jednak reorganizaci cytoskeletonu (změny tvaru buněk, motility) a jednak změny genetického programu, např. zvýšení fosforylace tyrozinu nebo aktivaci GTP. Byly identifikovány též intracelulární proteiny, které se specificky exprimují v metastázujících buňkách a účastní se přenosu signálů v buňce, např. mts-1 a Tiam-1.
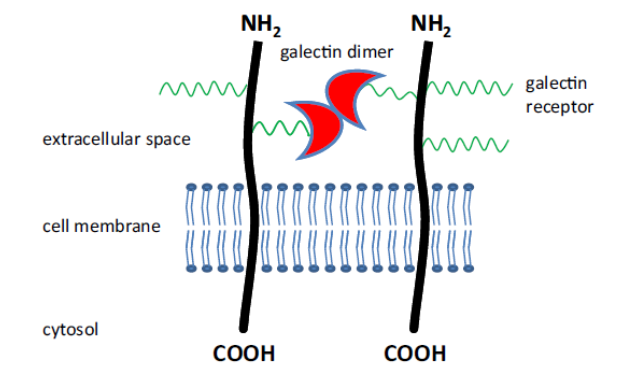
Obr. 10-21 Galektiny se účastní adhezí buňka-ECM, migrace, růstu, apoptózy a diferenciace.
Tvoří propojení důležitá při aktivaci receptorů a indukci vnitrob. signálů
Jsou změněny v patologických podmínkách
(Rambaruth N.D.S. a Dwek M.V., Acta Histochemica 2011 : 591)
Úloha mucinů v karcinogenezi
Muciny (MUC) jsou velké glykosylované proteiny syntetizované buňkami gastrointestinálního, dýchacího a močopohlavního ústrojí. Jsou kódovány řadou tkáňově specifických genů. Jejich úlohou je chránit epitel proti mechanickému, chemickému, enzymatickému a mikrobiálnímu poškození. Normální epiteliální buňky sekretují s membránou spojené muciny jen na apikálním konci a tak nebrání adhezi mezi buňkami navzájem nebo mezi a buňkou a substrátem. Hlavním mucinem sekretovaným ve střevě gobletovými buňkami je MUC2.
Poruchy povrchových mucinů jsou obecnou charakteristikou maligní transformace (obr. 10-22). Jsou odpovědné za abnormální chování buněk, změny adheze nebo metastázování a uniknutí z imunologického dozoru. Nádorové buňky totiž exprimují muciny po celém povrchu, což blokuje receptory a adheze s ostatními buňkami. Exprese se zvyšuje působením angiogenních růstových faktorů a cytokinů
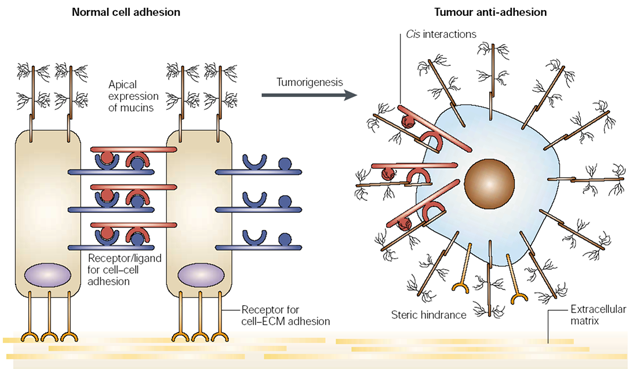
Obr. 10-22 Antiadhezívní vlastnosti mucinů
(Hollingsworth M.A. and Swanson B.J. Nature Rev Cancer 2004 : 45)
Nádory využívají
- antiadhezívních vlastností mucinů k uvolnění z nádorové masy a okolního stromatu a k invazi,
- adhezívních vlastností mucinů k připojení k endotelu a k invazi,
- muciny k úniku z imunologického dohledu (obr. 10-23).
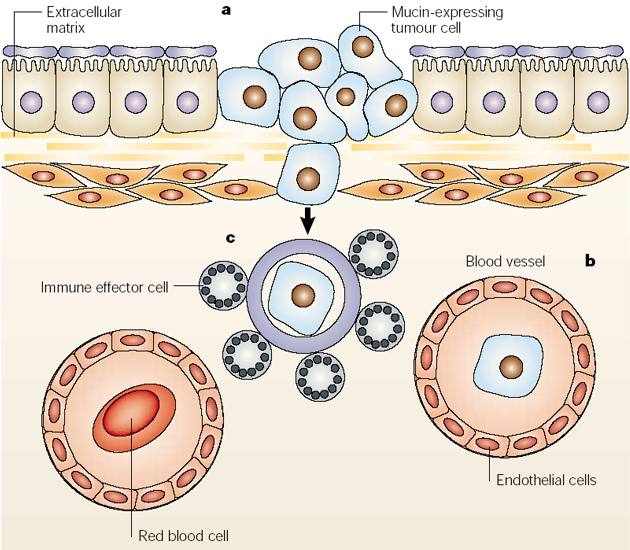
Obr. 10-23 Mnohonásobná úloha mucinů v rozvoji nádorů
(Hollingsworth M.A. and Swanson B.J. Nature Rev Cancer 2004 : 45)
Kontrolní otázky k tématu
Jak je charakterizováno progresivní stadium karcinogeneze?
Popište metastatickou kaskádu.
Které adhezívní molekuly hrají významnou úlohu v metastatickém procesu?
Co rozumíte pod pojmem závislost buněk na podkladu?
Jaká je úloha apoptózy v metastatickém procesu?
Vysvětlete hypotézu tzv. „docking a locking“.
Jak překonávají nádorové buňky tkáňové bariéry?
Jmenujte molekuly účastnící se proteolytické-antiproteolytické rovnováhy ve tkáních.
Které molekuly jsou zásadní v interakci s ECM?
Co jsou to muciny a jak se uplatňují při rozvoji nádorů?
ÚEB Biol, Přírodovědecká fakulta, Masarykova univerzita |
Návrat na úvodní stránku webu, přístupnost |
| Servisní středisko pro e-learning na MU
| Fakulta informatiky Masarykovy univerzity, 2012–2013
Centrum interaktivních a multimediálních studijních opor pro inovaci výuky a efektivní učení | CZ.1.07/2.2.00/28.0041