Přírodovědecká fakulta Masarykovy univerzity
doc. RNDr. Jiřina Hofmanová, CSc.
Molekulární základy nádorového onemocnění
Během posledních desítek let bylo věnováno velké úsilí poznání základních molekulárních mechanizmů vzniku nádoru. Karcinogeneze zahrnuje postupnou modifikaci řady genů, kde každá další změna genu vytváří další fenotypovou aberaci. Existuje řada důkazů pro primární úlohu poškození DNA v maligní transformaci. Interakce řady karcinogenů s DNA, souvislost karyotypových abnormalit s řadou nádorů a dědičnost maligního fenotypu svědčí o mutační etiologii maligní transformace.
Postupně vznikl koncept společného mechanizmu maligní transformace u různých nádorů. Objev genů důležitých v tomto procesu umožňuje charakterizovat jejich úlohu u dědičných nádorů, popsat řadu genetických aberací nutných pro maligní transformaci a objasňovat molekulární mechanizmy karcinogeneze. Intenzívní studie těchto genů poskytují také nový pohled na kontrolu buněčného růstu, diferenciace i apoptózy.
Protoonkogeny a onkogeny
Byla již objevena řada genů odpovědných za vývoj rakoviny. Na porozumění maligní transformaci má zásluhu zejména široká škála dřívějších prací s onkogenními viry. První tzv. onkogen s r c (sarcoma) byl izolován v roce 1970 z viru Rousova sarkomu u kuřat a označen v-src (virus). Virus Rousova sarkomu má dvě rozdílné části: část kódující proteiny odpovědné za replikaci viru a část kódující s r c gen umoňující vznik nádorů in vivo u kuřat. Normální kuřecí genom obsahuje příbuzný gen c-src (cellular) (obr. 3-1). Později se ukázalo, že řada retrovirů je onkogenních. Bylo též prokázáno, že src není jednoznačně retrovirový gen, ale spíše téměř přesná kopie genu nalezeného ve všech kuřecích buňkách. Tento normální gen, tzv. protoonkogen, je v retroviru modifikován (aktivován) tak, že působí po přenesení do buněk nádor (obr. 3-2). Objev s onkogeny příbuzných sekvencí v eukaryotickém genomu stimuloval úsilí transformovat normální buňky DNA stejným způsobem, jaký užívají retroviry. V řadě laboratoří byly transformovány myší fibroblasty DNA s různých přirozených nebo chemicky indukovaných nádorů (obr. 3-3). Ukázalo se, že maligní charakter transformovaných buněk může být přenášen defektem přítomným v DNA z nádorů. Pozitivních je však v transformačních pokusech asi jen 20 % nádorových vzorků.

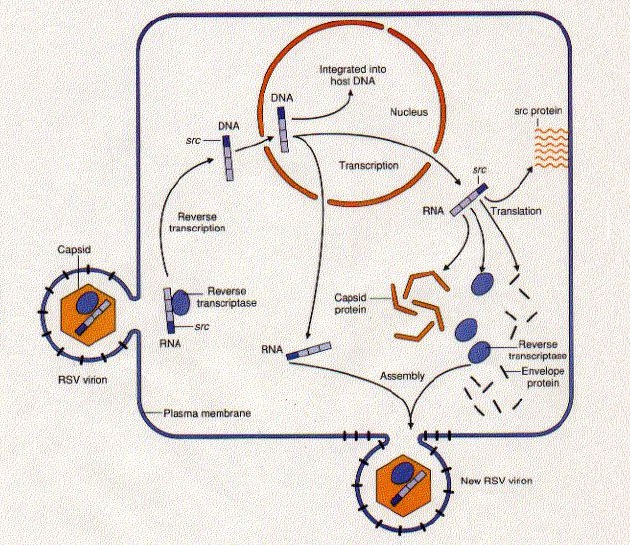
Obr. 3-1 Virus Rousova sarkomu a jeho životní cyklus
(zdroj: http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/R/RSV.html)
Obr. 3-1 Virus Rousova sarkomu a jeho životní cyklus
The Rous sarcoma virus has only 4 genes (bottom panel):
- gag, which encodes the capsid protein
- pol, which encodes the reverse transcriptase
- env, which encodes the envelope protein
- src, which encodes a tyrosine kinase, an enzyme that attaches phosphate groups to Tyr residues on a variety of host cell proteins.
In addition, each end of the RNA molecule has a set of repeated sequences of nucleotides ("R" and "P") that perform at least two important functions:
- they enable the DNA copies of RSV to insert into the host's DNA and
- they act as enhancers, causing the host nucleus to transcribe the RSV genes at a rapid rate.
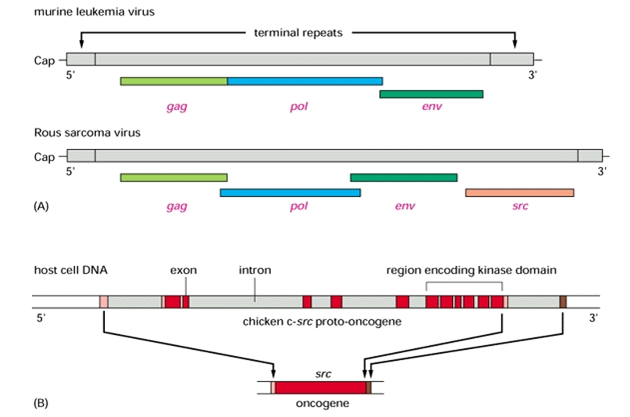
Obr. 3-2 Srovnání viru myší leukemie, viru Rousova sarkomu a inzerce c-src do hostitelské DNA
(zdroj: http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/R/RSV.html)
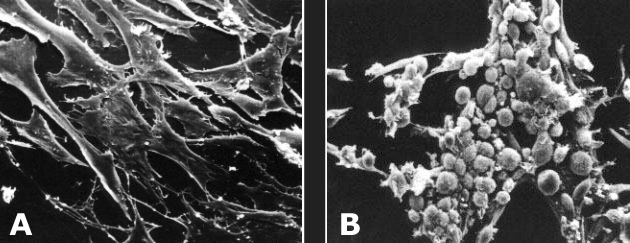
Obr. 3-3 Normální (a) a transformované (b) myší fibroblasty
(zdroj: http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/C/CancerCellsInCulture.html)
Protoonkogeny byly v průběhu evoluce dobře konzervovány a jejich přítomnost v normálních buňkách všech vyšších organismů předpokládá, že mají základní význam v buněčné fyziologii. Kódují proteiny, které hrají klíčovou úlohu na různých úrovních integrace mitogenních signálů nesených růstovými faktory a hormony a jsou zásadní v regulaci růstu, diferenciace a apoptózy normálních buněk. Jsou-li modifikovány, ať na strukturální nebo kontrolní úrovni, začnou se chovat jako onkogeny a podporují vývoj nádoru. Tak je mnoho onkogenů aktivovanými homology protoonkogenů, které existují v normálních buňkách. Uměle navozená mutace v onkogenu způsobuje deregulaci buněčného růstu, imortalizaci a transformaci in vitro a vývoj nádorů in vivo. Při vzniku nádorů u zvířat a u člověka se uplatňují stejné mechanizmy. Tak je možno transformovat lidskými onkogeny živočišné buňky a na nich testovat látky schopné inhibovat expresi nádorového fenotypu.
Protoonkogen lze tedy definovat jako normální buněčný gen zahrnutý v regulaci buněčné proliferace, diferenciace a apoptózy, který, je-li aktivován, může přispívat k vývoji malignity.
Jak se rozvíjelo porozumění cest přenosu (transdukce) signálů, bylo jasné, že tyto geny mohou zahrnovat abnormality na každém stupni tohoto procesu. Protoonkogen se stane transformovaným buď po změně v sekvenci nukleotidů, nebo změně jeho transkripce a exprese, takže buňka produkuje abnormální protein se změněnými biochemickými vlastnostmi či exprimuje abnormálně vysoké množství proteinu. K onkogenní aktivaci dochází většinou: bodovou mutací, chromozomální přestavbou nebo genovou amplifikací.
Protoonkogeny lze dělit
podle lokalizace jejich produktu na ty, které kódují (obr. 3-4):
- sekreční proteiny,
- proteiny buněčného povrchu,
- cytoplazmatické proteiny,
- jaderné proteiny;
podle funkce jejich produktů na (obr 3-5):
- růstové faktory,
- receptory pro růstové faktory,
- cytoplazmatické proteiny – protein kinázy a G-proteiny,
- jaderné proteiny.
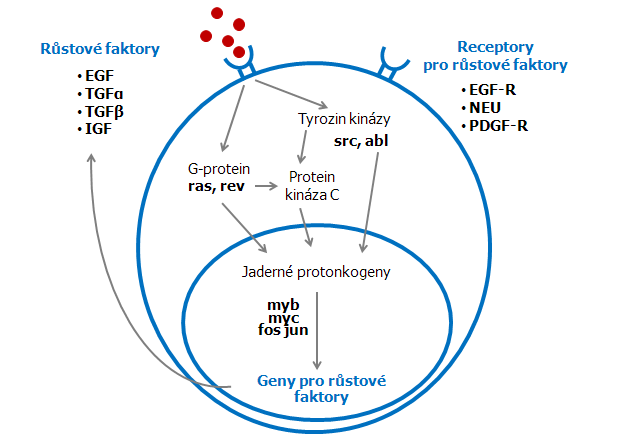
Obr. 3-4 Přenos signálů a růstová regulace v eukaryotických buňkách
Jsou znázorněny reprezentativní protoonkogeneny v signálních dráhách
(podle Miller D.M. et al., Amer J Med Sci 1990 : 59)
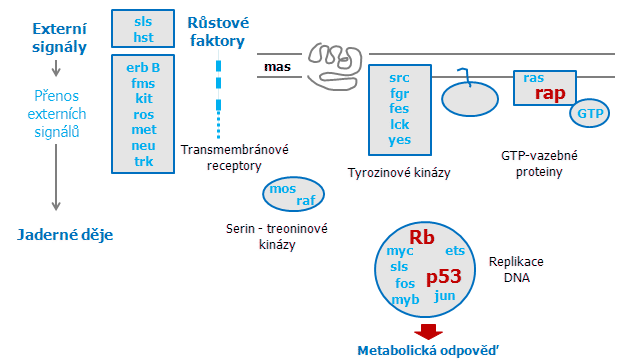
Obr. 3-5 Onkogeny a nádorově supresorové geny
Hlavní funkční skupiny onkogenních proteinů (bledě modrá) a jejich pravděpodobná vnitrobuněčná lokalizace. Nádorově supresorové geny jsou označeny červeně.
(podle Rey I. et al., Fundam Clin Pharmacol 1990 : 401)
Protoonkogeny regulují replikaci DNA a přenosy signálů přes své různé proteinové produkty. Známé produkty onko- a protoonkogenů spadají do několika funkčních skupin a jsou označovány třemi písmeny (příklady uvedeny v závorkách):
- růstové faktory (sis, hst),
- receptory pro růstové faktory (erb B, fms, kit) a tyrozin kinázy (src, fgr, fcs),
- na membránu vázané analogy proteinů vážících guanosin trifosfát – GTP (ras),
- cytoplazmatické serinové a treoninové kinázy (mil, mos, raf),
- jaderné proteiny fungující jako aktivátory transkripce (myb, myc, fos, jun).
Členové jednotlivých tříd vykazují zvýšenou expresi u řady lidských nádorů a tato exprese pak přispívá k řadě nádorových vlastností, jako jsou zvýšená buněčná proliferace, invaze a metastázy.
Růstová stimulace a inhibice
Mnoho protoonkogenů kóduje proteiny mající vztah k růstově stimulačním signálům přecházejících z vnějšího prostředí do nitra buňky. Růst buňky je deregulovaný, jestliže mutace v protoonkogenu způsobí trvalou aktivaci růstově stimulační dráhy. Toto souvisí se signály, které si navzájem předávají buňky v tkáních. Jedny buňky uvolňují růstové faktory, (glyko) proteiny, které se pohybují mezi buňkami a po vazbě na vhodný receptor na povrchu jiných buněk vyvolávají kaskádu dějů, které přenáší tento signál přes cytoplazmu až do jádra. V jádře pak proteiny nazývané transkripční faktory odpovídají tím, že aktivují řadu genů, které pomáhají buňce procházet buněčným cyklem. Podobně funguje i přenos růstově inhibičního signálu.
Stimulace buněk ve fázi G0 po působení růstových faktorů nebo hormonů vede ke vzrůstu vnitrobuněčného pH, volného Ca2+ a aktivaci řady proteinových kináz. Je to částečně výsledek rozkladu PIP2 (fosfoinositoldifosfát) a otevření kanálů Ca2+ indukované aktivitou tyrozinkinázy spjaté s receptorem. Pak dochází k velkému vzrůstu aktivity proteinových kináz závislých na cAMP. Výsledkem aktivace této kaskády je přechodná exprese (během několika minut) některých produktů jaderných protoonkogenů jako myc, fos a jun, které přímo ovlivňují transkripci.
Je známo, že vývoj a udržení jistých typů lidských nádorů jsou přísně závislé na přítomnosti specifických růstových faktorů. Jedna z protinádorových strategií tak sleduje identifikaci růstových faktorů a hledání jejich antagonistů. Např. buňky lidského melanomu exprimují „platelet-derived growth factor – like“ (PDGF) protein, který stimuluje inkorporaci 3H-tymidinu (ukazatel syntézy DNA) do lidských fibroblastů. Jiné tzv. „growth-like“ faktory s transformující aktivitou jsou např. epidermální růstový faktor (EGF), transformující růstový faktor (TFG) alfa, fibroblastový růstový faktor (FGF) atd.
Změny receptorů pro růstové faktory jsou jinou cestou aktivace onkogenů. Tak v-erb-B je změněná forma receptoru pro EGF a v-fms pro kolonie stimulující faktor (CSF-1). Asi polovina známých produktů onkogenů jsou proteinové kinázy.
Zmíněné geny mohou být aktivovány různým způsobem (obr. 3-6). Geny pro růstové faktory mohou být aktivovány buď mutacemi, které vyúsťují ve zvýšenou expresi nebo na sekreční úrovni. Receptory a cytoplazmatické signálně transdukční proteiny jsou většinou aktivovány strukturálními mutacemi, které dovolují vývoj růstové autonomie. K maligní transformaci je potřeba koordinovaná změna v řadě zásadních genů. Ačkoliv např. zvýšená exprese H-ras je schopná zvýšit buněčnou proliferaci, není tento gen sám schopen indukovat maligní transformaci.
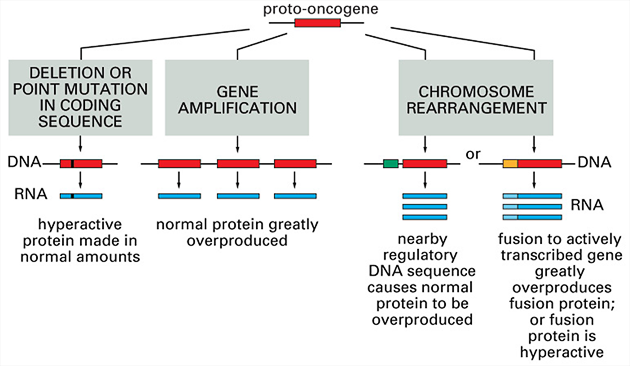
Obr. 3-6 Tři způsoby aktivace a změny protoonkogenu v onkogen
(Figure 23–27. Molecular Biology of the Cell, 4th Edition)
Po účinku polypeptidových růstových faktorů nebo steroidních hormonů dochází k expresi jaderných protoonkogenů jako jsou c-myc, c-fos, c-jun, c-myb. Jsou to tzv. geny rané odpovědi (immediate early genes) a jejich produkty jsou proteiny vážící se na DNA a fungující jako tzv. transkripční faktory, které regulují transkripci pozdních genů.
Jaderné protoonkogeny jsou většinou aktivovány zvýšenou expresí, která může být indukována různými způsoby: translokací (Burkittův lymfom), inzercí retroviru (spíše v experimentálních systémech) a amplifikací genů. Amplifikace – přítomnost více kopií genu – je obecným mechanizmem aktivace jaderných protoonkogenů a byla pozorována u řady nádorů. Přítomnost nebo absence amplifikace c-myc má např. prognostickou hodnotou u malých plicních nádorů. U neuroblastomu určuje amplifikace n-myc agresivitu maligního fenotypu.
Mutace protoonkogenu vedoucí k transformaci můžeme funkčně rozdělit do dvou tříd (obr. 3-7):
získání funkce (gain-of-function)
kde aktivita protoonkogenu vzrůstá a má za následek abnormální nebo nadměrnou růstovou stimulaci;ztráta funkce (loss-of-function)
která vede k inaktivaci represorové složky, která normálně negativně ovlivňuje buněčnou proliferaci (nádorově supresorové geny).
V obou případech je výsledkem nadměrná stimulace růstu. Produkty onkogenů pak přeměňují cestu mitogenního signálu tak, že udělí buňce konstitutivní růstový stimul.
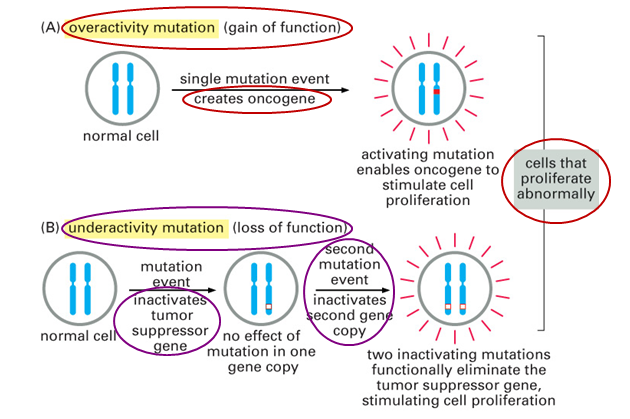
Obr. 3-7 Geny kritické pro vývoj nádorů spadají do dvou jasně rozlišitelných kategorií: dominantní a recesivní
(Figure 23–24. Molecular Biology of the Cell, 4th Edition.)
Nádorově supresorové geny
Buněčné dělení je stimulováno řadou signálů, jako jsou růstové faktory, hormony apod., ale je ovlivňováno i negativní regulací. Existuje řada genů, které působí proti funkci onkogenů a hrají úlohu v zástavě abnormální buněčné proliferace. Jsou to tzv. nádorově supresorové geny. Předpokládá se, že v některých případech je to právě ztráta funkce těchto genů, co způsobuje vývoj rakoviny, např. při vývoji retinoblastomu po ztrátě obou alel genu RB na 13 chromozómu. Produkt genu reguluje expresi specifických genů zahrnutých v mitogenezi (obr. 3-8).
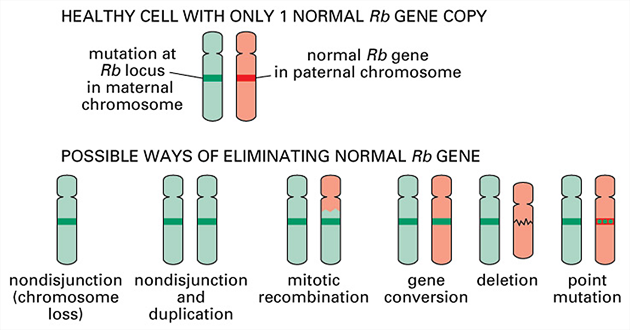
Obr. 3-8 Šest způsobů ztráty zbývající dobré kopie nádorově supresorového genu
(Figure 23–29. Molecular Biology of the Cell, 4th Edition)
Podobně jako růstové faktory podporují buněčný růst, na jeho útlumu se podílejí antiproliferačně působící molekuly, které představují významné téma zejména pro protinádorový výzkum. Např. TGF beta je z rodiny dimerických proteinů, které kontrolují růst a diferenciaci řady buněčných typů a mohou mít jak růstově podpůrnou, tak růstově inhibiční funkci v závislosti na buněčném typu a podmínkách. TGF beta stimuluje proliferaci buněk mesenchymálního původu indukcí exprese c-sis protoonkogenu, který kóduje PDGF-like protein. Naopak inhibuje proliferaci buněk epiteliálního původu, endoteliálních buněk, B lymfocytů a tymocytů a u řady buněčných typů indukuje diferenciaci. U endoteliálních buněk ovlivněných TGF beta je redukována exprese EGF receptoru s vysokou afinitou a tak buňka není schopna odpovídat na mitogenní signál EGF. Zatímco buňky retiny jsou normálně citlivé k antimitogennímu působení TGF beta, buňky nádoru (retinoblastomu) neexprimují receptory pro TGF beta a tak unikají negativní kontrole. Dalším endogenními antiproliferačním proteinem je např. interferon (IFN) gamma.
Význam pro terapii
Studie různých protoonkogenů ukazují, jak různé genetické změny mohou vyústit v expresi aberantních růstových signálů nebo, v případě nádorově supresorových genů, v utlumení růstově inhibičních signálů (obr. 3-9).
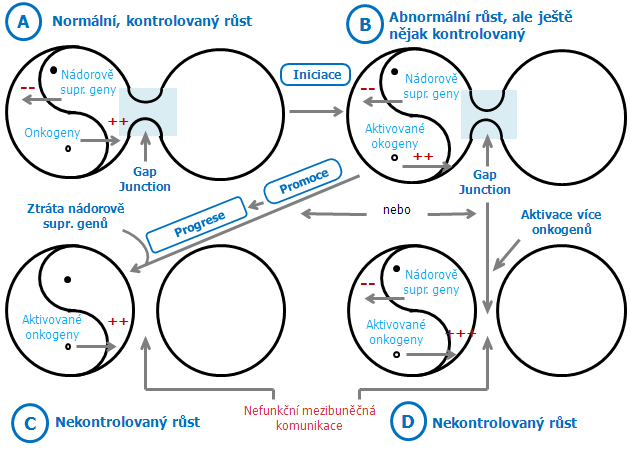
Obr. 3-9 Proces vzniku nekontrolovaného růstu buňky
Jak jsou objasňovány molekulární mechanizmy přenosu signálů mezi mimobuněčnými a vnitrobuněčnými doménami receptorů, děje obsazení receptoru související s produkcí raných růstových signálů a cesty, kterými tyto signály indukují expresi regulačních genů, je jasné, že může být změněn každý krok v kaskádě proliferačního signálu a může přispět k expresi transformovaného fenotypu. Proto také každý krok představuje možný cíl terapeutického působení. Nádorově supresorové geny představují zvláště slibný přístup k obnovení normální kontroly buněčné proliferace. Cílem budoucí chemoterapie je udržet expresi těchto genů nebo nahradit jejich defektní funkci.
Kontrolní otázky k tématu
Co jsou to protoonkogeny a jak z nich vznikají onkogeny?
Jak fungují nádorově supresorové geny?
Jaké odvětví výzkumu přispělo k objevu onkogenů?
Co jsou to retroviry?
Dle jakých kritérií dělíme protoonkogeny?
Jaká je funkce jaderných protoonkogenů?
Jakými mechanizsmy mohou být protoonkogeny aktivovány na onkogeny?
Jaké základní mutace protoonkogenů rozeznáváme a co je jejich výsledkem?
Jakým způsobem může dojít ke ztrátě funkce nádorově supresorového genu?
Jaké jsou v souhrnu hlavní poznatky o molekulárně genetické podstatě nádorového onemocnění?
ÚEB Biol, Přírodovědecká fakulta, Masarykova univerzita |
Návrat na úvodní stránku webu, přístupnost |
| Servisní středisko pro e-learning na MU
| Fakulta informatiky Masarykovy univerzity, 2012–2013
Centrum interaktivních a multimediálních studijních opor pro inovaci výuky a efektivní učení | CZ.1.07/2.2.00/28.0041

