Přírodovědecká fakulta Masarykovy univerzity
prof. RNDr. Jiřina Hofmanová, CSc.
Epigenetické změny v karcinogenezi
Jako epigenetické jsou označovány dědičné změny v genové expresi beze změn v sekvenci DNA. Zahrnují zejména metylaci DNA a acetylaci histonů.
Metylace DNA
Savčí buňky mají schopnost epigeneticky modifikovat svůj genom prostřednictvím kovalentního přidávání metylových skupin do 5 pozice na cytosinovém kruhu v CpG dinukleotidu za účasti enzymu metyltranferázy. Epigenetické změny hrají významnou úlohu v karcinogenezi.
Přibližně 70 % CpG zbytků v savčím genomu je metylováno. Distribuce je ale nerovnoměrná a většina genomu je chudá na CpG. Ty jsou nahromaděny buď v rozsáhlých repetitivních sekvencích (satelity, centromerické repetice) nebo v krátkých úsecích (asi 1 kb) bohatých na CG, tzv. „CpG islands“ (obr. 4-1). Tyto ostrůvky se vyskytují především v promotorových úsecích genů, blízko místa startu transkripce). Tyto úseky jsou normálně nemetylované a tak je umožněna transkripce genů za přítomnosti příslušného transkripčního faktoru. Repetitivní genomické sekvence roztroušené mezi zbytkem genomu jsou naopak silně metylovány a hrají asi roli ve vývoji nekódujících oblastí DNA a v utlumení endoparazitických a retrovirových transpozónů.
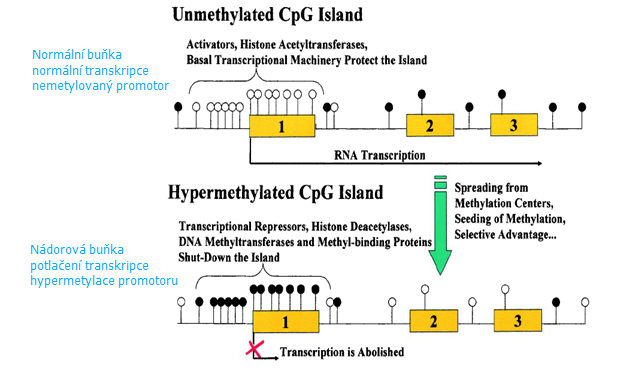
Obr. 4-1 Typické CpG ostrůvky nádorově supresorového genu v normální a nádorové buňce
Metylace cytosinových zbytků je spojena s navázáním specifických proteinů („methyl-binding domain proteins“), aktivací histon deacetyláz (HDAC) a histon metyltransferáz, modifikací histonů, kondenzací chromatinu a transkripční inaktivací příslušného genu.
Souhra metylace ostrůvků CpG pomocí metylačních a demetylačních enzymů je jednou z částí epigenetické kontroly zárodečné a tkáňově specifické genové exprese.
Metylace DNA hraje zásadní úlohu v normálním vývoji, v inaktivaci chromozómu X a supresi tzv. parazitických sekvencí DNA. Je nástrojem, který umožňuje zapínat a vypínat geny na správném místě a ve správné době. Metylace DNA však může také způsobit zvýšení mutací a dědičně tlumí geny, jejichž promotory jsou asociovány s ostrůvky CpG a které kontrolují buněčnou proliferaci. Zatím neznámé mechanizmy zabraňují de novo metylaci těchto promotorů u normálních buněk.
Vědecké studie odhalily spojitost mezi metylací DNA a genovou expresí. Využívá se k tomu inhibitoru metylace 5-azacytidinu. Působení na řadu buněčných linií ukázalo, že mnoho genů může být reaktivováno, např. metylačně specifická PCR. Primery rozlišují metylovanou a nemetylovanou DNA v nádorových biopsiích nebo tekutině. Další metodou je v současnosti imunoprecipitace purifikované metylované DNA, umožňující detekovat metylační profil DNA celého genomu (DNA methylom).
Hypo- nebo hypermetylace DNA (obsah 5-metylcytosinu) patří mezi negenotoxické mechanizmy karcinogeneze. Způsobuje epigenetické změny, tj. změny exprese normálních genů (včetně nádorově supresorových genů) (obr. 4-2). Detailní studie účinků metylace DNA na promoční aktivitu odhalilo, že metylace DNA je účinným supresorem genové aktivity zejména nádorově supresorových genů. Klíčovým mechanizmem je aberantní metylace DNA v promotorové oblasti.
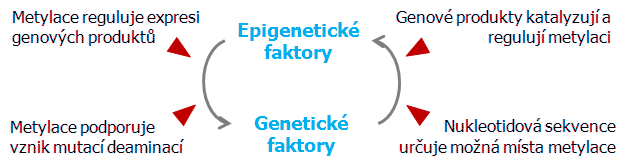
Obr. 4-2 Interakce genetických a epigenetických faktorů
Více než 30 let je známo, že metylační struktura v nádorových buňkách se liší od normálních buněk. Globální hypometylace genomu je doprovázena místně specifickou hypermetylací, jejímiž cílovými místy jsou ostrůvky CpG. Hypermetylace promotorů pro nádorově supresorové geny v těchto ostrůvcích CpG je doprovázena jejich utlumením a růstovou výhodou pro tyto buňky (obr. 4-3). Řada důkazů podporuje příčinnou roli metylace DNA v karcinogenezi. Redukovaná metylace DNA tlumí tvorbu střevních polypů u tzv. Apcmin/+ myší. U jednostranného retinoblastomu byla prokázána metylace promotorového úseku genu Rb. Studie sporadických případů kolorektálních karcinomů vykazujících nestabilitu mikrosatelitů ukazují vysokou frekvenci hypermetylace promotoru genu pro tzv. „mismatch repair“ (MMR). Působení inhibitoru metylace může funkci tohoto genu obnovit. Existují příklady toho, že jedna kopie nádorově supresorového genu je divokého typu, ale je tlumena hypermetylací, zatímco druhá kopie je nebo není mutovaná.
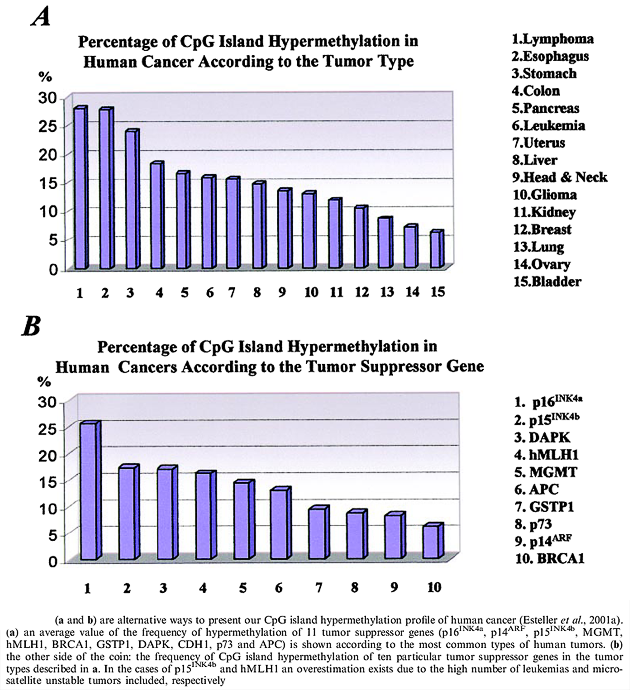
Obr. 4-3 Procento hypermetylace CpG 11 nádorově supresorových genů:
(A) u různých typů lidských nádorů
(B) u 10 různých nádorově supresorových genů
(Esteller M., Cancer Res 2001 : 3225)
Metylace DNA může též usnadňovat mutagenezi, protože 5MeC může spontánně deaminovat na tymin (hypermutabilita). Hypometylace DNA je spojena se zvýšenou genovou expresí (např. zvýšená exprese mutovaného H-ras je spojena s nádorovou transformací). CpG místa v oblastech kódujících p53 jsou u všech studovaných lidských tkáních metylována a přispívají asi k 50 % všech inaktivujících mutací u nádorů kolonu a 25 % u nádorů obecně. Výzkum metylace DNA umožňuje odhalovat změny v expresi genů, buněčné proliferaci, mutacích, chromatinových aberacích i inaktivace nádorově supresorových genů a uvádět je do souvislosti s procesem karcinogeneze (obr. 4-4).
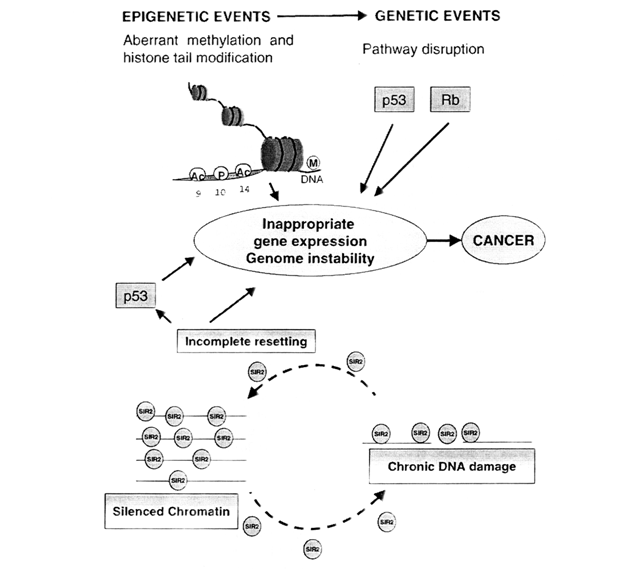
Obr. 4-4 Aberantní epigenetické a genetické děje mohou vést prostřednictvím nesprávné genové exprese k tvorbě nádorů
(Neumeister P. at al., Int J Biochem & Cell Biol 2002 : 1475)
Acetylace histonů
Genová exprese je regulována i strukturou chromatinu. Histony jsou typem proteinů, které fungují jako „překladatelé“ mezi genotypem a fenotypem a mají dynamickou funkci v regulaci struktury chromatinu a genové aktivity. Mohou být modifikovány acetylací, metylací, fosforylací, ubiquitinací. Specifická modifikace konců histonů enzymy histontransferázami je přímo spojena s aktivní nebo utlumenou transkripcí.
Chromatin obsahující hypoacetylované lysiny v histonech má kompaktní strukturu represivní pro transkripci. Řada látek fungujících jako inhibitory histonových deacetyláz (HDAC) může vytvářet otevřené struktury chromatinu a aktivovat určité geny inhibující nádorový růst, což lze využit i v terapii (butyrát, trichostatin). Histony se podílejí na tvorbě a udržování tzv. „epigenetické paměti“.
Existuje významné propojení („crosstalk“) mezi metylací DNA a acetylací histonů při aktivaci i tlumení genové exprese. 5-azacytidin a inhibitory HDAC způsobují v kombinaci reaktivaci nádorově supresorových genů (obr. 4-5 a 4-6).

Obr. 4-5 Některé známé změny DNA a chromatinu v nádorových buňkách
(J. Lopez et al. Br J Cancer 2009 : 571)

Obr. 4-6 Utlumení genové exprese aberantní metylací DNA a modifikací histonů
(Momparler R. L., Oncogene 2003 : 6479)
Micro RNAs
Důležitou součástí epigenetické regulace jsou také tzv. malé regulační RNA – mikroRNA (miRNA) (obr. 4-7). V tzv. RISC komplexu se miRNA vážou na částečně komplementární cílová místa genů a mohou řídit buď translační inhibici, nebo degradaci mRNA. Tato represe prostřednictvím miRNA je další cestou jak může byt modulována genová exprese (obr. 4-8).
miRNAs jsou deregulovány u řady nádorových typů a mohou fungovat jako nádorové supresory. Hypermetylace ostrůvků CpG spojených se specifickými miRNAs může být jedním z mechanizmů, kterým může být miRNA selektivně snížena. V případě, že je miRNA situována v kódující oblasti genu, metylace může zároveň tlumit expresi jak genu kódujícího protein, tak příslušné miRNA.
Kontrolní otázky k tématu
Co rozumíte pod pojmem negenotoxické změny?
Jakými mechanizmy fungují tzv. nádorové promotory? Uveď příklady takovýchto látek či faktorů.
V čem spočívá teorie kmenových buněk ve vztahu ke karcinogenezi?
Čím jsou charakterizovány epigenetické změny?
Které základní epigenetické mechanizmy hrají úlohu v nádorovém onemocnění?
Jak a kde probíhá (de)metylace DNA a jaký je její význam?
Jak jsou s ohledem na metylaci charakterizované nádory?
Jakou funkci mají v buňkách histony?
Jaký je význam acetylace histonů u nádorových buněk a jak ji lze modifikovat?
Jakou roli hrají v buňkách mikroRNA a jaká je jejich funkce v rozvoji nádorového onemocnění?
ÚEB Biol, Přírodovědecká fakulta, Masarykova univerzita |
Návrat na úvodní stránku webu, přístupnost |
| Servisní středisko pro e-learning na MU
| Fakulta informatiky Masarykovy univerzity, 2012–2013
Centrum interaktivních a multimediálních studijních opor pro inovaci výuky a efektivní učení | CZ.1.07/2.2.00/28.0041



