Rozmnožování rostlin a jeho genetické důsledky
Způsoby rozmnožování rostlin
Pro zachování jakéhokoli rostlinného organizmu je nutné střídání generací, které je umožněno rozmnožováním (obr. 4.1). U rostlin rozeznáváme tři základní způsoby rozmnožování:
- nepohlavní, amixie (amixis),
- pohlavní, amfimixie (amfimixis),
- apomiktické, apomixie (apomixis).
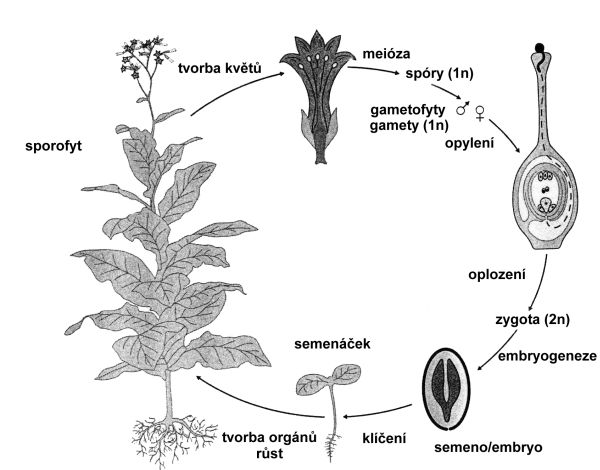
Obr. 4.1 Schéma životního cyklu dvouděložné rostliny Nicotiana tabacum.
(Zdroj: Westhoff et al., 1998)
Amixis
Amiktické, nepohlavní rozmnožování je nejprimitivnějším způsobem rozmnožování, při němž není organizmus schopen pohlavní diferenciace. Tento způsob rozmnožování je typický pro nejnižší organizmy, u vyšších rostlin se však může vyskytovat souběžně s rozmnožováním generativním (pohlavním).
Při nepohlavním rozmnožování vzniká jedna rostlina z jednoho rozmnožovacího základu, a to buď z rozmnožovací buňky, nebo ze složitější části mateřského těla. Po oddělení od mateřské rostliny vyrůstají z tohoto rozmnožovacího základu přímo noví samostatní jedinci, kteří vznikli pouze mitotickým dělením buněk. U rostlin se tento způsob rozmnožování nazývá vegetativní. Velká regenerační schopnost rostlin, kdy oddělená část vytváří za vhodných podmínek postupně všechny orgány, byla pozorována a využívána už dávno. Z genetického hlediska je zajímavé, že tato regenerační schopnost je často zachována i u vysoce specializovaných orgánů, jako např. u listů. Mnoho rostlin vytváří speciálně diferencované orgány, které částečně nebo zcela slouží k nepohlavnímu rozmnožování. Jsou to např. kořenové hlízy (Dahlia variabilis, Ipomea batata, Ficaria verna), oddenky jako metamorfózy stonku (Convalaria, Agropyron, Agrostis), stonkové hlízy oddenkové (Solanum tuberosum, Helianthus tuberosus) a bazální (Gladiolus, Colchicum, Crocus, Cyclamen), cibule a cibulky jako metamorfózy listů (Allium cepa, Lilium) aj.
Vegetativní potomstvo jedné rostliny se nazývá klon. Klon jako základní jednotku amikticky se množících rostlin můžeme definovat jako genotypově shodné jedince, kteří vznikli vegetativně z jediného původního organizmu. Vegetativní cestou tedy můžeme získat velké množství geneticky identických rostlin nehledě na genetickou konstituci výchozí formy.
Stálost klonů však není absolutní. Nezřídka dochází ke genotypovým a fenotypovým změnám, jež jsou výsledkem spontánní mutace v určitém sektoru pletiva nebo v určité buňce. Tyto změny byly již Darwinem označeny jako pupenové variace neboli sporty. Vznikají tedy somatickou mutací (spontánně či indukovaně) v jedné nebo více iniciálách pupenu. Výhon, který se vyvíjí z takového pupenu, ponese mutantní znak pouze pokud byl příslušný gen heterozygotní. Fakta o pupenových variacích, jak se s nimi setkávali praktičtí šlechtitelé v minulosti, shrnul poprvé velmi podrobně právě Darwin, který zdůrazňoval, že pupenové variace nejsou zvláštním znakem některých rostlinných forem, nýbrž jsou vlastní nejrůznějším představitelům kulturních i planých forem druhů. Dnes známe mnoho odrůd ovocných stromů, okrasných rostlin a zelenin, které vznikly cestou pupenových variací. Jsou to především stovky odrůd chryzantém, růží a brambor a většina odrůd citrusových stromů. Tyto somatické mutace se mohou týkat znaků a vlastností morfologických (tvar, barva, velikost orgánů apod.) i fyziologických (ranost, rezistence k chorobám a škůdcům, obsah určitých látek apod.).
Velké regenerační schopnosti rostlin se využívá v širokém měřítku v zemědělské praxi a v zahradnictví. Takto nepohlavně lze množit vysoce heterozygotní odrůdy, které by se při rozmnožování pohlavní cestou rozpadly na množství různých genotypů. Týká se to především ovocných dřevin a růží, u kterých se uplatňuje technika roubování nebo očkování. V podstatě jde o transplantaci větší části rostliny s několika pupeny (roub) nebo pouze jednoho pupenu (očko) na vhodnou podnož. Vegetativně se množí také okrasné stromy a keře, chmel, cukrová třtina, brambory, cibule, česnek, jahodník a mnohé rostliny okrasné květem.
Vegetativní rozmnožování se ve šlechtitelské praxi používá jako následná metoda pohlavního rozmnožování k udržení heterozygotnosti a hybridní zdatnosti. Někdy může sloužit i ke zvýšení podílu rostlin jednoho pohlaví v populacích (jako např. namnožení samčích rostlin u palmy datlové) nebo k udržení autoinkompatibilních rostlin (avokádo). Vegetativní rozmnožování je možné využít k získání klonů bez patogenů technikou explantátových kultur in vitro (např. meristémové kultury a embryokultury).
Předností nepohlavního rozmnožování vzhledem k zachování druhu je tedy potenciálně neomezená možnost zvýšení početnosti geneticky identických potomků jednoho jedince, tj. vytvoření tzv. klonu.
Amfimixis
Amfimixie je pohlavní rozmnožování, které představuje evolučně progresivnější reprodukci potomstva. Jeho předností je zajištění genetické rozmanitosti zabezpečující přizpůsobení organizmů vnějšímu prostředí.
Pro tento způsob rozmnožování je typická tvorba diferencovaných reprodukčních orgánů a střídání pohlavní haploidní generace (gametofytu), produkující gamety, s nepohlavní diploidní generací (sporofytem). U nižších rostlin převažuje fáze gametofytu nad sporofytem, zatímco u vyšších rostlin je tomu naopak.
U krytosemenných rostlin jsou generativní orgány součástí specifické části rostliny – květu. Samičím pohlavním orgánem je pestík (pistillum) vznikající srůstem jednoho nebo více plodolistů (megasporofylů). Pestík je obvykle rozlišen na semeník (ovarium), čnělku (stylus) a bliznu (stigma).
Makrosporogeneze a makrogametogeneze
Uvnitř semeníku se vyvíjí vajíčko (nebo vajíčka). Základem pro vznik samičího gametofytu je diploidní tzv. archesporová buňka, ze které vznikne dělením mateřská buňka megaspory. Redukčním dělením vzniká v procesu megasporogeneze samičí výtrus (megaspora neboli primární zárodečný vak). V dalším procesu se megaspora přetváří na zralý zárodečný vak se samičí pohlavní buňkou (oosférou). Vznik samičí gamety se označuje jako megagametogeneze. V zárodečném vaku se vyvíjí kromě vaječné buňky ještě dvě pomocné buňky (synergidy), které s ní společně tvoří tzv. vaječný aparát. Proti nim se formují tři buňky, tzv. protistojné (antipody). Uvnitř zárodečného vaku se nachází ještě centrální jádro zárodečného vaku (obr. 4.2).
Dlouho chyběla molekulární analýza samičího gametofytu. Hlavním důvodem byly problémy se získáním proteinů v dostatečné koncentraci. Možnost řešit tento problém umožnila metoda RT-PCR (amplifikace vycházející z cDNA po reverzní transkripci mRNA). Pro tuto metodu je dostatečné malé množství výchozího materiálu (RNA) a je proto vhodná pro analýzu samičího gametofytu a objasnění funkcí specifických genových produktů. Důležitá zjištění byla uskutečněna i pomocí květních mutantů, které se vyznačují samičí sterilitou. Do této skupiny patří řada mutantů A. thaliana s defekty ve vývoji integumentů, vajíček nebo embryonálního vaku: sin1 (short integuments-1), ovm2, ovm3 (ovule mutant-2, ovule mutant-3), bel1 (bel1), ats (aberrant testa shape). Další mutací s defektním vývojem vajíčka u A. thaliana je ant (aintegumenta). Gen ANT byl klonován. Produkt genu vykazuje vysokou sekvenční shodu s produktem genu AP2 v tzv. AP2 doméně. To naznačuje, že oba proteiny jsou příbuzné transkripční faktory. Všechny výše uvedené mutace jsou sporofytické. Vzácně existují i gametofytické mutace, např. u kukuřice ig (indeterminate gametophyte) a u huseníčku gf.
Mikrosporogeneze a mikrogametogeneze
Samčím pohlavním orgánem v květu je tyčinka (mikrosporofyl) tvořená nitkou (filamentum) a prašníkem (anthera). Prašník se skládá ze dvou prašných váčků, z nichž každý obsahuje dvě prašná pouzdra. Uvnitř prašných pouzder vznikají ze sporogenních buněk mitotickým dělením pylové mateřské buňky. V nich pak redukčním dělením vznikají v procesu mikrosporogeneze čtyři haploidní mikrospory (pylová zrna). Pylové zrno se ještě před opuštěním prašného pouzdra mitoticky dělí na malou buňku rozmnožovací (generativní) a větší buňku láčkovou (vegetativní), takže pylové zrno je pak dvoubuněčné. Generativní buňka se ještě jednou dělí na dvě spermatické buňky (samčí gamety). Tento vznik samčích pohlavních buněk je označován jako mikrogametogeneze (obr. 4.2).
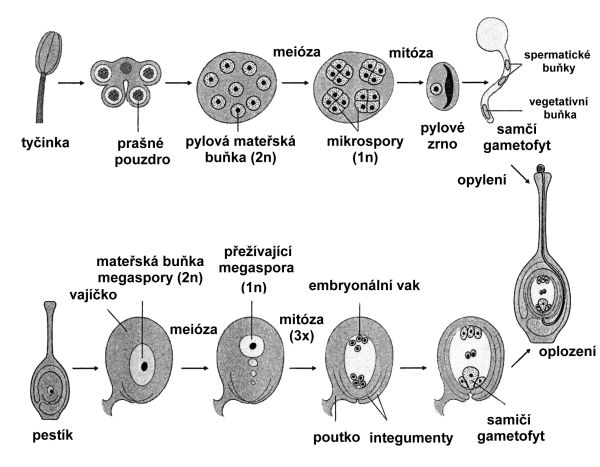
Obr. 4.2 Schéma tvorby samčích a samičích spor a gamet.
(Zdroj: Westhoff et al., 1998)
Mikrospory a pyl jsou pro svůj haploidní stav, relativní jednoduchost a vývojovou synchronizaci vhodným systémem pro výzkum molekulárních mechanizmů spojených s vývojem a diferenciací buněk. Při výzkumu buněčné specifičnosti genové exprese se v první fázi obvykle připraví knihovna cDNA z mikrospor nebo zralého pylu a klony, které nehybridizují s cDNA somatických orgánů, jsou považovány za specifické pro příslušné buňky.
K vývoji mikrospor je třeba koordinovaná genová exprese jak v těchto buňkách, tak v pletivech sporofytu, které je obklopují. Podle toho lze geny rozdělit do tří skupin:
- geny, které se transkribují jen ve sporofytických pletivech,
- geny, které se transkribují jak ve sporofytických pletivech, tak v mikrosporách a pylu,
- mikrosporově nebo pylově specifické geny.
Podle načasování aktivace jednotlivých genů je lze rozdělit na časné a pozdní. Časné geny se transkribují po skončení meiózy a většinou kódují cytoskeletární proteiny a proteiny potřebné pro syntézu buněčné stěny nebo ukládání škrobu. Pozdní geny jsou aktivovány po skončení mikrosporové mitózy a jejich mRNA dosahuje maxima ve zralém pylu. Obvykle kódují bílkoviny potřebné pro zrání pylu a růst pylové láčky.
K časným genům patří klon I3 cDNA izolovaný z nezralých prašníků Brassica napus. Transkript tohoto genu se akumuluje v období mikrosporové mitózy a poté jeho množství klesá. V nezralých prašnících B. napus byl dále identifikován gen BA42. Transkripty tohoto genu byly nalezeny jak ve vyvíjejících se mikrosporách, tak v buňkách tapeta a periferních buňkách cévního svazku. Nebyly však identifikovány ve zralém pylu. Tento gen má 64 až 67 % homologii s chalkonsyntázou, která se účastní biosyntézy flavonoidů.
Mezi geny, které se transkribují v buňkách tapeta v období po mikrosporové mitóze a jejichž produkty byly nalezeny na povrchu pylových zrn, patří geny pro oleoziny. U B. napus bylo identifikováno několik forem oleozinů o různých molekulových hmotnostech. Jednotlivé formy jsou kódovány rozdílnými transkripty jednoho genu. Jejich exprese začíná v buňkách tapeta ve stadiu pozdních mikrospor, zvyšuje se ve fázi dvoujaderného pylu a klesá po pylové mitóze, kdy začíná dehydratace prašníků a tapetum degeneruje.
U tabáku byl identifikován jeden gen NTM19, který je transkribován specificky v mikrosporách. Gen je aktivní ve stadiu tetrád, jeho transkripty se tvoří v mikrosporách a po mikrosporové mitóze jeho aktivita mizí. Transkripty byly identifikovány pouze v mikrosporách a nebyly nalezeny ve sporofytických pletivech prašníku. U B. napus byl identifikován gen Bp4, který se exprimuje v raných stadiích vývoje mikrospor a jehož transkripty se nehromadí ve zralém pylu.
Genetickou analýzu samčího gametofytu umožňuje řada mutantů s jadernou samčí sterilitou vyznačujících se defekty ve vývoji tyčinek, ale standardních ve vývoji plodolistů. V rámci této skupiny mutantů je možné další rozlišení podle typu defektu. U A. thaliana byly nalezeny mutace s defekty v procesu mikrosporogeneze, např. ms a mutace s defekty v uvolňování pylu msH nebo ve funkci pylu, mutace pop.
Jde většinou o sporofytické mutace, což znamená, že heterozygoti Ms ms tvoří normální pyl. Pouze v ojedinělých případech byly získány gametofytické mutace. U nich tvoří heterozygoti 50 % funkčního pylu.
Oplození krytosemenných rostlin
Po opylení, tj. přenosu pylu z prašníku na bliznu, dochází k oplození. Pro všechny krytosemenné rostliny je charakteristické dvojité oplození, které spočívá v tom, že jedna spermatická buňka splyne s vaječnou buňkou a druhá spermatická buňka splyne s centrálním jádrem zárodečného vaku. Po splynutí buněk (plazmogamii) následuje splynutí jejich jader (karyogamie). Celý tento proces se nazývá syngamie. Z oplozené vaječné buňky vzniká diploidní zygota a z oplozené centrální buňky zárodečného vaku se vyvíjí endosperm (nejčastěji triploidní).
Celý proces vývoje samčího a samičího gametofytu a oplození u krytosemenných rostlin je znázorněn na obr 2.
Apomixis
Apomiktický způsob rozmnožování je považován za fylogeneticky nejmladší, odvozený od pohlavního rozmnožování. Apomixie je nepohlavní způsob rozmnožování semeny, při kterém nový jedinec vzniká bez splynutí samčích a samičích gamet (tj. bez syngamie) a nevyvíjí se tedy ze zygoty. Je to komplexní znak vyplývající z několika modifikací pohlavního cyklu rostlin.
Začátkem minulého století se chápala apomixie v širším smyslu. Např. Winkler pod tento pojem zahrnoval viviparii a ostatní formy vegetativního rozmnožování. Tato široce chápaná definice se dnes již nepoužívá. V současné době se vegetativní rozmnožování do tohoto pojmu nezahrnuje. Základní výzkum vzniku, rozšíření a klasifikace apomixie spadá do poloviny 40. let našeho století. Zasloužil se o to především švédský botanik Gustafsson a později v 60. letech indický vědec Battaglia.
Apomixis v užším slova smyslu tedy chápeme jako nepohlavní způsob rozmnožování semeny (agamospermie), pro který jsou typické následující odchylky v porovnání s pohlavním rozmnožováním:
- modifikace nebo úplné vynechání meiózy,
- tvorba neredukovaných megaspór,
- partenogenetický vývoj embrya,
- autonomní (nezávislý na opylení) nebo pseudogamní (závislý na opylení) vývoj endospermu.
V důsledku uvedených odchylek se vytvářejí embrya (a potomstvo), která jsou přesnou genetickou kopií mateřské rostliny.
Apomixie zahrnuje dva typy reprodukce:
- gametofytickou apomixii a
- adventivní embryonii (sporofytickou apomixii).
Gametofytická apomixie
Tento způsob apomixe předpokládá pozměněnou megasporogenezi, při které nedochází k redukci počtu chromozomů, tzn., že vzniklý primární zárodečný vak (megaspora) a z něho odvozený zralý zárodečný vak (samičí gametofyt) nemá redukovaný počet chromozomů. Dalším předpokladem úspěšné apomixie je schopnost neoplozené vaječné buňky (s neredukovaným počtem chromozomů 2n) vytvářet embryo. Tato schopnost se nazývá (diploidní) partenogeneze. Oba procesy jsou pod nezávislou genetickou kontrolou a jsou determinované pravděpodobně polygenně.
Vedle diploidní partenogeneze se někdy do apomixie zahrnuje i haploidní partenogeneze, kdy se haploidní zárodek tvoří z neoplozené vaječné buňky (gynogeneze) nebo mikrospory (androgeneze).
Podle původu a způsobu vzniku zárodečného vaku a odchylek v megagametogenezi se rozlišují dva typy gametofytické apomixie:
- diplosporie a
- aposporie.
Pro diplosporii je typický vznik neredukovaného zárodečného vaku z buňky samičího archesporia (obr. 4.3). Pro tento typ apomixie se užívá synonym mitotická, somatická, přímá diplosporie, generativní aposporie aj. Embryonální vak se vytváří z neredukované megaspory nebo mateřské buňky megaspory. Embryo se vyvíjí partenogeneticky. Endosperm se vyvíjí autonomně z neredukovaných centrálních jader také bez oplození (Compositae). Může mít proměnlivou úroveň ploidie. U rodů Ergastosis a Tripsacum je pro tvorbu endospermu nezbytné opylení (tzv. pseudogamie). Meiotická diplosporie se vyskytuje u rodů Arabis, Paspalum, Taraxacum, Ixerix a zástupců některých rodů Compositae. Mitotická diplosporie byla zjištěna u rodu Antennaria.
U polyploidních druhů Allium nutans (2n = 40), A. odoratum (2n = 32) a A. tuberosum (2n = 32) je diplosporie typu Allium. U těchto druhů dochází k premeotickému zdvojení chromozomů endomitózou. Vznikají dva identické chromozomy, oba se dvěma chromatidami. Během následující meiózy se párují sesterské chromozomy a tvoří autobivalenty. Vzniká tetráda jader rodičovského genotypu.
Při aposporii (někdy též somatické aposporii) vzniká neredukovaný zárodečný vak z některé jiné somatické buňky nucelu, než ze které vzniká archesporová buňka (obr. 4.3). Aposporie i amfimixie mohou probíhat v jednom vajíčku. Při vývoji aposporních zárodečných vaků dochází k řadě morfologických odchylek v uspořádání a polaritě, které slouží jako kritérium pro klasifikaci jednotlivých typů (typy: Hieracium, Poa, Panicum, Andropogon). U typu Hieracium se tvoří neredukovaný 8 jaderný bipolární embryonální vak. Embryonální vak typu Panicum je zpravidla neredukovaný 4 jaderný monopolární. Pro vývoj endospermu je u většiny druhů s výjimkou Hieracium spp. nezbytné opylení. Aposporie je častým apomiktickým mechanizmem u řady druhů trav patřících k rodům Pennisetum, Poa, Paspalum a Cenchrus.
Adventivní embryonie
Embrya a nové sporofyty vznikají ze somatických pletiv vajíčka (obr. 4.3), nejčastěji z nucelu nebo integumentů (nucelární nebo integumentální embryonie). Na tvorbě adventivních embryí se tedy podílejí diploidní buňky, které bezprostředně sousedí se zárodečným vakem. Tyto buňky prorůstají do zárodečného vaku, kde se z nich vyvíjí embryo. Přitom může vznikat v zárodečném vaku pohlavním i nepohlavním způsobem embryo z vaječné buňky. Vznik více embryí v jednom zárodečném vaku se nazývá polyembryonie.
Jednotlivé typy apomixie jsou schematicky znázorněny na obr. 4.3.
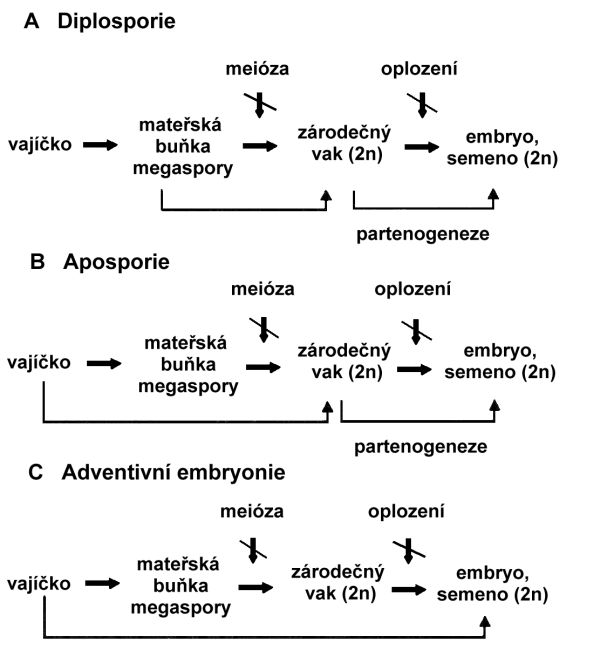
Obr. 4.3 Jednotlivé typy apomixie
Příčiny vzniku apomixie
I když bylo vysloveno mnoho teorií o příčinách vzniku apomixie, je dnes všeobecně uznávaná koncepce dědičné determinace apomixe. K dispozici je však dosud málo experimentálních údajů o typu dědičnosti, počtu genů a jejich vztazích. Pozornost se soustřeďuje na objasnění genetické determinace jednotlivých složek apomixie. Klíčovými mechanizmy apomixie je modifikace nebo vynechání samičí meiózy a podpoření autonomního vývoje embrya ve vajíčku. Nejčastěji jsou uváděny tyto odchylky vedoucí k apomixii:
- Vynechání heterotypického meiotického dělení, jehož důsledkem je neredukovaný počet chromozomů a vznik neredukovaných diplosporních nebo aposporních zárodečných vaků.
- Vynechání heterotypického meiotického dělení, jehož důsledkem je neredukovaný počet chromozomů a vznik neredukovaných diplosporních nebo aposporních zárodečných vaků.
- Schopnost genotypů vytvářet diplosporní nebo aposporní zárodečné vaky.
- Schopnost neoplozených vajíček k autonomnímu vývoji (partenogenezi).
- Neschopnost neredukovaných vaječných buněk k oplození.
- Schopnost somatických buněk nucelu a integumentů pronikat do zárodečného vaku a vytvořit adventivní zárodky (polyembryonie).
- Na opylení nezávislá schopnost polárních jader nebo sekundárního jádra zárodečného vaku k autonomnímu vývoji endospermu.
Huseníček a rýže se staly hlavními rostlinnými objekty při izolaci odpovídajících genů podmiňujících jednotlivé procesy vedoucí k apomixii, a to především prostřednictvím mutageneze a získání apomiktických mutantů. K objasnění genetiky apomixie přispělo studium populací hybridů získaných křížením Pennisetum squamulatum a Tripsacum dactyloides s kukuřicí.
Rozšíření apomixie
Existuje řada experimentálních důkazů o tom, že apomixie a amfimixie se jako dva základní způsoby rozmnožování navzájem nevylučují. Naopak se v populacích určitých rostlinných druhů často vyskytují současně ve stavu určité rovnováhy. Apomiktické taxony obvykle zahrnují pohlavně se množící diploidy a polyploidy, ale také fakultativní apomikty. Pozitivním aspektem většiny apomiktů je zachování samčí fertility. Diploidní partenogeneze u jinak pohlavně se množících druhů byla zjištěna např. u rodů Fragaria, Solanum, Zea, Primula, Triticum, Petunia, Nicotiana, Brassica aj. Z dalších kulturních rostlin, u kterých je významné apomiktické rozmnožování, můžeme jmenovat Taraxacum officinale a Parthenium argentatum (Asteraceae), druhy rodů Malus a Rubus (Rosaceae), dále Poa, Panicum, Paspalum, Pennisetum a další subtropické trávy čeledě Poaceae. Odrůdy druhů subtropických rodů Citrus, Mangifera a Musa se rozmnožují apomikticky semeny vzniklými adventivní embryonií. Celkově se různé typy apomixie zjistily u více než 300 druhů a 90 rodů krytosemenných rostlin. Přitom se často vyskytují ve fylogeneticky mladých čeledích, např. Poaceae (téměř 60 rodů) a Asteraceae (téměř 30 rodů). Nejčastější je výskyt apomixie u Gramineae, řádu Compositae a čeledě Rosaceae. Apomixie byla zjištěna většinou u druhů s vyšší ploidií, což také komplikuje její využití ve šlechtění.
Využití apomixie ve šlechtění
Detekce apomixie předcházející jejímu využití je poměrně snadná při úplné apomixii. Např. u většiny rostlin Taraxacum officinale i po pečlivé kastraci jednotlivých květů a po vyloučení možnosti cizosprášení izolací úboru, vznikají normální semena. Naproti tomu částečnou apomixii zjistíme tímto způsobem velmi těžko. Ještě komplikovanější jsou případy pseudogamie, kdy embryo sice vzniká partenogeneticky, vyžaduje však stimulaci opylením pro vývoj endospermu. Na pseudogamii můžeme usuzovat tehdy, jestliže po „křížení“ dvou homozygotních rostlin s různými dominantními geny – markery (AA bb x aa BB) bude potomstvo F1 jednotné a fenotypově shodné s mateřskou rostlinou.
Zájem o apomiktický způsob rozmnožování a jeho využití ve šlechtění se soustřeďuje na několik základních oblastí:
- Pozornost je zaměřena na ověření biologických a genetických předpokladů apomiktických forem při fixaci heteroze u vhodných hybridních kombinací hospodářsky důležitých rostlin, bez neustálého opakování křížení při tvorbě hybridů a na snadnější udržování rodičovských linií. Určité úspěchy byly v tomto směru dosaženy u čiroku a jiných Poaceae a u některých zástupců z čeledě Asteraceae, např. u Centaurea cyanus.
- Některé šlechtitelské programy jsou zaměřeny na zvýšení genetické variability hospodářsky důležitých apomiktů mezidruhovým křížením s pohlavně se rozmnožujícími formami nebo fakultativními apomikty. Obvykle se používá křížení, ve kterém se mateřské rostliny opylují pylem obligátních apomiktů. Vzniklé heterozygotní potomstvo vykazuje velkou variabilitu jak ve sledovaných znacích, tak i ve způsobu rozmnožování. Následující výběr je obvykle zaměřen na hospodářsky nejcennější vysoce apomiktické hybridy. V některých případech bylo možno tímto způsobem vybrat i obligátní apomikty (např. Pennisetum ciliare, Panicum maximum).
- Další oblast využití je spjata s představou indukce vyšší četnosti haploidní partenogeneze, následným výběrem haploidních rostlin a po jejich diploidizaci rychlým odvozením homozygotních linií. Takové linie se mohou úspěšně využít jako rodičovské linie při tvorbě výkonných hybridů.
- Opakovaný vznik partenogenetických rostlin je často pozorován v potomstvech mezidruhových i mezirodových hybridů, kdy v důsledku poruch v meióze dochází v některých případech k tvorbě neredukovaných gamet. Jejich vznik v řadě případů umožňuje i fixaci amfidiploidního stavu např. u mezirodových hybridů Haynaldia x Triticum, Triticum x Aegilops. Nejvíce amfiploidů s následným praktickým využitím bylo však získáno z křížení Triticum x Secale.
- Adventivní embryonie je významným způsobem reprodukce u Citrus sp. a využívá se k získání bezvirózního potomstva. Tento typ reprodukce se prakticky využívá i u dalších rodů např. Mangifera, Malus, Ribes a Beta.
K uskutečnění uvedených šlechtitelských záměrů je nutná záměrná introgrese jednotlivých složek (geneticky kontrolovaných komponent) apomixie do pohlavně se množících hospodářsky důležitých rostlin. To je možné buď výběrem rostlin z cizosprašných populací (u samosprašných rostlin se předpokládá, že jsou tyto geny rychle eliminovány), nebo indukcí mutací. V neposlední řadě je to možné uskutečnit přenosem celých chromozomů (nebo jejich fragmentů) vzdálenou hybridizací z geneticky příbuzných apomiktických forem nebo druhů a následným výběrem linií s vhodnými složkami apomixie. K jejich identifikaci se využívají izoenzymové nebo DNA markery. Byly rozpracovány vysoce efektivní metody přenosu částí chromozomů, které mohou tento proces podstatně urychlit. Podařilo se například přenést složky apomixie z Tripsacum dactyloides do Zea mays. K introdukci apomixie byly využity také druhy rodů Beta, Malus, Agropyron, Elymus a Solanum. Pokusy o introdukci složek apomixie ze vzdálených příbuzných druhů do druhů se zemědělským využitím však byly většinou neúspěšné, protože výsledkem byly jen částečně fertilní apomiktické rostliny. Z těchto důvodů se úsilí výzkumných pracovníků zaměřilo na identifikaci a izolaci klíčových regulačních genů.
Genetická determinace apomixie
Přes mnohaleté úsilí šlechtitelů není apomixie ve větší míře využívána ve šlechtitelských programech a její genetická kontrola není doposud zcela objasněna. Pravděpodobně jde o znak kvalitativní. U většiny sledovaných druhů segregovala apomixie jako jeden lokus. U druhů Panicum maximum, Ranunculus auricomus a Brachiaria sp. byla zjištěna aposporie s monogenní dědičností, kde byla tvorba neredukovaného zárodečného vaku determinována dominantní alelou. Hlavními modelovými druhy při studiu genetiky diplosporie byly druhy rodu Taraxacum. U nich je gen nebo několik málo genů determinujících tento typ apomixie lokalizován na jednom chromozomu. U druhů rodu Tripsacum je apomixie kontrolována několika těsně vázanými geny a dědí se mendelovsky jako jeden lokus. Výskyt obligátní nebo fakultativní apomixie a odlišný stupeň fakultativní apomixie v rámci jednoho druhu naznačuje vliv jiných genů, tzv. modifikátorů, nebo vliv genetického pozadí.
Gametofytická apomixe zahrnuje několik modifikací pohlavního reprodukčního cyklu, jako je apomeióza, partenogenetická tvorba embrya a v některých případech změny tvorby centrální buňky zárodečného vaku a různé způsoby tvorby endospermu.
Výzkum prováděný v 80. a 90. letech minulého století u několika druhů naznačuje, že apomeióza se dědí monogenně, dominantní alelou. Různá penetrance genu vysvětluje výskyt fakultativních apomiktů. U některých druhů, jako je Ranunculus auricomus, Pennisetum maximum a Hieracium piloselloides, se apomeióza společně s dalšími elementy apomiktické reprodukce dědí také jako jeden znak. U druhů Taraxacum officinale, Poa pratensis a Erigeron annuus, apomeióza ne vždy kosegreguje s dalšími rysy apomeiózy. U všech testovaných druhů je silná suprese rekombinace v okolí lokusu pro apomeiózu, což naznačuje, že apomixis je asi kontrolována mnoha geny, které jsou v těsné vazbě, geny tvoří jeden nebo dva komplexy.
Práce od r. 1999 dokládají nezávislou kontrolu jednotlivých komponent apomeiózy a partenogeneze dominantními alelami majorgenů. Ale to nevylučuje, že každá komponenta apomixis může být kontrolována více geny. Doposud nejsou žádné poznatky o faktorech podmiňujících penetranci a expresivitu u různých genetických pozadí. Rozdíly v expresivitě a interakce genů jsou zodpovědné za širokou škálu způsobů reprodukce. Aposporie a partenogeneze a také jednotlivé geny segregují nezávisle.
Genetické analýzy jsou komplikovány nízkou rekombinací, nepravidelnou segregací a polyploidií. Nejobtížnější jsou analýzy tvorby apomiktických semen, protože gametofytická generace je reprezentována jen několika málo buňkami a je omezena na krátký časový interval.
Poa pratensis je významná pícnina. Je to aposporní pseudogamní apomikt s 2n = 18 až 150. Genetická kontrola apomixie byla studována u řady segregujících potomstev pocházejících z křížení a selfování obligátních pohlavně se množících rodičů a fakultativních apomiktických rodičů. Výsledkem je model s pěti geny s velkým účinkem, které jsou nezbytné pro kontrolu tvorby asexuálních semen:
- Apospory initiator Ait aktivace aposporie
- Apospory preventer Apv inaktivace tvorby aposporního zárodečného vaku
- Megaspore development Mdv tvorba mateřské buňky megaspóry
- Partenogenesis initiator Pit aktivace partenogeneze
- Partenogenesis preventer Ppv inaktivace partenogeneze
Rozdíly v expresivitě a interakce genů jsou zodpovědné za širokou škálu způsobů reprodukce. Aposporie a partenogeneze a také jednotlivé geny segregují nezávisle.
- Geny Apv, Ppv brání tvorbě aposporního zárodečného vaku a embrya bez oplození.
- Penetrance a expresivita je úplná u genů Apv a Ppv u rostlin s amfimixií.
- Recesivní alely apv, ppv tolerují, ale neindukují apomeiózu nebo partenogenezi.
- Dvojnásobný recesivní homozygot apv apv ppv ppv tvoří apomiktická semena sporadicky.
- Pro vyšší podíl apomixe existují dva další geny. Dominantní alely Ait a Pit indukují aposporii a partenogenezi. Nejvyšší podíl apomixie je u genotypů Ait - apv apv, Pit - ppv ppv.
- Obligátní amfimixie je u genotypů ait ait Apv -, pit pit Ppv - .
- Recesivní alela mdv způsobuje aborci megaspór nebo megagametofytů.
- Genotyp stabilního aposporního apomikta je Ait - apv apv mdv mdv Pit - ppv ppv.
Je možné šlechtění na apomixii?
Testované přístupy introdukce apomixie do kulturních druhů jsou založeny např. na hybridizaci příbuzných druhů, apomikta s pohlavně se množícím kulturním druhem. Čeleď Poaceae má řadu apomiktických druhů a řadu ekonomicky významných druhů. V řadě programů byly snahy přenést pseudogamní apomixii do kulturního druhu prostřednictvím mezirodové nebo mezidruhové hybridizace (Tripsacum dactyloides x Zea mays nebo Pennisetum squamulatum x Pennisetum squamosum)..
Hybridizace byla vždy málo úspěšná. U kříženců docházelo ke ztrátě apomiktické schopnosti, aborci semen a sterilitě v důsledku nerovnováhy endospermu vlivem fúze neredukovaných centrálních buněk s haploidní spermatickou buňkou. Introgrese autonomní apomixie, která je schopná obejít problémy s endospermem, však není k dispozici u čeledě Poaceae, ale vyskytuje se jen u čeledě Asteraceae.Další přístup byl založen na indukci mutací u pohlavně se množícího druhu a výběru rostlin s autonomní tvorbou semen. Byla prováděna řada pokusů a u jednotlivých mutantů byly získány dílčí znaky, jako je schopnost tvorby neredukovaných gamet a partenogenetických embryí. Ale nepodařilo se získat rostlinu, která vytváří asexuální embrya ve vysokých četnostech. Mutageneze a skrínink apomixie byly testovány i u Arabidopsis. Byly identifikovány tři mutace fis (fertilisation independent seed) – fis1/mea (medea), fis2, fis3/fie (fertilization independent endosperm). U mutantů docházelo k autonomnímu vývoji centrální buňky ve zralém zárodečném vaku. Avšak žádná mutace samostatně nebyla schopná indukovat plnou diferenciaci automního endospermu. Dále se u mutantů nepodařilo iniciovat vývoj vaječné buňky, pravděpodobně proto, že gen FIS je pozdě exprimován.
Klonování genů pro apomixii u rostlin s apomixií a jejich následné využití při genetické transformaci je velmi obtížné z důvodů suprese rekombinace v okolí lokusu, polyploidie druhů a redukované sexualitě apomiktů. Ačkoli některé lokusy byly zmapovány, žádné nebyly osekvenovány. Je nezbytné aplikovat jiné přístupy, např. přes mRNA.
Byly identifikovány geny podílející se na indukci embryogeneze bez oplození. Např. roku 2001 byl identifikován gen AtSERK1, který je exprimován u vajíček před oplozením a u raných embryí; exprese genu zvyšuje embyogenní potenciál kalusů in vitro. Roku 2002 byl identifikován gen BABYBOOM, který je exprimován během tvorby semen; v podmínkách in vitro indukuje tvorbu somatických embryí např. na okrajích listů a v apikálním vrcholu. Exprese těchto genů stimuluje sice somatickou embryogenezi in vitro u vegetativních orgánů, avšak zdaleka nic neříká o možnosti indukovat partenogenezi v semenech, což je nezbytné pro apomixii.
On-line prezentace
Ke kapitole Rozmnožování rostlin a jeho genetické důsledky.
ÚEB Biol, Přírodovědecká fakulta, Masarykova univerzita |
Návrat na úvodní stránku webu, přístupnost |
| Servisní středisko pro e-learning na MU
| Fakulta informatiky Masarykovy univerzity, 2013
Centrum interaktivních a multimediálních studijních opor pro inovaci výuky a efektivní učení | CZ.1.07/2.2.00/28.0041

