Odolnost rostlin k patogenům
Rostliny jsou zdrojem obživy nejen pro lidskou populaci, ale již na počátku své evoluce byly zdrojem výživy pro další organizmy – mikroorganizmy, jako jsou např. houby a bakterie. Většina těchto organizmů jsou saprofyté využívající jako zdroj své výživy metabolity rostlin, které jsou již odumřelé a rozkládají se. Mnoho dalších však napadá živé rostliny. Některé organizmy žijí s rostlinami v symbióze, která je výhodná pro rostlinu i mikroorganizmus – př. jsou rizobia (fixace dusíku, význam v zemědělství), nebo mykorhizní houbové organizmy. Další skupinou organizmů jsou ty, které napadají rostliny a využívají jejich metabolity, rostlinu neusmrtí, ale negativně ovlivňují její metabolizmus. Negativní vlivy působení cizího organizmu se projeví u rostliny určitými příznaky jako choroba. Podle vnějších příznaků odborníci poznají, kterým organizmem je rostlina napadena. Choroba má tedy určité fenotypové projevy. Důsledkem napadení je většinou zhoršená vitalita rostlin, a pokud jde o kulturní plodiny, vznikají tak škody v zemědělství. Takové organizmy se nazývají patogenní, napadená rostlina je hostitel. Ne všechny organizmy jsou pro určitý druh patogenní; nepatogenní organizmus nenapadá rostliny určitého druhu.
Reakce rostlin na napadení patogenem jsou velice rozmanité a odolnost rostlin může mít různé příčiny. V procesu kontaktu parazita s hostitelem a v procesu vytváření parazitického vztahu lze nalézt obecné rysy:
První etapa je kontakt – interakce patogena s hostitelem. Nálet počátečního inokula na rostlinu se uskutečňuje vzdušnými proudy, vodou nebo hmyzem. Počáteční inokulum je určité množství jednotek, které se dostanou na hostitelskou rostlinu. Počáteční inokulum vyvolává tzv. infekční tlak. V této etapě působí mechanizmy úniku před chorobou, tedy hlavně mechanizmy zábrany vniknutí do pletiv. Průnik do rostliny se uskutečňuje přímo přes povrchové vrstvy prostřednictvím mechanického tlaku nebo enzymatického působení, přes přirozené otvory jako jsou průduchy a lenticely nebo až po poranění rostliny.
Druhou etapou je infekce. Počáteční inokulum se dostane do aktivního stavu, v němž je schopno infikovat hostitele. Etapa infekce končí, jakmile mezi parazitem a hostitelem vznikne parazitický vztah. V této fázi mohou s vysokou účinností působit inhibiční látky produkované rostlinou.
Třetí etapou je vlastní parazitický vztah. Ten je charakterizován výživou na úkor hostitele. Tento proces začíná skrytě (inkubační dobou) a končí vnějšími příznaky napadení.
Rostliny vzhledem ke svému nepohyblivému způsobu života musí mít schopnost adaptovat se k různým extrémním (stresovým) podmínkám prostředí. Řada adaptací se děje na úrovni transkripce genů. Rostlina disponuje četnými obrannými mechanizmy, které se různým způsobem překrývají:
- konstitutivní – předem vytvořené jako fyzické bariéry (kutikula, buněčná stěna) a různé antimikrobiální látky, pokud jsou přítomné i bez působení stresového faktoru,
- indukované – vyžadují určitou formu indukčního signálu ke své aktivaci.
Obrana rostliny může být dvou typů:
- pasivní – závisí na anatomických a morfologických vlastnostech rostliny,
- aktivní – daná syntézou indukovaných obranných látek.
Mechanizmy působení rostlinných patogenů
Rostlinné patogeny působí různými mechanizmy, které byly zatím prozkoumány jen v hlavních rysech. Studium mechanizmů jejich působení je důležité k tomu, aby bylo možné přesněji definovat jednotlivé typy rostlinných obranných mechanizmů. Proto studium mechanizmů působení rostlinných patogenů, zvláště jejich enzymů, které se patogeneze účastní, je stejně významné jako studium rostlinných genů podmiňujících rezistenci. Základní typy rostlinných patogenů jsou houbové, bakteriální a virové organizmy.
Houbové organizmy
Bylo popsáno asi 74 tisíc až 100 tisíc druhů hub, avšak většina z nich jsou saprofyté. Více než 10 tisíc druhů hub jsou parazité, kteří žijí na živých rostlinách a způsobují různý stupeň jejich poškození (vnější příznaky – choroba). Nejčastějšími patogeny u rostlin jsou Blumeria (padlí), Erysiphe (padlí), Monilinia (houbová choroba plodů), Sclerotinia (kořenové a stonkové hniloby), Ustilago (sněť), Melampsora, Puccinia a Uromyces (původci rzí), Fusarium (původce krčkových hnilob).
Tito parazité jsou:
- biotrofní a získávají živiny z živých hostitelských buněk pletiv a snižují tak vitalitu rostlin,
- nekrotrofní využívají svoje enzymy nebo toxiny, kterými naruší buněčnou stěnu i cytoplazmatickou membránu, rostlina uhyne a potom využívají metabolity rostlinných buněk pro svoji výživu.
Většina houbových organizmů jsou kombinované formy – hemibiotrofní. V první fázi po napadení dochází k biotrofní infekci, potom k poškození buněk a jejich smrti. Následuje sporulace houbového organizmu.
Enzymy, které narušují rostlinné buněčné stěny, jsou zejména polygalakturonidázy, pektát lyázy a kutinázy. V dalším stadiu se účastní hydrolázy a esterázy, které rozrušují makromolekulární komponenty rostlinných buněk, jež jsou potom použity pro výstavbu buněčných komponent patogena. Často se podílejí i nízkomolekulární toxiny (alkaloidy a další). Geny pro základní enzymy, působící patogenicitu mnoha patogenů byly klonovány.
Cochliobolus carbonum produkuje specifický HC toxin, který inhibuje aktivitu histonové deacetylázy, enzymu nezbytného pro aktivaci genů obranného systému. Alternaria alternata f. sp. lycopersici produkuje AAL toxin, který pravděpodobně aktivuje mechanizmus programované buněčné smrti u rajčete. Další houby tvoří neselektivní toxiny, např. Fusicoccum amygdali tvoří toxin fusicoccin, který působí na H+-ATPázu lokalizovanou na membránách. Působením toxinu dochází k nevratnému otevření stomat a vadnutí rostlin, to je následováno programovanou buněčnou smrtí a nekrotrofní kolonizací.
Bakteriální organizmy
Z 1 600 druhů bakterií asi 100 druhů způsobuje choroby rostlin (např. Pseudomonas, Xanthomonas, Agrobacterium, Erwinia a další). Některé druhy Pseudomonas mohou být symbiotické, jiné patogenní. Bakterie podobně jako houby degradují pektin a další komponenty rostlinné buněčné stěny (pektin lyázy, polygalakturonidázy). Bakterie pak přežívají v mezibuněčných prostorách různých orgánů nebo v xylemu. Bakteriální geny, které působí patogenicitu, jsou zmapovány a klonovány lépe než houbové díky značným možnostem bakteriální genetiky a bakteriálního genového inženýrství. Je poměrně dobře známa degradativní dráha pektinu. U bakterie Erwinia chrysanthemi byly izolovány nejen enzymy, které se jí účastní, ale byly detekovány také jednotlivé geny, z nichž většina byla klonována a sekvenována. Jsou to následující geny kódující příslušné enzmy:
- pel pektát lyáza (kódovaná u Pseudomonas pěti geny pelA až pelE)
- ogl oligogalakturonát lyáza
- kduI 5-keto-4-deoxyuronát izomeráza
- kduD 2-keto-3-deoxyglukonát oxidoreduktáza
- kdgK 2-keto-3-deoxyglukonát kináza
- kdgA 2-keto-3-deoxy-6-fosfoglukonát aldoláza
- pme pektin metylesteráza
- exuT transportní systém galakturonátu do rostlin
- uxaC uronát izomeráza
- uxaB altronát oxidoreduktáza
- uxaA altronát hydrolyáza
Kromě toho mnoho druhů fytopatogenních bakterií produkuje toxiny, které spolupůsobí při vzniku a vývoji choroby.
Z hlediska poznání mechanizmu působení toxinů můžeme rozlišit tři skupiny:
- toxiny se známým mechanizmem působení (nízký počet),
- toxiny se známým metabolickým procesem, do kterého jsou zapojeny, případně které organely jsou jím postiženy,
- toxiny s neznámým mechanizmem působení (většina).
Jedním bakteriálním klonem může být produkováno větší množství toxinů, ale jen některé z nich jsou známy. Spektrum toxinů produkovaných mikrobiálním patogenem in vitro může být odlišné od spektra toxinů produkovaných v rostlině. Toxiny jsou extracelulární polysacharidy a každý toxin má svůj jediný typ cílové molekuly – obvykle specifický enzym, který inaktivuje. Důsledek působení toxinů je cévní vadnutí, rakovina, sněti, hniloby a plísně.
Například Pseudomonas syringae pv. (patovar) phaseolytica produkuje fazeolotoxin, který inhibuje specifický rostlinný enzym ornitinového cyklu, ornitin karbamoyltransferázu (OCTázu). Pseudomonas syringae pv. tabaci produkuje tabtoxin, jehož beta-laktam inhibuje glutamin syntázu, která se účastní odbourávání amonných iontů v rostlině. Genů pro produkci bakteriálních fytotoxinů (nízkomolekulárních difundabilních látek) bývá obvykle několik a bývají společně lokalizovány na velkém bakteriálním plazmidu. Řada těchto genů byla klonována. Pro patogenezi jsou obecně nezbytné geny Hrp (Hypersensitive response and pathogenicity cluster) produkující protein umožňující transport proteinů Avr do rostliny.
Hlavním molekulárně genetickým poznatkem využitelným pro genové manipulace rostlin je, že i bakterie mají enzymy obdobné těm rostlinným, které jsou cílovými místy působení toxinu. Tyto bakteriální enzymy jsou však k toxinu rezistentní. Klonované geny pro takové bakteriální enzymy mohou být po spojení s vhodnými rostlinnými regulačními sekvencemi vneseny do rostlinného genomu a tam podmiňovat rezistenci k bakteriálním toxinům.
Viry
Mnoho virů infikuje řadu rostlinných druhů; u různých hostitelů způsobují různé symptomy. Většina rostlinných virů má genom tvořený jednořetězcovou RNA a plášťovým proteinem (Rhabdoviridae, Potyviridae, Luteoviridae). Další rostlinné viry mají dsRNA (Reoviridae, Partitiviridae), mezi rostlinnými viry se vyskytují i ty s genomem tvořeným ssDNA (Geminiviridae) i dsDNA (Caulimoviridae). Hlavními vektory virů jsou mšice, dalšími nematody a živočichové, šířit se mohou ale i semeny nebo pylem. Jakmile je virus uvnitř rostliny, replikuje se, využívá a modifikuje rostlinný replikační aparát. Šíří se plazmodezmaty mezi buňkami a cévním systémem celou rostlinou.
Pasivní (konstitutivní) obranné mechanizmy
Pasivní obranné mechanizmy zahrnují jak strukturní elementy jako je kutikula, tak antimikrobiální chemické látky v rostlině, které jsou zde přítomny již před napadením patogenem, tzv. fytoanticipiny. Je to první obranná bariéra vůči napadení mikroorganizmem.
Strukturní bariéry
Povrch rostlin tvoří kutikula a její hlavní součástí je kutin, dále celulóza a pektin. Kutin je nerozpustný polyester, který se skládá z hydroxy a hydroxyepoxy mastných kyselin. Další významnou součástí je suberin s obdobným složením. První pasivní bariéru proti mikroorganizmům na povrchu kutikuly tvoří vosky. Chrání rostlinu před vyschnutím a působí jako bariéra proti vstupu mikroorganizmů. Brání tvorbě kapek vody, které jsou nezbytné pro pronikání bakterií a klíčení spor hub. Podobnou funkci mají chloupky na listech. Kutikula je velmi účinná proti vstupu virů, ale ty pronikají přes poranění nebo prostřednictvím vektorů. Houby pronikají kutikulou přímo, v důsledku exkrece kutináz. Buněčná stěna epidermálních buněk tvoří další bariéru proti všem patogenům, kromě těch hub, které mají faktory patogenicity pro přímou penetraci, a vektorů, které nesou patogena. Stomata jsou jedinými otvory ve strukturní bariéře. Některé houby mohou pronikat zavřenými stomaty, jiné, jako např. rzi obilovin, musí čekat na jejich otevření.
Lignifikace rostlinných pletiv je jedním z dalších typů obranných reakcí. U starších rostlinných orgánů dochází k lignifikaci cévních pletiv. Lignin je komplexní heterogenní aromatický polymer, který zesiluje buněčné stěny buněk vyšších rostlin a činí je nepropustné pro vodu. Vzniká polymerací fenylpropanoidových monolignolů, para-kumaryl, -koniferyl a ‑synaptylalkoholů. Ligniny různých rostlin i různých částí téže rostliny se liší složením a obsahem svých monolignolů. Tato variabilita je pravděpodobně určována různými substrátovými specifitami enzymů syntetizujících lignin. Je to polymer s komplexní strukturou, s různými esterickými a uhlíkatými vazbami mezi monomery i příčnými vazbami s dalšími polymery buněčných stěn. Prekurzory ligninu jsou syntetizovány fenylpropanoidovou metabolickou drahou, která syntetizuje také prekurzory antokyanů, flavonoidů a taninů. Obecné enzymy fenylpropanoidového metabolizmu jsou fenylalanin amonium lyáza (PAL) a cinamát-4-hydroxyláza (C4-H).
Byl získán transgenní tabák se sníženou aktivitou PAL a sníženým obsahem ligninu v xylemu. Měl mnoho morfologických abnormalit, jako zakrslý růst, změněný tvar listů, sníženou životaschopnost pylu, změněnou morfologii kvetení. Jiný transgenní tabák měl změněn jeden z terminálních enzymů syntézy ligninu. Vytvářel jiný typ ligninu červenohnědého zbarvení, takže lodyhy odkvétajících rostlin měly hnědé zbarvení. Tento typ ligninu by byl vhodný u dřevin používaných v dřevozpracovatelském průmyslu, protože se dá snadno oddělit od celulózy.
Chemické bariéry
Fytoanticipiny jsou chemické sloučeniny přítomné v rostlině, které fungují jako antimikrobiální látky a tvoří chemickou bariéru proti invazi patogenů. Detoxifikují enzymy patogenů; např. triterpenoid avenacin (saponin přítomný u ovsa) detoxifikuje enzym avenacinázu.
Morfologické strukturní bariéry
Spory patogenního organizmu Ustilago nuda f. sp. hordei (sněť) se rozšiřují větrem a rostlinu infikují přes otevřené květy – přes bliznu a stěnu semeníku. Ječmen je autogamní, opylení tedy nevyžaduje otevření květů. Proto se šlechtí odrůdy kleistogamní, u nichž se květy neotvírají, k opylení a oplození dochází uvnitř zavřeného květu a patogen se nedostane do květů a neinfikuje rostlinu.
Aktivní (indukované) obranné mechanizmy
Lokální signály
První reakcí rostliny po invazi patogena, před aktivací exprese specifických genů a syntézou proteinů, je tvorba iontových kanálů, reaktivních kyslíkových radikálů, tvorba kysličníku dusnatého a aktivace fosforylační kaskády.
Programovaná buněčná smrt
Důležitým aktivním obranným mechanizmem u rostlin je hypersenzitivní reakce (HR), která je charakterizována rychlou nekrózou, tj. místním odumřením živého pletiva v místě napadení patogenem. Tento mechanizmus pravděpodobně zahrnuje dvě fáze: zaprvé indukce programované smrti okolních buněk může zamezit šíření patogena a lokalizovat jej od zbytku rostliny a zadruhé existuje široká fyziologicky podmíněná imunita, tzv. systémová rezistence, která je důsledkem hypersenzitivní reakce a aktivace genů spojených s obranným procesem.
HR je časově a prostorově koordinovaný mechanizmus, kdy v buňkách dochází ke kondenzaci chromatinu a degradaci DNA.
Inhibiční látky rostlin
Příkladem účinku inhibičních látek je rezistence zelených plodů rajčat, které obsahují steroidní alkaloid tomatin, vůči Fusarium spp. Aby byla zjištěna funkce tohoto alkaloidu pro rezistenci, byly selektovány mutantní kmeny Fusarium, které měly schopnost růst při vysokých koncentracích tomatinu. Bylo zjištěno, že tyto kmeny mají zvýšenou virulenci k zeleným plodům, takže i tomatin má důležitou funkci v rezistenci vůči tomuto patogenu.
Biopolymery buněčné stěny
Poranění nebo infekce rostliny mají za následek akumulaci specifických proteinů extenzinů v buněčné stěně, zvláště u dvouděložných rostlin. Extenziny jsou glykoproteiny bohaté na hydroxyprolin a mají schopnost vázat intramolekulárně různé komponenty buněčné stěny.
V buňkách ječmene a některých dalších Poaceae byly zjištěny thioniny, proteiny, které jsou vysoce toxické pro houby a jsou velmi odolné vůči degradaci patogenem. Geny pro tyto proteiny byly již klonovány a sekvenovány.
Další polymer, odolný k degradaci patogenem je lignin. Klíčové enzymy syntézy ligninu jsou cinamylalkoholehydrogenázy a polyfenoloxidázy. Další fenolickou sloučeninou ukládající se na vnitřním povrchu buněčné stěny je suberin. Kalóza je polysacharid (β-1,3-glukan), který je deponován při infekci patogenem v buněčné stěně, což blokuje šíření hub i virů. Kalóza blokuje také plazmodezmata vůči pohybu virů. Proces lignifikace může být indukován patogenem a účastní se ho současně celá skupina genů hostitele, která je aktivována na úrovni transkripce. Mezi nimi jsou i hydrolázy, které rozkládají komponenty buněčné stěny hub, jako chitinázy a β-1,3-glukanázy. Některé chitiny mají současně také lysozymovou aktivitu a lze předpokládat, že působí antibakteriálně tím, že hydrolyzují buněčné stěny bakterií.
Peroxidázy jsou hlavní enzymy, které mají funkci při zesílení buněčné stěny a jsou indukované patogenem. Oxidují řadu substrátů, využívají H2O2 jako donoru elektronu. Jde o velkou rodinu proteinů vyskytujících se v celé rostlinné říši. U jednoho druhu lze nalézt až 40 různých izoforem. Peroxidázy modifikují buněčnou stěnu oxidací dvou rozpustných proteinů, proteinu bohatého na hydroxyprolin a proteinu bohatého na prolin. Jde o důležité strukturní proteiny v místech, kde dochází k lignifikaci.
Fytoalexiny
Houbové patogeny uvolňují do buněk hostitele specifické látky – elicitory, které indukují syntézu nízkomolekulárních látek. Elicitory jsou aktivní již při extrémně nízkých koncentracích. Typickým elicitorem je glukan, který působí v koncentraci 10-9. Obecně elicitory mohou být sacharidy, ale také polypeptidy. Další elicitory jsou např. chitozan, houbové polysacharidy ale i glykoproteiny, ribonukleázy apod. Elicitory indukují syntézu fytoalexinů. Existuje mnoho typů fytoalexinů a každý rostlinný druh syntetizuje většinou jeden fytoalexin. Obecně jsou to nízkomolekulární obranné antibakteriální a protihoubové látky, které jsou chemicky velmi heterogenní, ale převážně se jedná o fenolické sloučeniny.
Fytoalexiny jako sekundární metabolity zahrnují terpenoidy (seskviterpeny – rišitin u bramboru), saponiny (avenacin u ovsa), alifatické kyselé deriváty, fenolické látky a fenylpropanoidy (flavonoidy, izoflavonoidy, pterokarpany – medicarpin u vojtěšky), stilbeny (resveratrol u révy vinné) nebo organické látky (alkaloidy). Většina těchto látek jsou deriváty biosyntetických drah izoprenoidu, fenylpropanoidu, alkaloidu nebo mastných kyselin.
Klíčovým enzymem syntézy fytoalexinů je fenylalanin amonium lyáza (PAL), jejíž gen byl klonován. Způsobuje přeměnu fenylalaninu na kyselinu cinamovou. Ta je pak hydrolyzována acetylkoenzymem A za vzniku 4-hydroxycynamyl-CaA, který je využíván ve dvou metabolických drahách:
- syntéza flavonoidů a isoflavonoidů nebo fytoalexinů prostřednictvím chalkonsyntázy (CHS, další enzym, jehož gen byl klonován z genomu řady rostlinných druhů),
- přeměna na prekurzory ligninu.
Fytolaexiny jsou u rostlin druhově specifické (brambory – rišitin, hrách – pisatin, vojtěška – medicarpin, jetel – trifolirhizin, fazol – fazeolin, kukuřice – zeatin). Fytoalexiny jsou toxické i pro rostlinné buňky. Po indukci jejich syntéza dosahuje vrcholu a pak je blokována. I tak je u některých genotypů příčinou hypersenzitivní reakce.
Elicitory aktivují signalizační dráhu, která začíná jejich reakcí s receptory buněčné membrány nebo vniknutím do cytoplazmy. Signální polypeptid buněčné membrány, který tvoří článek řetězu přenosu signálu od elicitoru ke spuštění syntézy fytoalexinu, musí obsahovat tři úseky:
- hydrofilní zónu, která interaguje s prostředím na vnějším povrchu buněčné stěny,
- hydrofobní zónu, která je v interakci s lipidovou dvojvrstvou,
- část, schopnou komunikovat s cytoplazmou.
Elicitory mohou v některých případech také procházet buněčnou stěnou a buněčnou membránou do nitra buněk (prostřednictvím pórů, plazmodezmat a kanálků).
Elicitory indukují syntézu fytoalexinů, ale mohou současně také stimulovat syntézu alkaloidů u těch rostlinných druhů, u nichž alkaloidy vznikají i v neinfikovaných rostlinných pletivech, ale také jsou indukovány nebo jejich syntéza je zvýšena po infekci patogenem. Alkaloidy mohou být toxické pro patogena.
U rostlin se předpokládá existence antivirových proteinů podobných interferonu. Jde o látky, které nebyly přesně identifikovány. Takovýto protein byl izolován z listů Nicotiana glutinosa infikovaných TMV (virus mozaiky tabáku). Jeho aplikace na další tabáky vedla ke snížení obsahu virů v rostlině. Rovněž protoplasty N. tabacum uvolňovaly do media protein, který měl antigenní vlastnosti, ale nebyl serologicky příbuzný s interferonem.
Některá pletiva vyšších rostlin produkují nízkomolekulární látky – fytoncidy, které působí baktericidně, fungicidně i insekticidně. Jsou to látky chemicky různorodé, které buď usmrcují mikroorganizmy, nebo omezují jejich růst. Jsou obsaženy v rajčatech, cibuli, česneku, křenu, citronech, v kopřivě, černém rybízu a v mnoha dalších rostlinách, v jejich nadzemních i podzemních částech. Nazývají se rostlinnými antibiotiky, protože jde o léčiva rostlinného původu, která mají význam i v ochraně člověka před infekcemi.
Hydrolázy
Hydrolázy jsou enzymy, které jsou indukovány patogenem a rozkládají komponenty buněčné stěny hub (chitinázy, ß-1,3 glukanázy). Částečně se překrývají s PR-proteiny.
PR-proteiny
PR-proteiny (angl. pathogenesis-related) jsou další, tentokrát zvláště významnou a univerzálně v rostlinách přítomnou skupinou proteinů, které se účastní obranných reakcí rostliny. Jsou to proteiny indukované infekcí virů a viroidů, ale také bakteriálními a houbovými patogeny. Je to skupina většího počtu heterogenních proteinů, které byly studovány především u tabáku, ale také u dalších druhů.
Geny pro různé PR-proteiny byly klonovány a sekvenovány a některé z nich mají chitinázovou nebo D-1,3-glukanázovou aktivitu. PR-proteiny jsou ve velmi nízkých koncentracích přítomny i v neinfikovaných pletivech, ale po infekci se jejich hladina zvyšuje o 2 až 3 řády.
PR-proteiny nemusí ale vždy být indukovány jen patogeny. Například endogenně zvýšená aktivita auxinů v pletivech transformovaných bakteriemi Agrobacterium tumefaciens rovněž zvyšuje syntézu PR-proteinů. Předpokládá se, že etylén je obecným induktorem PR-proteinů. Prekurzory etylénu stimulují syntézu PR-proteinů a látky, které blokují syntézu etylénu, blokují také syntézu PR-proteinů.
Syntézu PR-proteinů zvyšují rovněž některé chemické látky, jako kyselina polyakrylová, kyselina salicylová, acetosalicylová, benzoová, dále AgNO3, MgCl2 a další látky. Jiné látky a faktory syntézu PR-proteinů inhibují. Jsou to například arginin, lysin, ornitin, spermidin, hydrochinon, EDTA a aktinomycin D.
PR-proteiny jsou lokalizovány především v mezibuněčných prostorách a vakuolách. Značné množství se jich hromadí v xylemu. Obranné vlastnosti PR-proteinů jsou z větší části vysvětlitelné jejich enzymovými aktivitami (chitinázy, glukanázy, ale i alkalické deproteázy). Není však zatím vysvětlená jejich antivirová aktivita. PR proteiny byly rozděleny do 14 tříd podle homologie a serologie.
Geny pro různé proteiny, spojené s indukovanou odpovědí na patogenezi u tabáku:
- PR-1 Kyselý, extracelulární, nejvíce zastoupený, funkce neznámá
- PR-1 Bázická forma kyselého PR-1
- PR-2 Kyselá extracelulární D-1,3-glukanáza
- PR-3 Kyselá extracelulární chitináza
- PR-4 Kyselý, extracelulární, funkce neznámá
- PR-5 Kyselý extracelulární homologní s thaumatinem a bifunkční inhibitor amylázy/proteázy kukuřice, rovněž označovaný PR-R nebo PR-S
- PR-9 peroxidáza
- PR-11 chitináza
Biochemická funkce PR-proteinů a jim podobných proteinů
Základní typy PR-proteinů u tabáku jsou PR-1, PR-2, PR-3, PR-4 a PR-5. Je známo, že skupina proteinů PR-2 má D-1,3-glukanázovou aktivitu a PR-3 proteiny jsou chitinázy. Ochranná funkce D-1,3-glukanáz je dvojí:
- mohou uvolňovat z buněk patogena karbohydrátové elicitory (viz fytoalexiny),
- mohou rozrušovat hyfy hub, jejichž buněčné stěny obsahují D-1,3-glukany.
Také chitinázy narušují buněčné stěny houbových patogenů.
U rostlin jsou přítomny ještě jiné glukanázy a chitinázy, které nepatří k PR-proteinům. Ty se vyskytují konstitutivně, ale ve zvýšené míře jsou indukovány po infekci. Některé z nich jsou homologní s PR-2 a PR-3, zatímco jiné mají zcela odlišné aminokyselinové složení.
Proteiny PR-4 jsou homologní proteinu, který vzniká u bramboru translací určitého typu mRNA, indukované poraněním. Proteiny PR-5 jsou příbuzné thaumatinu, což je bazický, sladký (100 tisíc krát sladší než cukr) zásobní protein semen tropického keře Thaumatocuccus danelii. Proteiny PR-5 však nemají sladkou chuť. Jsou podobné proteinu osmotického stresu u tabáku, osmotinu. Syntéza PR-5 je indukována jednak vývojově a jednak patogeny.
Transgenoze genem pro PR-1 nevedla ke zvýšené rezistenci tabáku k virům. Je však možné, že PR-1 nepůsobí antivirově, ale některé jiné PR-proteiny ano.
Systémová rezistence
Při systémové rezistenci dochází k aktivaci transkripce genů kódujících různé komponenty buněčné stěny rostlin (polysacharidy, lignin, suberin, saponin), které mohou být bariérou pro infekci patogena. Infekci mohou zabránit i další rostlinné enzymy (proteiny PR), což jsou různé chitinázy, glukanázy a proteázy, které rozkládají komponenty buněčné stěny hmyzích škůdců, houbových nebo bakteriálních patogenů.
Nejvýznamnější je získaná systémová rezistence (SAR, angl. systemic acquired resistance), která zajišťuje širokou rezistenci vůči virovým, bakteriálním a houbovým patogenům.
Bylo zjištěno, že při hypersensitivní reakci se v rostlině zvyšuje koncentrace kyseliny salicylové a že také exogenně aplikovaná kyselina salicylová (SA, popř. její analogy) indukuje stejné geny SAR jako při biologické iniciaci SAR. Toto zjištění vedlo k domněnce, že salicylová kyselina je endogenním signálem pro systémovou rezistenci. Systémová rezistence je výsledkem aktivace genů souvisejících s patogenezí, PR (z angl. pathogenesis related) genů.
Biosyntéza SA se děje přeměnou fenylalaninu na kyselinu trans-skořicovou prostřednictvím enzymu fenylalaninamonium lyázy (PAL). Ten je pak přeměňován na SA přes alternativní intermediáty kyselinu ortho-kumarovou nebo kyselinu benzoovou. Existují vazebné proteiny kyseliny salicylové. SA blokuje katalázu a podmiňuje vznik superoxidových radikálů. SA spolupůsobí s dalšími signál, fungujícími na dlouhou vzdálenost jako je systemin, kyselina jasmonová, elektrické potenciály a etylén. Etylén indukuje expresi PR-proteinů a inhibitory syntézy etylénu inhibují také syntézu PR-proteinů zprostředkovanou ABA.
Metodou transgenoze byly získány transgenní rostliny tabáku, do jejichž genomu byl introdukován gen nahG z genomu bakterie Pseudomonas putida, který kóduje salicylát hydroxylázu. Tento enzym přeměňuje kyselinu salicylovou na katechol, který je inaktivní při SAR. Transgenní rostliny tabáku s tímto genem neakumulují kyselinu salicylovou po napadení patogenem a nemají SAR. Tyto výsledky naznačují, že kyselina salicylová má důležitou funkci při SAR.
Dalším typem systémové rezistence je indukovaná systémová rezistence (ISR, angl. induced systemic rezistance). Je nezávislá na přítomnosti kyseliny salicylové a nedochází k expresi genů SAR. Tento typ rezistence zajišťuje jen asi 40 až 60% ochranu vůči houbovým a bakteriálním patogenům (např. Pseudomonas syringae v. tomato). Důležitými signály při indukci rezistence k mikrobiálním patogenům je kyselina jasmonová a etylén. Kyselina jasmonová zvyšuje expresi genů, které jsou součástí obranných reakcí rostliny. Existují i další obranné mechanizmy, které nejsou vyvolány kyselinou salicylovou. Patří sem např. aktivace genů, které kódují chitinázy a glukanázy, inhibitory proteáz nebo thioniny. Jsou to tzv. malé antimikrobiální peptidy. Jejich funkce při obranných mechanizmech rostliny jsou studovány u transgenních rostlin, do jejichž genomů byly introdukovány geny kódující tyto látky.
K hypersensitivní reakci dochází i po virové infekci např. virem tabákové mozaiky (TMV). Šíření virů v rostlinných pletivech může být omezeno mechanizmy závislými na přítomnosti kyseliny salicylové. Dochází ke zvýšení teploty v místě virové infekce (tzv. horečka rostliny) vlivem alternativní oxidativní respirace indukované kyselinou salicylhydroxyamicovou. Po virové infekci nemusí dojít k tvorbě příznaků (tzn. lézí či poškození), avšak virové částice způsobují zpomalení růstu rostliny a poruchy v reprodukci. Rostliny je možné ozdravit alespoň od některých typů virů. Po infekci virem květákové mozaiky nebo nepoviry rostlina využívá mechanizmů posttranskripčního umlčování genů. Umlčování genů je často pozorováno u rostlin, do jejichž genomů byla introdukována cizorodá DNA, především T‑DNA. U těchto rostlin dochází k transkripci jaderných genů, avšak mRNA je v cytoplazmě degradována různými mechanizmy. Prozatím není jasné, zda mechanizmy umlčování cizorodých genů jsou příčinou rezistence nebo důsledkem jiné obranné strategie rostliny po virové infekci.
Překrývající se obranné mechanizmy
Rostliny reagují aktivací transkripce a translace genů pro stresové proteiny nejen na patogeny, ale ještě na mnoho dalších stresových faktorů (horko, chlad, sucho, zaplavení, mechanické poškození, paraziti, xenobiotika, atmosférický ozón a podobné). Každá z odpovědí je spojena se syntézou určitého počtu proteinů, ale různé odpovědi mohou mít některé proteiny společné. Toto překrývání odpovědí může mít za následek jejich vzájemné zeslabování. Například rezistence k patogenům může být silně oslabena abiotickým stresem.
Rezistence rostlin se ve značné míře odráží na výnosech určité plodiny, proto je také studium rezistence rostlin k chorobám důležitým a aktuálním tématem. Řada genů determinujících rezistenci k chorobám byla identifikována klasickou genetickou analýzou. V tab. 7.1 jsou uvedeny lokusy, které se podílejí na rezistenci k houbovým patogenům u ječmene. Je zřejmé, že tyto lokusy jsou rozptýleny po všech sedmi chromozomech tohoto druhu. U mnoha chorob se na rezistenci podílí několik lokusů (genů). Polygenní charakter rezistence odpovídá předpokladu, že se na genetickém založení rezistence u ječmene podílejí různé mechanizmy.
| Patogen | Počet lokusů | Lokalizace na chromozomech |
| Puccinia hordei | 11 | 1, 2, 3, 5, 6 |
| P. graminis | 2 | 1 |
| P. striiformis | 4 | 5 |
| Ustilago nuda | 7 | 1, 5 |
| U. hordei | 4 | |
| U. nigra | 1 | |
| Erysiphe graminis f. sp. hordei | 13 | 4, 5, 6 |
| Pyrenophora teres | 4 | 2, 3, 5 |
| P. graminae | 3 | |
| Cochliobolus sativus | 4 | 2, 5 |
| Leptosphaeria avenaria f. sp. triticea | 3 | |
| Rhynchosporium secalis | 11 | 3, 4 |
| Fusarium spp. | 1 | |
| Pericularia oryzae | 1 |
Vztah gen proti genu
Rezistenci rostlin k patogenům dělíme podle genetické determinace na dva základní typy, a to horizontální a vertikální.
Horizontální rezistence
Horizontální rezistence, nebo také rasově (genotypově) nespecifická rezistence, je účinná zpravidla proti širokému spektru patotypů parazita. Tato odolnost má vlastnosti typického polygenně založeného znaku. Projevuje se u ní silná interakce genotypu s prostředím. Je označována jako polní rezistence. Podstatou rezistence je, že rostlina je schopna dokončit svůj životní cyklus dříve, než se patogen dostatečně rozšíří.
Vertikální rezistence
Vertikální rezistence je rezistence rasově specifická. Odolnost tohoto typu je řízena jedním nebo několika málo geny s velkým účinkem (majorgeny) a týká se jediného genotypu patogena. Každá alela určitého lokusu odolnosti u hostitele zabezpečuje odolnost pouze vůči jedinému genotypu patogena. Tyto různé genotypy patogena se fenotypově projevují jako tzv. fyziologické rasy, které se označují jako patotypy.
Genotypy patogena, které nejsou potlačeny genem pro rezistenci, se označují jako virulentní k hostitelské rostlině. Mohou ale být blokovány genotypem jiného jedince populace hostitele. Genotypy patogena schopné překonat různé geny rezistence hostitele se nazývají fyziologické rasy (u hub) nebo kmeny (u bakterií a virů).
Rezistence k patogenům je tím stabilnější, čím více genů hostitele se jí zúčastní. Jestliže při horizontální rezistenci je jeden gen polygenního systému eliminován mutací nebo je překonán mutací patogena, nebude to mít podstatný vliv na stupeň rezistence. Pravděpodobnost, že při horizontální rezistenci patogen překoná všechny geny pro rezistenci hostitele, je téměř nulová. Jednotlivé geny polygenního systému však nelze ve šlechtitelských programech analyzovat. Šlechtitelé se proto spoléhají především na vertikální rezistenci a kombinování více genů velkého účinku pro rezistenci do genomu. Působení genů velkého účinku lze snadno měřit. Vertikální rezistence však není trvalá. Protože mikroorganizmy se množí podstatně rychleji než rostliny, také rychleji mutují a jediná specifická mutace může překonat rezistenci hostitele.
Mezi bakteriálními geny avirulence (označovanými Avr/avr) a rostlinnými geny rezistence (R/r) existuje vztah gen proti genu, který charakterizuje interakci mezi patogenem a rostlinou (tab. 7.2).
| Hostitelská rostlina | Patogen | |
| Virulentní | Avirulentní | |
| Rezistentní | choroba se neprojeví | choroba se neprojeví |
| Náchylná | příznaky choroby | choroba se neprojeví |
Klasické metody determinace interakcí hostitel – patogen u lnu (Linum usitatissimum)
Podstata rezistence lnu (L. usitatissimum) ke rzi travní byla objasněna ve 40. a 50. letech 20. století Florem, který analyzoval křížení mezi rezistentními a náchylnými odrůdami lnu a mezi virulentními a avirulentními rasami patogena (rzi travní). Výsledky studia dědičnosti virulence patogena a dědičnosti rezistence lnu ke dvěma rasám rzi jsou uvedeny v tab. 7.3 a tab. 7.4. V tab. 7.3 je uvedena dědičnost virulence a avirulence v potomstvu dvou ras rzi (22, 24). Tab. 7.4 uvádí dědičnost rezistence a náchylnosti v potomstvu dvou odrůd lnu (Ottava, Bombay). Z tab. 7.3 vyplývá, že rasa 22 rzi je virulentní u odrůdy Ottava a avirulentní u odrůdy Bombay. F1 hyrid je avirulentní u obou odrůd. Rasy 22 a 24 jsou geneticky odlišné a tyto výsledky naznačují, že alela virulence je u obou ras recesivní (protože F1 je avirulentní u obou odrůd). Potomstvo F2 je virulentní nebo avirulentní u odrůdy Ottava a virulentní nebo avirulentní u odrůdy Bombay. Potomstvo lze klasifikovat do čtyř skupin: avirulentní u obou odrůd, virulentní pouze u odrůdy Ottava, virulentní pouze u odrůdy Bombay, virulentní u obou odrůd, přičemž počty kultur odpovídají štěpnému poměru 9 : 3 : 3 : 1. Tento mendelistický štěpný poměr se očekává, jestliže alely dvou genů segregují v meióze nezávisle a sledované geny tedy nejsou ve vazbě. Tento výsledek naznačuje, že virulence u odrůd Ottava a Bombay je determinována dvěma geny a tyto geny nejsou ve vazbě. Rasa 22 má genotyp aLaLANAN a rasa 24 má genotyp ALALanan. AL/aL a AN/aN jsou různé geny s alelou aL determinující virulenci u odrůdy Ottava a alelou aN determinující virulenci u odrůdy Bombay.
Tab. 7.4 shrnuje výsledky křížení dvou odrůd lnu Ottava a Bombay a sleduje generaci F1 a segregující generaci F2. U těchto rostlin byl testována náchylnost a rezistence vůči rzi rasy 22 a 24. Odrůda Ottava je náchylná k rase 22 a rezistentní k rase 24, zatímco Bombay je rezistentní k rase 22 a náchylná k rase 24. Potomstvo F1 získané křížením uvedených dvou odrůd je rezistentní k oběma rasám patogena. Odrůdy Ottava a Bombay jsou geneticky odlišné, a protože rostliny F1 jsou rezistentní k oběma rasám, alela pro rezistenci je dominantní o obou odrůd. Potomstvo generace F2 je možné rozdělit do čtyř skupin: rostliny rezistentní k oběma rasám, rostliny rezistentní pouze k rase 24, rostliny rezistentní pouze k rase 22 a rostliny náchylné k oběma rasám. Počty rostlin v jednotlivých kategoriích odpovídají štěpnému poměru 9 : 3 : 3 : 1. Z toho lze vyvodit jednoznačný závěr, že dva geny determinují rezistenci ke rzi rasy 22 a 24 u uvedených dvou odrůd a gen pro rezistenci vůči rase 22 není vázán s genem pro rezistenci k rase 24.
Odrůda Ottava má genotyp LLnn a odrůda Bombay má genotyp llNN. Alela L determinuje rezistenci k alele AL genotypu rzi a alela N determinuje rezistenci k alele AN genotypu rzi.
| Hostitel (odrůda) | Rasa | F1 |
F2 |
||||
| 22
aLaL ANAa |
24
ALAL aNaa |
aLAL aNAa |
AL- AN- |
aLaL Aa- |
AL- aNaN |
aLaL aNaN |
|
| Ottava (LL nn) | citlivá | rezistentní | rezistentní | rezistentní | citlivá | rezistentní | citlivá |
| Bombay (ll NN) | rezistentní | citlivá | rezistentní | rezistentní | rezistentní | citlivá | citlivá |
| Počet kultur | 78 | 27 | 23 | 5 | |||
Tab. 7.5 shrnuje možné interakce mezi sledovanými genotypy rzi a lnu. Tento model dědičnosti, který je založen na jednom genu rezistence a jednom genu virulence je znám jako model gen proti genu a byl popsán u řady virových, bakteriálních a houbových patogenů rostlin, jenž vyvolávají hypersensitivní reakci rezistence. Jedním z rysů tohoto typu interakce, jako u rezistence lnu ke rzi, je recesivní charakter alel virulence. Takové alely vznikají inaktivačními mutacemi. Tento předpoklad naznačuje, že funkční gen (alela) houbového patogena kóduje avirulentní fenotyp (viz inkompatibilní typ interakce popsaný dále).
Tento typ rezistence je velmi efektivní při ochraně vůči infekci rostlin a je široce využíván ve šlechtitelských programech. Protože však ztráta funkčních mutací vede k virulenci a protože velikost populace patogena je mnohem větší než u rostlin, je tento typ rezistence nestabilní. Během několika let po introdukci rezistentních alel do genotypu plodiny, se objevují nové mutantní typy patogenů.
Geny rezistence u lnu
Podstata rezistence lnu (L. usitatissimum) ke rzi travní (Melampsora lini) byla objasněna ve 40. a 50. letech 20. století Florem. Do dnešní doby bylo identifikováno celkem 7 lokusů (K, L, M, N, P, D, Q) se 34 geny kódujícími rezistenci lnu k tomuto patogenu. V lokusu L bylo popsána alelová série alespoň 13 alel. Každá alela má různou specifitu navozené rezistence. Lokus M je tvořen multigenní rodinou 15 genů.
| Hostitel | F1 |
F2 |
|||||
| Patogen Rasa |
Ottava
LL nn |
Bombay
ll NN |
Ll Nn |
L- N- |
L- nn |
ll N- |
ll nn |
|
22
aLaL ANAN |
náchylná | rezistentní | rezistentní | rezistentní | náchylná | rezistentní | náchylná |
|
24
ALALaNaN |
rezistentní | náchylná | rezistentní | rezistentní | rezistentní | náchylná | náchylná |
| Počet rostlin | 110 | 32 | 43 | 9 | |||
| Patogen alely genu Avr | Rostlina alely genu rezistence L | Patogen alely genu Avr | Rostlina alely genu rezistence N | ||
L |
l |
N |
n |
||
| AL | rezistentní | náchylná | AN | rezistentní | náchylná |
| aL | náchylná | náchylná | aN | náchylná | náchylná |
Inkompatibilní vztah mezi rostlinou a patogenem
Inkompatibilní vztah mezi rostlinou a patogenem je výsledkem specifického rozpoznávacího mechanizmu mezi genovým produktem rostliny a genovým produktem patogena. V důsledku tohoto rozpoznání dojde k aktivaci obranného mechanizmu, který zabrání rozšíření patogena. Kompatibilita mezi hostitelem a patogenem je důsledkem selhání aktivity obranného mechanizmu, protože jeden nebo oba potřebné genové produkty se buď nevytvářejí, nebo jsou změněny natolik, že nejsou vzájemně rozpoznány.
Koncepce genů pro avirulenci dobře vysvětluje většinu případů rezistence podmíněné geny velkého účinku. V nejjednodušším případě jde o dvojici genů, z nichž jeden je dominantní gen pro avirulenci patogena AvrL a ten je komplementován specifickou dominantní alelou genu rostliny RL. Produkt genu pro avirulenci je v interakci s produktem genu pro rezistenci za vzniku projevu rezistence rostliny. Jestliže některý z obou genů není funkční nebo jeho produkt je podstatně změněn, ke vzniku rezistence nedochází.
Ze vztahu gen proti genu je zřejmé, že rezistence může vznikat v důsledku různých typů interakcí a je podmíněna různými geny. Bylo klonováno mnoho genů pro avirulenci z genomů bakterií a některých hub, ale jejich funkce není v některých případech stále jasná. Bakteriální geny pro avirulenci, proti kterým rostlina nemá odpovídající geny pro rezistenci, se ve skutečnosti chovají jako geny pro virulenci a podmiňují patogenezi i u rezistentního hostitele. Naopak inkompatibilitní reakce vede k rychlé blokádě množení patogena v místě infekce. V důsledku toho vznikají nejprve malá ohraničená chlorotická místa a pak obvykle následují nekrózy malých sektorů pletiva (lokální léze). Tato hypesenzitivní odpověď je nespecifická a je obecným projevem rezistence, jak proti houbovým a bakteriálním patogenům, tak proti virům. Je to aktivní obranný mechanizmus, ke kterému dochází při kombinacích genotypů hostitele a patogena, které vedou k rezistenci. Je způsobena koordinovanou indukcí různých metabolických aktivit.
Při infekci a hypersenzitivní reakci je stimulována syntéza etylénu tím, že je indukován enzym ACC-syntáza, což je klíčový enzym syntézy etylénu. Etylén stimuluje nekrotizaci, ale stimuluje i mnoho dalších typů odpovědi na patogena.
Interakce mezi rostlinami rajčete a houbovým patogenem Cladosporium fulvum je ekvivalentní interakci mezi lnem a rzí Melampsora lini a je znázorněna na obr. 7.1. Gen avirulence Avr9 Cladosporium kóduje peptid, který funguje jako signální molekula (elicitor) spouštějící hypersenzitivní reakci u rajčete. Odpovídající gen rezistence u rajčete je Cf-9 a pravděpodobně kóduje receptorovou molekulu bohatou na leucin (LRR) pro Avr9 peptid. Interakce peptidu Avr9 a Cf-9 LRR receptoru pravděpodobně způsobuje konformační změny receptoru a ten může fungovat jako první signál pro buňky při HR. Jedinou možnou kombinací alel, která iniciuje HR u rajčete je dominantní alela Cf-9 a funkční alela Cladosporium Avr9. U všech dalších kombinací chybí buď receptor nebo elicitor nebo oba. HR není proto spuštěna a rostlina je náchylná k infekci Cladosporium.
Obecně podle teorie gen proti genu dochází k interakci mezi produkty genu R a genu avr formou vazby mezi receptorem a elicitorem (ligandem). Tato vazba je nezbytná pro spuštění obranné reakce rostliny.
Kompatibilní vztah mezi rostlinou a patogenem
Při kompatibilní interakci patogena a rostliny dochází k přímému ovlivnění rostliny prostřednictvím produktu genu Avr patogena bez příznaků hypersenzitivní reakce. Produktem genu Avr bývá nejčastěji toxin, který je u rezistentní rostliny (genotypu RR nebo Rr) inaktivován konkrétním enzymem, který je produktem aktivní alely genu R. Rostlina je „rezistentní“ i vůči patogenu, který neprodukuje toxin (nemá aktivní alelu). Náchylnost rostliny se projeví pouze tehdy, jestliže rostlina není schopna tvořit enzym (je genotypu rr) a je napadena virulentním patogenem, který tvoří toxin.
Obr. 7.2 znázorňuje tento typ interakce patogen – rostlina. Houbový patogen Cochliobolus carbonum (dříve Helminthosporium carbonum) způsobuje listovou skvrnitost a napadá i palice u kukuřice. Rasa1 C. carbonum tvoří cyklický tetrapeptidový toxin (tzv. HC-toxin) a tvorba tohoto toxinu kosegreguje s jedním lokusem Tox2+. HC toxin inhibuje aktivitu histonové deacetylázy, což ovlivňuje strukturu chromatinu.
Některé genotypy kukuřice jsou rezistentní k infekci C. carbonum rasy 1. Rezistence je kódována jaderným genem HM1, který je lokalizován na 1. chromozomu. Dominantní (funkční) alela genu determinuje úplnou rezistenci rostliny k C. carbonum rasy 1 a tato rezistence je způsobena tvorbou enzymu HC-toxin reduktázou, kódovanou genem HM1, který inaktivuje HC-toxin. Obr. 7.2 ukazuje, že jediná interakce, která vede k infekci, je funkční alela Tox2+ houbového patogena a absence funkční alely HM1 u rostliny. Ztráta funkčních mutací u patogena vede k avirulenci vůči všem genotypům rostlin. To znamená, že rezistence kódovaná genem HM1 vůči kompatibilnímu genu u C. carbonum je stabilnější než rezistence rostlin k inkompatibilním genům virulence určitého patogena.
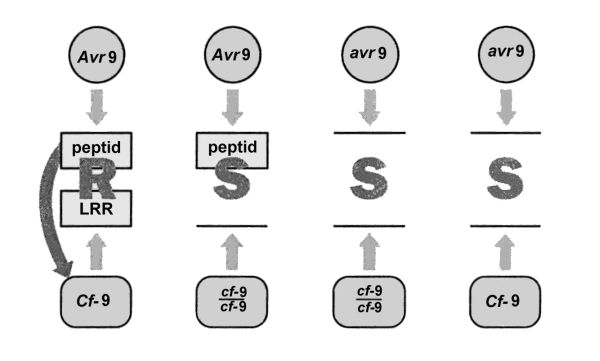
Obr. 7.1 Inkompatibilní typ interakce rostlina Lycopersicon esculentum (gen rezistence Cf-9) – patogen Cladosporium fulvum (gen avirulence Avr9)
(Zdroj: Hughes, 1996)
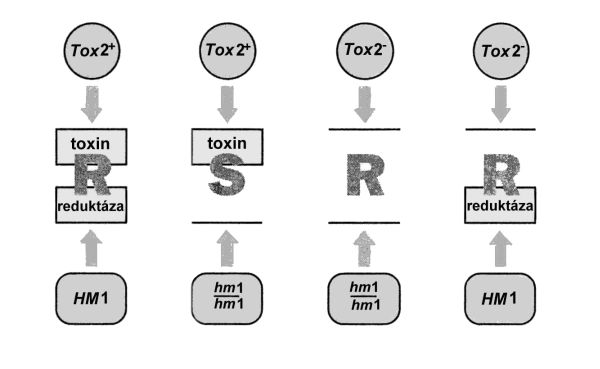
Obr. 7.2 Kompatibilní typ interakce rostlina Zea mays (gen rezistence HM1) – patogen Cochliobolus carbonum (gen avirulence Tox2+)
(Zdroj: Hughes, 1996)
Charakteristické rysy proteinů kódovaných geny R
Hlavní úlohu v přenosu signálu pro aktivaci specifických genů R pro rezistenci má přenos zprostředkovaný kinázami. Modulace fosforylovaného stavu je vůbec jeden z hlavních mechanizmů, které živé organizmy používají k řízení aktivity proteinů prostřednictvím signalizační kaskády, která vede k aktivaci specifických transkripčních faktorů, těmi se aktivují např. geny PR.
Proteiny kódované rasově specifickými geny rezistence mají charakteristickou strukturu v důsledku přítomnosti konzervovaných domén se specifickými funkcemi. Takovou významnou doménou jsou na leucin bohatá opakování LRR (angl. Leucin Rich Repeats). Obsahují zbytky leucinu nebo jiné hydrofobní aminokyselinové zbytky v pravidelných opakováních a mohly by také obsahovat pravidelně uspořádané zbytky prolinu a asparaginu. Domény LRR tvoří terciární strukturu s charakteristickým prostorovým uspořádáním, které se účastní při interakcích mezi dvěma proteiny, interakcí mezi vnitrobuněčnými komponentami kaskády přenosu signálu. Podobné domény jsou známé z interakcí proteinů u živočišných buněk, např. hormonální receptory, které rozpoznávají glykoproteinové ligandy, nebo enzymové inhibitory, které rozpoznávají enzymy. Identifikace těchto domén u produktů genů R vedla k hypotéze a předpokladu, že jde o tzv. rozpoznávací domény (charakter receptorů). Rozpoznávací domény jsou v buňkách lokalizovány buď extracelulárně (vyčnívají ven z buňky a umožňují interakci s elicitory patogena). Produkty jiných genů R mají tyto domény lokalizované v cytoplazmě, což není překvapující, protože viry se množí v buňkách, haustoria hub prorůstají do buněk.
Dále tyto proteiny často obsahují vazebné místo pro nukleotidy (NBS, angl. Nucleotide Binding Sites). Většinou toto místo zprostředkovává vazbu ATP nebo GTP. Je tedy zřejmé, že podstatnou součástí molekulárního mechanizmu rezistence je vazba nukleotidtrifosfátů na odpovídající proteiny. Tato vazba může ovlivňovat například interakci mezi proteiny, které vznikají expresí genů R s dalšími proteiny regulační kaskády. Jde o signální domény se třemi vazebnými místy. Byla potvrzena homologie s proteiny apoptózy u živočišných buněk.
Další doména je označována TIR (angl. Toll Interleukin Receptor). Název je odvozen od její homologie s doménami jiných genetických systémů, jako Toll proteinu drozofily a savčího proteinu pro receptor Interleukin-1 a další. Jde o cytoplazmatickou signalizační doménu. Proteiny s těmito doménami jsou klíčovými komponentami imunitního systému, který existuje u mnohobuněčných organizmů. Spouští řadu obranných reakcí jako je fagocytóza a exprese bakteriálních a antihoubových proteinů jako jsou defensiny.
CC domény (angl. Coiled Coil) jsou místem tvorby dimerů (u transkripčních faktorů eukaryot). Jejich funkce u produktů genů R není objasněna.
Některé proteiny obsahují leucinový zip – známou doménu jednoho z typů transkripčních faktorů, která se uplatňuje zejména při interakci dvou proteinů.
Další proteiny, kódované geny R, obsahují domény typické pro transmembránové receptory.
Mechanizmy signalizace napadení patogenem v rostlinné buňce
Indukce hypersenzitivní reakce elicitory vede k rychlým metabolickým změnám. Mění se aktivita H+-ATPázy v plazmalemě, která za normálních podmínek udržuje transmembránový potenciál tím, že přesunuje protony na vnější stranu plazmatické membrány. To vede ke snížení pH cytoplasmy a uvolnění Ca2+. Vápník jako druhý posel vede k aktivaci obranné reakce. Její podstatnou součástí je rychlé ukládání kalózy (D-1,3-vázaného polymeru glukózy, který blokuje plazmodezmata). Následují řetězce dalších biochemických dějů, které vedou k buněčné smrti. Pokud nekróza následuje několik hodin po infekci a únik patogena je blokován, léze bývají omezeny jen na sektory několika buněk.
Při infekci a hypersenzitivní reakci je stimulována syntéza etylénu tím, že je indukován enzym ACC-syntáza, což je klíčový enzym syntézy etylénu. Etylén stimuluje nekrotizaci, ale i mnoho dalších typů odpovědi na patogena.
R-proteiny působí jako receptory a detekují mikrobiální signály zprostředkované geny Avr. Ty zahrnují přímé a nepřímé produkty genů Avr patogena, látky typu chitinu, enzymů a složek buněčných stěn. Receptorové proteiny jsou produkty genů R. Mechanizmus signalizace zahrnuje aktivaci kináz, fosfatáz, G-proteinů i změn koncentrace iontů (především Ca2+). Dochází ke zvýšení hladin inozitol trifosfátů a diglycerolu a ke změnám poměru proteinů s vázaným GTP a GDP. Dochází k aktivaci superoxidů kysíku, přímé indukci transkripce genů pro obranné proteiny, genů pro indukci syntézy kyseliny jasmonové a etylénu. Rychle se zvyšuje především aktivita fenylalaninamonium lyázy (PAL) a chalkonsyntázy (CHS). Po aktivaci prvních odpovědí na patogena dochází k rychlé aktivaci dalších signálních genů a dochází k amplifikaci odpovědi. Je suprimována syntéza histonů a genů buněčného cyklu, což jednak napomáhá apoptóze a jednak umožňuje soustředit síly na obrannou reakci. V posledním stadiu dochází k uzavření plazmodezmat kalózou, v důsledku toho snížení mezibuněčné komunikace a vyhasínání obranné reakce.
Klonování genů pro rezistenci k patogenům
Molekulární analýza a klonování genů se většinou zaměřuje na rezistenci, která je kódována jedním genem. Některé geny rezistence u rostlin, které byly zatím klonovány, jsou uvedeny v tab. 7.6.
V zásadě existuje několik možností klonování genů pro rezistenci:
- Klonování náhodných sekvencí (angl. shotgun cloning), rezistentního rostlinného genomu. Po něm může následovat klonování jednotlivých sekvencí do binárních vektorů Agrobacterium a přenášení celé populace klonů do rostlinných buněk. Po transformaci rostlin, rezistentních k patogenům je možno selektovat rezistentní rostliny. Vektorový plazmid binárního vektoru, který takovouto rezistenci indukoval, pravděpodobně obsahuje hledaný gen.
- Gene tagging, tedy mutační inaktivace a označování genu. Tento přístup je využitelný zejména u Arabidopsis thaliana (T-DNA tagging) a u kukuřice (označování genu včleněním transpozonu, transpozonový tagging). K inzerci T-DNA a transpozónů dochází do více či méně náhodných míst genomu a příslušné mutace je třeba selektovat. Gen, označený včleněním T-DNA nebo transpozonu se pak dá poměrně snadno klonovat.
- Využití známé mutace pro senzitivitu v rezistentní linii k tzv. pozičnímu klonování genu. Tento přístup lze použít tam, kde je dobře vysycená molekulární genetická mapa (založená na RFLP, nebo AFLP) a mutace je v těsné vazbě s molekulárním znakem. Potom lze využít přístupu kráčení po chromozómu k nalezení kozmidového nebo jiného vektorového klonu, který pravděpodobně obsahuje daný gen. Přítomnost genu lze potvrdit jednak transgenozí a jednak sekvenováním.
Před více než dvaceti lety byl vytvořen a nyní potvrzen model “gen proti genu”. Podle něho bakteriální geny, které se podílejí na virulenci označené Avr (protože jejich mutované recesivní alely avr podmiňují ztrátu virulence). Rostlinné geny pro rezistenci se označují R. Model. Předpokládám, že geny Avr kódují elicitory, které slouží jako ligandy receptorů, kódovaných R geny.
První klonovaný R gen byl v roce 1992 gen Hm1 kukuřice, který podmiňuje rezistenci k houbovému patogenu Cochlioborus carbonum, jeho rase 1. Gen kóduje NADPH – dependentní reduktázu, která inaktivuje potenciální rostlinný toxin produkovaný tímto kmenem patogena. Zde se jedná o ne zcela typický případ rezistence, protože protein nemá interakci s genem Avr patogena, neindukuje hypersenzitivní odpověď a nemá ani další rysy typické pro projev genů rezistence.
Vzápětí byl klonován gen Pto rajčete, který podmiňuje rezistenci vůči Pseudomonas syringae pathovar tomato, který nese gen avirulence avrPto. Gen rezistence kóduje protein kinázu serin-threoninového typu. Jiné klonované geny rezistence kódují proteiny, které obsahují leucinem bohaté opakování (LRR) a řadu dalších oligopeptidových domén, které se často vyskytují v R- proteinech.
U A. thaliana byly klonovány dva geny pro proteiny SAR. První z nich na základě mutace cpr1, která se vyznačuje konstitutivní expresí PR-genů. Rostliny s tímto homozygotně recesivním genem mají konstantně zvýšenou hladinu SA a zvýšenou rezistenci k bakteriálním a houbovým patogenům. Rostliny s touto konstitutivní aktivací PR-proteinů jsou morfologicky odchylné: mají malé, úzké, tmavě zelené listy, hustě pokryté na spodní straně trichomy a dlouhá plodenství – šešule. Jiná zajímavá mutace opačného typu byla označena npr1 (nonsupresor of PR-genes). Je zde narušen proces přenosu signálu od kyseliny salicylové. Obě mutace byly detegovány u A. thaliana s chimérickým transgenem GUS pro b-glukuronidázu, jehož kódující sekvence je zapojena za promotor pro b-1,3-D-glukanázu. Mutace cpr1 byla zjištěna na základě konstitutivní exprese genu GUS, mutace npr1 na základě její absence při pěstování klíčních rostlin na mediu s kyselinou salicylovou.
Na základě poznání, že mechanizmy rezistence jsou obecné a obecné jsou i geny, které se účastní, při přenosu signálu pro rezistenci byly vybrány oligonukleotidy ze sekvenčních databází, které byly konzervativní u klonovaných genů pro rezistenci mezi tabákem a A. thaliana. Amplifikací podle DNA bramboru byly získány homology známých genů pro rezistenci a bylo zjištěno, že mohou sloužit jako sonda ke klonování předpokládaných, ale dosud neklonovaných genů pro rezistenci k háďátku a k Phytophotora infestans. To ukazuje, že geny pro rezistenci k háďátku jsou homologní ke známým, ale dosud neklonovaným genům a mohou být využity k jejich klonování pomocí PCR.
Rezistence k patogenům je tím stabilnější, čím více genů hostitele se jí zúčastní. Jestliže při horizontální rezistenci je jeden gen polygenního systému eliminován mutací nebo je překonán mutací patogena, nebude to mít podstatný vliv na stupeň rezistence. Pravděpodobnost, že při horizontální rezistenci patogen překoná všechny geny pro rezistenci hostitele, je nulová. Jednotlivé geny polygenního systému však nelze ve šlechtitelských programech analyzovat. Šlechtitelé se proto spoléhají především na vertikální rezistenci, kombinování (pyramidování) genů velkého účinku pro rezistenci v genomu. Působení genů velkého účinku lze snadno měřit. Vertikální rezistence však není trvalá. Protože mikroorganizmy se množí podstatně rychleji, než rostliny, také rychleji mutují a jediná specifická mutace může překonat rezistenci hostitele.
| Hostitel | Gen | Patogen | Gen virulence | Metoda klonování | Interakce |
| Lycopersicon esculentum | Cf-9 | Cladosporium fulvum | Avr9 | I | inkompatibilní |
| Zea mays | HM1 | Cochliobolus carbonum | Tox2 | I | kompatibilní |
| Lycopersicon esculentum | PTO | Pseudomonas syringae pv. tomato | avrPto | I | inkompatibilní |
| Arabidopsis thaliana | RPS2 | P. syringae pv. tomato, maculicola | avrRpt2 | K | inkompatibilní |
| Nicotiana tabacum | N1 | virus mozaiky tabáku | CP | I | inkompatibilní |
| Linum usitatissimum | L6 | Melampsora lini | aL6 | I | inkompatibilní |
| Hostitel | Gen | Patogen | Typ proteinu |
| Linum ussitatisimum | L, P, M | Melampsora lini | TIR-NBS-LRR |
| Nicotina tabacum | N | Virus mozaiky tabáku | |
| Arabidopsis thaliana | RPP1, RPP RPS4 | Peronospora parasitova Pseudomonas syringae | |
| Lycopersicon exculentum | Prf Mi | P. syringae Meloidogyne incognita | CC-NBS-LRR |
| brambor | Gpa2/Rx1 | Glodobera (nematoda), virus X bramboru | |
| Arabidopsis thaliana | RPS2,RPS5, RPM1 RPP8/HRT | Pseudomonas syringae Peronospora | |
| pepper | Bs2 | Xanthomonas campestris | NBS-LRR |
| Locika | Dm3 | Bremia lactuca | |
| Lycopersicon exculentum | I2 | Fusarium oxysporum | |
| Tritium aestivum | Cre3 | Heterodera avenae | |
| Oryza sativa | Xa1 Pib,Pi-ta | Xanthomonas oryzae Magnaporthe grisea | |
| Zea mays | Rp1 | Puccinia sorghi | |
| Hordeum vulgare | Mla | Blumeria graminis | |
| Arabidopsis thaliana | RRS1-R | Ralstonia solanacearum | TIR-NBS-LRR- NLS-WRKY |
| Lycopersicon exculentum | Cf-2, Cf-4,Cf-5, Cf-9 | Cladosporium fulvum | LRR-TM |
| Lycopersicon exculentum | Pto | Pseudomonas syringae | Kináza |
| Arabidopsis thaliana | PBS1 | Pseudomonas syringae | |
| Hordeum vulgare | Rpg1 | Puccinia graminis | Kináza-Kináza |
| Oryza sativa | Xa21 | Xanthomonas oryzae | LRR-TM-Kináza |
| Beta vulgaris | HS1pro-1 | Heterodera schachtii | Jedinečný |
| Arabidopsis thaliana | RPW8 | Erysiphe | |
| Hordeum vulgare | mlo* | Blumeria graminis | Membránový protein |
| Lycopersicon exculentum | Ve1 | Verticilliu albo-atrum | Glykoprotein buněčného povrchu |
| Zea mays | Hm1* | Cochliobolus carbonum | Toxin reduktáza |
LRR leucine-rich repeat, NBS nucleotide binding site, CC coiled coil, TIR Toll interleukin receptor, NLS nuclear localisation signal, WRKY transkripční factor, TM transmembrane, * rasově nespecifická rezistence
Obrana před parazity a predátory: antinutriční faktory rostlin
Parazité rostlin jsou především hmyz a háďátka (nematoda), predátoři jsou herbivorní živočichové. Rostliny se proti parazitům a predátorům (ale také proti mikroorganizmům) brání především sekundárními metabolity. Ty patří do různých skupin, jako fenoly, terpenoidy, dusíkaté sloučeniny. Některé jsou konstitutivně přítomné, jiné jsou indukovatelné. Existují ve velkém množství heterogenních skupin a zde budou uvedeny jen některé příklady.
Konstitutivně přítomné toxiny
Mnoho rostlinných druhů hromadí toxiny v průběhu celého vývoje. Například čekanka (Cichorium intybus) je chráněna třemi seskviterpenovými laktony, které jsou toxické a mají hořkou chuť. Jsou sekretovány v latexu v rostlině a hromadí se zvláště v místě poranění. Tím dochází ke kumulaci několika mechanizmů antifeedantů. Podobné hořké laktony jsou také u salátu, ale tam byla při šlechtění proti nim prováděna selekce, takže dochází k okusu slimáky a dalšími škůdci.
Indukovaná akumulace toxinů.
Syntéza toxinů může být zcela indukovaná (např. u fytoalexinů), nebo jsou toxiny v nízké hladině přítomny konstitutivně, ale jejich množství se zvyšuje při působení různých stresových faktorů. Například v rostlinách Nicotiana sylvestris je stále přítomen nikotin a nornikotin, ale jeho množství se zvyšuje na dvojnásobnou až pětinásobnou hodnotu při okusu parazity nebo mechanickém poškození.
Přednostní ochrana ohrožených pletiv
Parazity bývají ohroženy mladé listy podstatně více než listy staré. V korelaci s tím jsou toxické látky syntetizovány především mladými listy. V mladých listech kávovníku dochází k akumulaci kofeinu v množství až 4 % sušiny a se stárnutím listů se obsah kofeinu postupně snižuje. Koncentrace kofeinu v mladých kávových zrnech je asi 2 % sušiny a se zráním se snižuje na pouhých 0,24 % sušiny.
Syntéza hmyzích hormonů rostlinnými pletivy
Mnoho rostlinných druhů syntetizuje a hromadí velká množství hmyzích hormonů, jde zvláště o analog juvenoidních hormonů, které narušují normální metamorfozu hmyzu. Koncentrace aktivního analogu juvenoidního hormonu je v šáchoru (Cyperus iria) 150x vyšší, než množství v pletivech hmyzu. Kromě toho existují rostlinné analogy svlékacích hormonů hmyzu. Ty rovněž narušují metamorfózu a způsobují sterilitu hmyzu.
Variabilita chemického složení antinutričních látek a toxinů
Stromy mohou obsahovat v listech různá množství taninů (kondenzovaných fenolů), které mají svíravou chuť. Rozšířenými toxickými látkami jsou kyanogenní glykosidy. Ty jsou akumulovány ve vakuolách rostlinných buněk. Při požeru dochází k narušení vakuol a glykosidy přicházejí do styku s cytoplazmatickými lytickými enzymy za uvolňování kyanovodíku. Kyanogenní glykosidy mají hořkou chuť, a proto se jim herbivora vyhýbají.
Brukev zelná produkuje isothiokyanáty (hořčičné oleje), které vznikají hydrolýzou glukosinolátů po poranění.
Uchovávání sekundárních metabolitů v rostlině
Sekundární metabolity jsou toxické i pro rostlinu, která je produkuje. Jsou obvykle uchovávány v neaktivních formách jako glykosidy, estery nebo peptidy. V této formě jsou zpravidla rozpustnější a obvykle jsou uloženy ve vakuolách. Jsou uvolňovány při narušení pletiva parazity nebo herbivory. Mohou však někdy být také uchovávány v trichomech (zvláště terpenové oleje v sekrečních trichomech). Trichomy mohou po narušení produkovat nejen toxiny, ale také šťávu, která má lepkavou konsistenci a způsobuje přilepení hmyzích škůdců k rostlině a jejich úhyn.
Inhibitory proteáz
Poranění rostlin v důsledku napadení parazity a predátory vede k indukci syntézy inhibitorů proteáz, které působí na živočišné a mikrobiální, ne však na rostlinné proteázy. Proteázy blokují odbourávání v potravě přijatých proteinů a působí tak jako antifeedanty. Jsou to polypeptidy, různé inhibitory trypsinu a chymotrypsinu, které byly zjištěny v listech bramboru a rajčete, v semenech vikvovitých rostlin a jinde. Poranění nejprve uvolňuje endogenní elicitor, nazvaný indukční faktor inhibitoru proteázy. Současně vzniká látka, která proniká do ostatních částí rostliny a rovněž indukuje (na úrovni transkripce) syntézu inhibitorů proteáz. Ty se pak hromadí ve vakuolách a rostliny jsou připraveny na obranu před cizopasníky.
Systemin je signální molekula, peptid o osmnácti aminokyselinách, a je to forma prekurzorového proteinu, která vzniká po poranění. Dochází k jejímu transportu na vzdálená místa a tam se váže na receptorové molekuly na cytoplazmatické membráně buněk listů. Ty uvolňují hormon, kyselinu jasmonovou, a ta již pravděpodobně přímo indukuje syntézu inhibitorů proteáz. Transgenoze tabáku genem pro inhibitor proteázy rajčete s konstitutivním promotorem vedla k rezistenci k larvám motýla Manduca sexta.
U rostlinných zásobních orgánů (semen, hlíz) jsou inhibitory proteáz konstitutivně přítomny. Uplatňují se tam současně jako frakce zásobních proteinů.
On-line prezentace
Ke kapitole Odolnost rostlin k patogenům.
ÚEB Biol, Přírodovědecká fakulta, Masarykova univerzita |
Návrat na úvodní stránku webu, přístupnost |
| Servisní středisko pro e-learning na MU
| Fakulta informatiky Masarykovy univerzity, 2013
Centrum interaktivních a multimediálních studijních opor pro inovaci výuky a efektivní učení | CZ.1.07/2.2.00/28.0041

