VIII. třída: Silikáty
Silikáty (křemičitany) tvoří nejpočetnější třídu, kam patří asi 1/3 všech minerálů z celkem cca čtyř tisíc dosud známých ze zemské kůry. Hmotnostní podíl v zemské kůře je ještě výraznější, silikáty v ní tvoří objemem cca 75 %. Význam prvku křemíku v geochemii zemské kůry stoupá připočtením ještě 12 % volného SiO2 (křemen, opál). Mnohé silikáty jsou nejdůležitějšími horninotvornými minerály.
Silikáty jsou podstatně zastoupeny téměř ve všech ložiskách užitkových minerálů, nejen jako doprovodné minerály rudních ložisek (hlušina), ale mnohdy jako nositelé cenných kovů (Ni, Zn, Be, Zr, Li, Cs, Rb, U, vzácných zemin ap.).
Některé silikáty jsou cennými užitkovými nekovovými minerály - azbest, kaolín, hlinky a živce, jako surovina pro ohnivzdorné výrobky a keramiku, různé stavební hmoty ap. Mnohé silikáty jsou odedávna používány jako drahé a ozdobné kameny - smaragd, akvamarín, turmalín, topaz, rodonit, nefrit, granáty aj. Hlavní prvky, které se zúčastňují stavby silikátů jsou: Na, K, Li, Ca, Mg, Fe2+, Fe3+, Mn2+, Be, Al, B, Si, Zr, Ti, O, F, H (jako H+, [OH]- a H2O).
Podle dřívější, pouze chemické klasifikace, byly silikáty odvozovány ze solí hypotetických kyselin: křemičitých, alumokřemičitých, titano-zirkono-křemičitých ap. přičemž kyseliny křemičité se formálně odvozovaly slučováním jejich anhydridu SiO2 s vodou v různých poměrech:
- H4SiO4 (SiO2 : H2O = 1:2) - kyselina ortokřemičitá
- H6Si2O7 (SiO2 : H2O = 2:3) - kyselina diortokřemičitá
- H4Si3O8 (SiO2 : H2O = 3:2) - kyselina triortokřemičitá
- H2SiO3 (SiO2 : H2O = 1:1) - kyselina metakřemičitá
- H2Si2O5 (SiO2 : H2O = 2:1) - kyselina dimetakřemičitá
Silikáty, tedy soli těchto kyselin, se pak označovaly jako ortosilikáty, diortosilikáty, triortosilikáty, metasilikáty, dimetasilikáty, pyrosilikáty (soli kyseliny H6Si2O7) atd.
Novější krystalografické výzkumy struktury silikátů prokázaly, že jejich základní stavební jednotkou je křemíko-kyslíkový tetraedr [SiO4]4-, který je tvořen malým centrálním atomem křemíku, jenž je obklopen čtyřmi velkými atomy kyslíku, nacházejícími se ve vrcholech tetraedru.
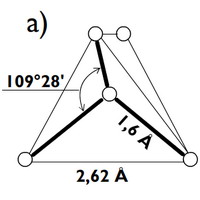
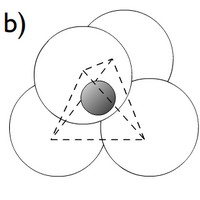
b) schematické znázornění téhož tetraedru s reálným poměrem ve velikosti atomů (atom křemíku je šrafovaný a je skryt v "dutině" mezi relativně velkými atomy kyslíku)
Tyto tetraedry mohou ve struktuře silikátů existovat jako samostatné strukturní jednotky nebo se mohou vzájemně spojovat do složitějších útvarů, přičemž ke spojení tetraedrů dochází sdílením jednoho kyslíkového atomu dvěma sousedními tetraedry (dva sousední tetraedry jsou spojeny rohem, nikdy ne hranou nebo plochou).
Ve struktuře silikátů může být určitá část centrálních atomů Si nahrazena atomy Al. Jde v podstatě o nahrazení části tetraedrů [SiO4]4- tetraedry [AlO4]5- (tzv. alumosilikáty).
K uvedené substituci (zastoupení) křemíku hliníkem dochází pouze u určitých strukturních typů silikátů.
Způsob vzájemného spojení křemíko-kyslíkových (hliníko-kyslíkových) tetraedrů ve struktuře silikátů předpokládá rozdělení této třídy na 6 oddělení:
- nesosilikáty
- sorosilikáty
- cyklosilikáty
- inosilikáty
- fylosilikáty
- tektosilikáty
1. Nesosilikáty (křemičitany s izolovanými tetraedry)

V tomto typu silikátů je křemíko-kyslíkový tetraedr [SiO4]4- samostatnou strukturní jednotkou . Vazba těchto izolovaných samostatných tetraedrů je uskutečňována pomocí tzv. vnějších kationů, které se nachází v mezerách mezi tetraedry.
2. Sorosilikáty (křemičitany s izolovanými skupinami tetraedrů)

Ve struktuře sorosilikátů se až na nepatrné výjimky setkáváme s dvojicemi křemíko-kyslíkových tetraedrů, tzv. diortogrupami [Si2O7]4-. Součástí struktury sorosilikátů mohou být i samostatné tetraedry [SiO4]4-. K sorosilikátům však náleží i silikáty, které místo diortogrupy obsahují lineárně uspořádané trojice tetraedrů [Si3O10]8-, popř. i pětice tetraedrů [Si5O16]12-.
3. Cyklosilikáty (křemičitany s kruhovou vazbou tetraedrů)

V tomto oddělení silikátů jsou křemíko-kyslíkové tetraedry cyklicky uspořádány do prstenců, které jsou nejčastěji trojčetné [Si3O9]6-, čtyřčetné [Si4O12]8- nebo šestičetné [Si6O18]12-, avšak může jít např. i o zdvojené šestičetné prstence [Si12O30]12-, které jsou tvořeny dvěma nad sebou ležícími a šesti atomy kyslíku spojenými šestičetnými prstenci.
U cyklosilikátů podobně jako u nesosilikátů a sorosilikátů nedochází k zastupování křemíku hliníkem - výjimkou je komplikovaná struktura cordieritu s anionovou skupinou [AlSi5O18]13-.
4. Inosilikáty (křemičitany s řetězovitou vazbou tetraedrů)

Ve struktuře inosilikátů jsou křemíko-kyslíkové tetraedry uspořádány do nekonečných řetězců, které mohou být jednoduché (u pyroxenů), dvojité (u amfibolů), nebo vzácněji i vícenásobné. U jednoduchých řetězců sdílí každý tetraedr dva atomy kyslíku se sousedními tetraedry. Vůči ose řetězce jsou sousední tetraedry zpravidla různě orientovány, avšak lze pozorovat, že v určité periodě se polohy tetraedrů opakují.
Podle počtu tetraedrů v periodě se rozlišují jednoduché dvojčlánkové řetězce se vzorcem anionu základní periody [Si2O6]4-. Jednoduché trojčlánkové řetězce se vzorcem [Si3O9]6- a jednoduché vícečlánkové řetězce (pozn.: jednoduché jednočlánkové řetězce nejsou u minerálů známy). Struktura dvojitých nebo vícenásobných řetězců je tvořena dvěma nebo více souběžně probíhajícími řetězci tetraedrů, které jsou v periodicky se opakujících vzdálenostech propojeny atomem kyslíku, jenž leží ve vrcholu dvou tetraedrů, náležejících ke dvěma různým řetězcům. Z dvojitých řetězců jsou nejběžnější dvojité dvojčlánkové řetězce se skupinou [Si2O5]2-. Vícenásobné řetězce jsou u přírodních inosilikátů vzácné. Ve struktuře inosilikátů někdy dochází k zastupování křemíku hliníkem.
5. Fylosilikáty (křemičitany s plošnou vazbou tetraedrů)

Ve struktuře fylosilikátů jsou křemíko-kyslíkové tetraedry uspořádány do vrstev (do nekonečných dvojrozměrných sítí), přičemž je v těchto vrstvách každý tetraedr propojen třemi vrcholy se třemi sousedními tetraedry. Anionová kostra fylosilikátů může mít, podobně jako kostra inosilikátů, různý charakter.
Nejčastěji je základní strukturní perioda fylosilikátů tvořena čtyřmi tetraedry - v tomto případě má anionová skupina vzorec [Si4O10]4-, avšak velmi často je v této skupině 1/4 nebo 1/2 atomů křemíku zastoupena atomy hliníku a anionová skupina má potom vzorec [AlSi3O10]5- nebo [Al2Si2O10]6-.
6. Tektosilikáty (křemičitany s prostorovou vazbou tetraedrů)
Křemíko-kyslíkové tetraedry jsou vázány do trojrozměrné prostorové kostry. V ní je každý tetraedr propojen všemi svými vrcholy se čtyřmi sousedními tetraedry a atomy křemíku a kyslíku jsou v této struktuře přítomny v poměru 1:2. Uvedenému poměru odpovídá vzorec SiO2 a mezi tektosilikáty, tvořenými pouze tetraedry [SiO4]4-, by tedy patřily jen různé modifikace SiO2 (křemen, tridymit, cristobalit aj.), s nimiž mají podobnou mřížku.
Existence tektosilikátů odlišného chemického složení je umožněna nahrazením určité části (max. 50 %) atomů křemíku v centru tetraedrů hliníkem (méně často i bórem nebo železem). Touto substitucí (nahrazením) dochází k valenční nerovnováze, která je kompenzována vstupem vhodných kationů do dutin v anionové kostře, např. ve struktuře draselného živce o vzorci K[AlSi3O8] má 1/4 tetraedrů ve svém centru hliník a v dutinách anionové kostry je přítomen draslík.
Pozn.: při psaní chemických vzorců je vhodné jejich anionovou kostru uzavřít do hranaté závorky a tak ji oddělit od katiotové části vzorce (u silikátů se složitější strukturou je používání hranaté závorky nezbytné). Pokud jsou v aniotové kostře silikátu přítomny různé skupiny tetraedrů nebo i přídatné aniony, oddělují se ve vzorci svislými čarami, přičemž přídatné aniony se uvádějí zpravidla před tetraedrickými skupinami. Kationy jsou ve vzorci umístěny před hranatou závorkou v pořadí, které odpovídá jejich klesající velikosti; při izomorfní substituci značky prvků za sebou následují v pořadí podle klesajícího zastoupení. Uvedené zásady lze doložit např. na poměrně složitém vzorci vesuvianu Ca10(Mg,Fe)2Al4[(OH)4|(SiO4)5|(Si2O7)], nebo na vzorci muskovitu KAl2[(OH,F)2|AlSi3O10].
1. oddělení: Nesosilikáty
Nesosilikáty (chemicky ortosilikáty) mají typické fyzikální vlastnosti, podmíněné vlastnostmi kompaktních krystalových mřížek. Habitus krystalů bývá izometrický. Vysoká tvrdost a značně zvýšená hustota jsou dány hustým uspořádáním iontů v mřížce a to má za následek zvýšený index lomu světla. Mezi základní nesosilikáty patří zirkon, olivín, topaz, kyanit, andalusit, sillimanit, staurolit, granáty, vesuvián a titanit.
2. oddělení: Sorosilikáty
Z chemického hlediska sem patří tzv. pyrosilikáty. Nejvýznamnější sorosilikáty jsou hemimorfit a epidot.
3. oddělení: Cyklosilikáty
Hlavními cyklosilikáty jsou beryl, cordierit a turmalíny.
4. oddělení: Inosilikáty
Nejdůležitějšími inosilikáty (dříve označované podle chemizmu jako metasilikáty) jsou pyroxeny a amfiboly, dále pak wollastonit. Jejich společnými znaky jsou např. analogický krystalový habitus, blízké krystalové struktury, stejná štěpnost, podobná tvrdost a hustota. V pyroxenech a amfibolech bývají jako kationy tyto prvky: Mg2+, Fe2+, Ca2+, Na+, někdy Li3+, Al3+ a Fe3+. Na stavbě anionů se zúčastňují radikály [SiO4]4-, i [AlO4]4-, [OH]-, F- a Cl- (v amfibolech). V přírodě jsou nejrozšířenější (16 % hmotnosti) pyroxeny a amfiboly, které jsou důležitými horninotvornými minerály mnohých hornin magmatických a metamorfovaných. Je pro ně charakteristické, že mají výraznou štěpnost a že krystalová individua jsou protáhlá v jednom směru.
Přes mnoho společného, odlišují se pyroxeny a amfiboly od sebe podstatně takto:
v krystalových strukturách pyroxenů jsou zastoupeny aniontové radikály složené z jednoduchých řetězců křemíko-kyslíkatých tetraedrů, v amfibolech složené z dvojitých řetězců; z těchto typů struktur vyplývají rozdílné úhly prizmatické štěpnosti pyroxenů a amfibolů, rovnoběžně s protažením řetězců.
Štěpné linie pyroxenů tvoří útvary blízké čtverci s úhlem 87°, u amfibolů mají tvar kosočtverce s úhlem 124°. Krystaly pyroxenů mají na příčném průřezu pseudotetragonální tvary a krystaly amfibolů pseudohexagonální tvary.
V oddělení inosilikátů rozlišujeme dvě skupiny minerálů:
1. skupina pyroxenů
s jednoduchými řetězci tetraedrůObecný vzorec je ABSi2O6, kde
A = Ca, Fe2+, Li, Mg, Na
B = Al, Cr3+, Fe2+, Fe3+, Mg, Mn2+, Sc a část křemíku může být nahrazena hliníkemPatří sem:
- a) klinopyroxeny (tj. jednoklonné pyroxeny), kam patří pyroxeny dipsid hedenbergitové řady, augit a alkalické pyroxeny egirín-jadeitové řady
- b) ortopyroxeny (tj. kosočtverečné pyroxeny) enstatit-ferrosilitové
řady
Klinopyroxeny jsou diopsid, hedenbergit, augit, jadeit, egirín a spodumen. Ortopyroxeny jsou enstatit a hypersten.
2. skupina amfibolů
s dvojitými řetězci tetraedrůObecný vzorec je A0-1B2Y5Z8O22(OH,F,Cl)2, kde
A = Ca, Na, K
B = Ca, Fe2+, Li, Mg, Mn2+, Na
Y = Al, Cr, Fe2+, Fe3+, Mg, Mn2+, Ti
Z = hlavně Si, ale i Al a TiPatří sem:
- a) klinoamfiboly (tj. jednoklonné amfiboly)
- b) ortoamfiboly (tj. kosočtverečné amfiboly)
Nově jsou amfiboly děleny podle chemizmu na:
- Ca-amfiboly
- Fe-Mg-Mn amfiboly
- Na-Ca amfiboly
- alkalické amfiboly
Klinoamfiboly jsou hornblenda, tremolit, aktinolit a glaukofán. Ortoamfibol je antofylit.
5. oddělení: Fylosilikáty
Do tohoto oddělení patří především slídovité silikáty (mastek, slídy, chlority, serpentin) a jílové minerály (kaolinit, illit, montmorillonit a nontronit), s typickou vrstevnatou šesterečnou (hexagonální) nebo pseudohexagonální krystalovou mřížkou. Je pro ně charakteristické, že vždy obsahují hydroxyl OH, často spolu s F. Kationy jsou spolu s hydroxylovými skupinami bezprostředně spojené s vrstvami křemíko-kyslíkatých tetraedrů.
Ve fylosilikátech jsou zastoupeny jako kationy Mg2+ a Al3+ a kromě toho prvky, které je mohou izomorfně zastupovat - Fe2+, Ni2+,(Mn2+), Li+ a Fe3+, zřídka Cr3+ a V3+. Mnohé minerály, které mají ve mřížkách tetraedry SiO4 částečně zaměněné za tetraedry AlO4 obsahují kromě toho velké doplňkové kationy K+, Na+, Ca2+ a molekuly vody. Fyzikální vlastnosti vyplývají z krystalové struktury.
Stavba rovinných sítí se odráží především v hexagonálně souměrném habitu krystalů, dále v tzv. nárazových a tlakových trhlinkách na štěpných tabulkách. Vrstevnatá stavba krystalové mřížky podmiňuje výbornou štěpnost těchto minerálů až na jemné lupínky. Stupeň jejich pružnosti je různý. Obecný vzorec slídovitých silikátů je (K,Na)(Al,Fe,Mg)2-3(OH,F)2(Si,Al)4O10.
6. oddělení: Tektosilikáty
Toto oddělení minerálů je nejdůležitější ve třídě silikátů pro své obrovské rozšíření v zemské kůře.
Tektosilikáty se vyznačují trojrozměrnými kostrovitými mřížkami, složenými z anionových tetraedrů (Si,Al)O4. Chemicky jsou to téměř výlučně alumosilikáty, tzn. že v krystalových strukturách sloučenin jsou v anionových komplexech nejen tetraedry SiO4, ale i tetraedry AlO4. Počet iontů Si4+, zaměňovaný ionty Al3+, nepřevyšuje nikdy polovinu. Poměry Si:Al bývají buď 3:1 nebo 1:1, tj. komplexní aniony mají formu: Si3AlO8 nebo SiAlO4(Si2Al2O)8. Poměr (Si + Al):O v anionových radikálech je vždy 1:2. U živců a zeolitů, které jsou spolu s foidy hlavními představiteli tektosilikátů, byly zjištěny tyto hlavní typy anionových radikálů: [Si3AlO8]-, [Si2Al2O8]-, [Si3Al2O10]2-.
Fyzikální vlastnosti tektosilikátů mají některé zvláštnosti - nápadná je světlá barva, nejmenší index lomu světla ze všech oddělení silikátů, tvrdost minerálů je dosti vysoká (mezi 5 - 6,5), štěpnost je dobrá až velmi dobrá jen podle některých směrů (na rozdíl od strukturně podobného křemene, kde je ve všech třech směrech stejná) a výrazná náklonnost k vytváření dvojčatných srůstů (v důsledku jejich vysoké symetrie krystalových struktur).
prof. RNDr. Miloš Suk, DrSc. |
Pedagogická fakulta, Masarykova univerzita |
Vstoupit na úvodní stránku webu |

| Servisní středisko pro e-learning na MU, 2007
| Stránky střediska na Elportále