Pozorování bakteriálních endospor a jejich barvení, negativní barvení
Cíl cvičení
- Zvýraznění buněk rodu Bacillus negativním barvením (nefixovaný preparát).
- Pozorování bakteriálních endospor rodu Bacillus v nativním preparátu (fázový kontrast).
- Zvýraznění pouzder rodu Azotobacter negativním barvením (nefixovaný preparát).
- Barvení spor.
Úvodní slovo
Kromě rostoucích a dělících se vegetativních buněk nacházíme u prokaryot i struktury dovolující přežití nepříznivých podmínek – endospory. Endospory jsou odolná klidová stádia. V buňce prokaryot je přítomna pouze jedna endospora, která obsahuje peptidoglykan zcela odlišného charakteru než peptidoglykan v buněčné stěně buňky. Makromolekuly jsou v endospoře stabilizovány přítomností specifických bílkovin, snížením množství vody a zvýšením obsahu vápníku. Vápník je v endospoře vázán v kyselině dipikolinové, která je v přírodě přítomna pouze uvnitř bakteriálních endospor a zajišťuje její termorezistenci. Endospory jsou díky četným obalům různého charakteru odolné k působení UV a γ záření, vysoušení, lysozymu, teplotním změnám, nedostatku živin a působení mnoha dezinfekčních prostředků, v etanolu mohou přežívat i několik měsíců. Endospory jsou prostředkem šíření bakterií i na značné vzdálenosti a v různém prostředí. Tvorba endospory není odpovědí na vnější prostředí, ale přípravou na nepříznivé podmínky. Endospory jsou vysoce světlolomné útvary. Endospory jsou nereproduktivní struktury tvořené malým počtem převážně grampozitivních bakterií (např. Bacillus, Clostridum, Thermoactinomyces, Desulfotomaculum, Sporosarcina, Sporolactobacillus, Oscillospira).
Klinicky, farmaceuticky a technologicky významné jsou termostabilní endospory zejména rodů Bacillus a Clostridium. Bakteriální endospory jsou významným prostředkem bioterorizmu (např. Bacillus anthracis - anthrax). Některé endospory jsou používány jako biopesticidy (např. Bt toxin, bílkovina spor Bacillus thuringiensis var. israelensis). Endospory obsahují na svém povrchu proteiny, peptidy či enzymy, které se využívají jako specifické sondy nebo mají biokatalytickou funkci. Modifikované endospory B. subtilis se používají jako vehikula vakcín a jiných farmak, např. povrchové proteiny endospor B. subtilis, které obsahují fragment C tetanového toxinu; alfa toxin Clostridium perfrigens používaný pro orální a nazální imunizaci člověka i zvířat. Endospory jako transportéry farmak dodávají teplotní stabilitu, flexibilitu pro genetické modifikace a nenákladný proces přípravy.
Zatímco toxiny sporulujících druhů jsou většinou termolabilní, jsou inaktivovány již po 5 minutách při teplotě 60 °C, endospory jsou velmi odolné. U druhu Clostridium botulinum sporulující buňky odolávají 90 minut teplotě 100 °C, nesporulující buňky hynou po 30 minutách při 70 °C. Endospory Clostridium tetani (původce tetanu) jsou inaktivovány po 20 minutách při 121 °C při tlaku 0,2 Mpa a po 90 – 180 minutách při 160 - 200 °C suchého tepla. Endospory jsou vysoce termorezistentní, přežijí až pětihodinový var. Pro ověření správného průběhu sterilizace se využívají endospory Geobacillus stearothermophilus, které přežijí při 120 °C až 12 minut.
Sporicidních látek je málo a jsou nákladné. Příkladem je etylenoxid, β-propionlakton, koncentrované louhy a kyseliny, formaldehyd při prodloužené expozici, kyselina peroctová, jodové preparáty, chloramin.
Stavba zralé bakteriální endospory (obr. 41)
Jádro spory tvoří sporoplast (též protoplast). Stroma endospory představuje gelovou matrix tvořenou bakteriálním jaderným ekvivalentem (nukleoidem), ribozomy, kalcium dipikolinátem (až 10 % sušiny endospory) nebo pyridin-2,6-dikarboxylovou kyselinou, která nahrazuje vodu při udržování kvarterní struktury při vazbách, SASPs (small acid-soluble proteins), které jsou pevně svázány s nukleovou kyselinou a zabezpečují její kondenzaci a rezistenci vůči UV záření a DNA-ničících chemických látek. Přítomny jsou polyaminy, aminokyseliny a 3-fosfoglycerát. V jádře endospory jsou u některých druhů přítomny specifické látky ve formě krystalků, toxinů. Jádro je obaleno vnitřní lipoproteinovou membránou, intinou, která brání prostupu chemických látek z prostředí. Zbytky původní buněčné stěny mateřské buňky slouží jako základ nové buněčné stěny při klíčení endospory. Kortex, který se skládá z vnitřní (20 %) a zevní části (80 %), zajišťuje nepropustnost a po dehydrataci jádra termorezistenci, je nebarvitelný a je tvořen peptidoglykany. Zhruba 20-30 % peptidoglykanových jednotek je shodných s jednotkami peptidoglykanu buněčné stěny, zbylých 50-60 % jednotek představuje N-acetylmuramovou kyselinu modifikovanou na N-acetylmuramyl–laktam, dalších 18-20 % kyseliny N‑acetylmuramové je spojeno s L-alaninem namísto tetrapeptidu. Tyto modifikace jsou zajišťovány membránově vázanými enzymy. Perikortikální vnější lipoproteinová membrána pláště, extina, se skládá z proteinů bohatých na cystein, zajišťuje odolnost k působení chemikálií. Exosporium není přítomno u všech taxonů, uděluje buňce odolnost vůči chemickým látkám a enzymům.

Tvar a umístění endospory (obr. 42) v buňce je významný charakteristický znak, který pomáhá identifikaci. Např. druhy Bacillus anthracis, B. cereus, Clostridium botulinum mají vždy oválné endospory, druhy Clostridium tetani, Bacillus sphaericus mají kulaté enodspory. Hodnotí se, zda a ve kterém místě endospora vyklenuje buňku. Uložení v buňce může být terminální (na konci tyčinky, např. C. tetani - paličky, Geobacillus stearothermophilus), centrální (C. histolyticum, C. novyi, C. septicum, B. anthracis, B. cereus) nebo nejčastěji subterminální, též paracentrální, (mezi středem a pólem buňky, např. C. botulinum, C. sporogenes, B. brevis).

Neobarvené endospory můžeme pozorovat fázovým (zářící spory; až po vzniku kortexu, který udává světlolomnost) a Nomarského kontrastem (plastický povrch buňky, pouze pokud spora vyklenuje buňku), jednoduchým barvením (pouze pokud spora vyklenuje buňku).
Přímé obarvení endospory je možné při vzniku prospory (vznik kortexu), která je pro barvivo propustná. Spory špatně přijímají barvivo i po fixaci preparátu vzhledem k rigidnímu špatně propustnému kortexu, proto se obarví až během varu pomocí koncentrovaných barviv nebo mořidel (podobně např. acidorezistentní bakterie, které se Gramovým barvením neobarví vzhledem k obsahu mykolových kyselin v buněčné stěně). Příkladem barvení endospor je Wirtz-Conklinova a Schaeffer-Fultonova metoda. Obarvené endospory se těžko odbarvují kyselinami a jinými sloučeninami (např. alkoholem).
Barvitelnost endospor závisí na vývojovém stádiu sporulující buňky, je podmíněna stářím kultury, kvalitou živné půdy, individuálními vlastnostmi mikroorganizmů, a proto nelze barvících metod používat schematicky. Barvitelnost endospor se zlepší použitím sporulačních médií s přídavkem manganu.
Nativní preparát pozorovaný fázovým či Nomarského kontrastem umožňuje pozorování skutečného tvaru a struktury buněk neporušených fixací a barvením, dále pozorování růstu, množení a pohybu bakterií. V diagnostické praxi má význam při studiu světlolomných buněčných útvarů, které se obtížně barví (např. endospory).
Fázový kontrast využívá odlišné světlolomnosti částic v pozorovaném objektu. Různé struktury buňky mají různé indexy lomu světla a vznikající obraz je výsledkem složení obrazů vln s posunutou fází a vln odkloněných od preparátu. Tmavé endospory se v preparátu jeví jako zářící objekty.
Sporulace - proces vzniku endospory
Ke studiu sporulace se využívá zejména rodu Bacillus, především druh B. subtillis. Sporulace probíhá i při dostatku živin zejména ve stacionární fázi. Během sporulace B. subtillis lze rozlišit několik fází (obr. 43), které lze charakterizovat morfologicky a na molekulárně biologické úrovni. Za vznik endospory zodpovídá asi 50 genů a celý proces trvá průměrně 6–7 hodin. V průběhu vzniku přepážky je jasné, zda vznikne vegetativní buňka nebo endospora. V případě vzniku endospory buňka přechází od binárního dělení k dělení asymetrickému.
Prospora se utváří v tzv. sporogenní zóně. Primárně se přepisují geny, které připraví prostor pro endosporu, zvyšuje se množství volutinu, které lze zjistit barvením. Dochází ke zvýšení množství enzymů, buňka zvyšuje spotřebu acetátu, a navyšuje počet enzymů Krebsova cyklu a hydroláz. Na procesu sporulace se podílí amylázy, proteázy, fosfatázy, DNázy. Axiálních filamenta slouží k rozbalení nukleoidu do dlouhého vlákna a replikaci. Vytváří se septum, které postupně rozdělí buňku na dvě nestejné části, je ukončena replikace buněčného genetického materiálu, který se rozestoupí pólům buňky. DNA endospory již není aktivní. Sporogenní zóna je homogenizovaná a zahuštěná. Má vždy jinou hustotu než zbylý obsah buňky. Cytoplazmatická membrána proliferuje kolem obou částí buňky, u prespory dochází k zaobalení dvěma membránami, intina a extina, vchlípením cytoplazmatické membrány. Do prespory se vkládá mnoho vápníku a syntetizuje se v ní kyselina dipikolinová, vzniká prospora. Ubývá volutinu. Prospora není světlolomná, nesvítí při mikroskopii ve fázovém kontrastu. Proces sporulace je již nevratný. Tvorba kortexu spory s odlišným složením peptidoglykanu od složení peptidoglykanu buněčné stěny je řízena chromozomem mateřské buňky. Při vzniku kortexu je obsah volutinu již minimální. Ve spoře je obsažena kyselina dipikolinová, která je syntetizována mateřskou buňkou, její množství je regulováno. Kalcium dipikolinát je charakteristická složka přítomná pouze v endosporách bakterií. Endospora je již světlolomná, se vznikem kortexu je nepropustná pro barvivo, obarvitelná až při výstupu par. Probíhá syntéza dvouvrstevného pláště. U zástupců rodu Bacillus vzniká exosporium složené z 10 proteinů, polysacharidů a lipidů. Unikátnost bílkovin pláště je sledována chemotaxonomickými metodami. Probíhá maturace endospory, lyze mateřské buňky a uvolnění zralých spor. Následuje kryptobiotická fáze volné zralé endospory, která ve vhodných podmínkách může a nemusí klíčit. Její vnější architektura, počet a tvar plášťů je druhově specifická.
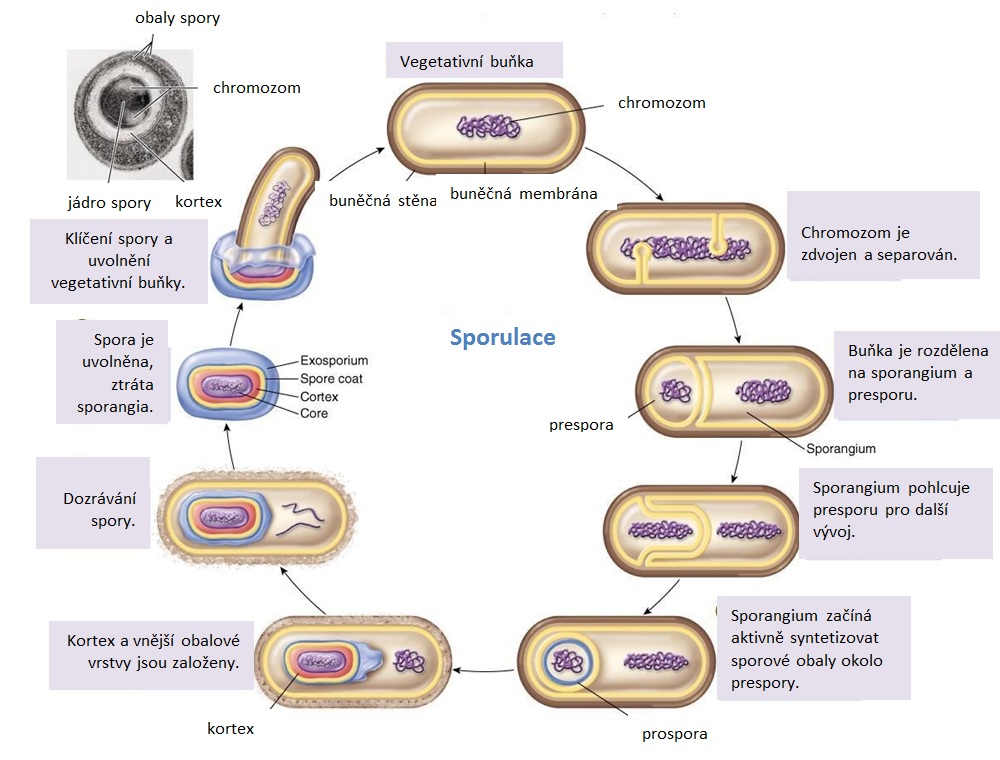
Germinace bakteriální endospory
Germinace (klíčení endospory, obr. 44) začíná spontánní aktivací endospory. Dochází k destabilizaci pláště, v laboratorních podmínkách při působení teploty 70–85 °C po 5–10 minutách, dalšími aktivátory jsou malé organické molekuly. Aktivovaná endospora přijímá vodu a ztrácí rezistenci. Bílkovinné stabilizátory jako vnitřní součásti se začínají rozkládat. Vzniklé aminokyseliny slouží pro tvorbu nových proteinů. Nejprve je ovlivněna proteosyntéza (degradační enzymy). V momentě, kdy buňka vytváří energii, začíná fungovat regulační aparát chromozomu (ATP = signál aktivace chromozomu). Prvními funkčními enzymy jsou glykozidázy pro metabolizování kortexu. Následuje rozklad extiny (fosfolipidy, bílkovina, polysacharid). Lytický enzym kortikohydroláza depolymerizuje kortex pro průnik vody. Dvě hodiny po germinaci endospory dochází k dělení vegetativní buňky. Podle lokalizace klíčení endospory rozeznáváme germinaci terminální (na pólech buňky) a centrální. Germinaci je možné inhibovat přítomností aminokyseliny D-Ala, MgCl2 a inhibitorem proteáz, fenylmetylsulfonylfluoridem.

Cysty rodu Azotobacter
Cysty jsou klidová stádia obklopená pláštěm (obr. 45), který je chrání před chemickým a fyzikálním stresem (např. vysychání, záření). Cysty rodu Azotobacter obsahují alkylresorcinol, alginát, polyhydroxybutyrát a polysacharidy. Cysta se skládá z oválné buňky, centrálního těla obklopeného dvouvrstvou kapsulou. Cysty jsou vůči nepříznivým podmínkám více odolné než vegetativní buňky, ale méně než endospory.

Bakteriální pouzdra
Polysacharidové či bílkovinné pouzdro lemuje bakteriální buňku a v prostředí ji chrání proti vysychání, jedům a nepříznivým faktorům. V živočišném těle bakterii maskuje před imunitní odpovědí makroorganizmu (maskování antigenu, větší odolnost, faktor virulence). Bakterie, které tvoří pouzdra, na misce rozeznáme podle charakteristického mohutně slizovitého vzhledu. Velké kolonie téměř splývají na médiu a za kličkou se táhnou. Pouzdro je jasně oddělené od prostředí, na rozdíl od slizu, který je více rozptýlen kolem buňky. Vysoké množství sacharidů v médiu či prostředí zintenzivňuje tvorbu pouzdra. Schopnost tvorby pouzdra je možné ztratit (mutací), z původní mukózní formy se stává R forma (reverzibilní, drsná) až S forma, která již pouzdro není schopna tvořit.
Stejně jako endospory jsou i pouzdra omezeně barvitelná. Pouzdra se nabarví po povaření v barvivu. Pro zvýraznění pouzdra se využívá negativního barvení. Pouzdro je v preparátu nezbarveno a je výrazně světlé.
Negativní barvení
Negativním barvením se obarví okolí buněk, nikoli buňky samotné. Velikost ani tvar buňky není deformovaný fixací a barvivem. Využívá se pro měření přesné velikosti a tvaru bakteriální buňky, pro stanovení pouzder, kapsulí a slizů.
Seznam přístrojů, materiálu a mikroorganizmů
Pomůcky a chemikálie
- podložní a krycí skla, bakteriologická klička
- filtrační papír, sterilní destilovaná voda
- nigrosin, Kongo červeň, metylenová modř, malachitová zeleň
Mikroorganizmy
- Bacillus megaterium CCM 2007 – spory kulaté, nezduřují buňku, subterminální umístění
- Bacillus sphaericus CCM 1615 – spory kulaté, zduřují buňku, terminální umístění
- Bacillus cereus CCM 2010 – spory oválné, nezduřují buňku, centrální umístění
- Bacillus thuringiensis CCM 19 – spory oválné, nezduřují buňku, subterminální umístění
- Bacillus subtilis CCM 2216 – spory oválné, nezduřují buňku
- Paenibacillus polymyxa CCM 1459 – spory oválné, zduřují buňku, centrální umístění
- Azotobacter vinelandii CCM 289 (případně izolát z půdy)
Postup
Při fázovém kontrastu jsou v preparátu zvýrazněny endospory, jejich tvar, velikost a umístění.
Pro pozorování endospor je vhodná kultura určitého stáří narostlá na médiu podporující sporulaci, např. u rodu Bacillus kultury staré 2-3 dny.
Negativní barvení nigrosinem
- Asepticky přenést buňky do malé kapky destilované vody na podložním sklíčku, vedle přidat malou kapku nigrosinu.
- Kapky smíchat kličkou, rozetřít jemným tahem druhého sklíčka (přiloženého pod úhlem 45˚ po celé ploše podložního skla) a bez oplachování nechat zaschnout na vzduchu.
- Důležité je vytvořit tenký film barviva s dostatečně zředěnými buňkami.
- Pozorovat při zvětšení 1000× s imerzí.
Hodnocení
V preparátu jsou viditelné neobarvené buňky na šedém pozadí (obr. 46). Porovnat mezi preparáty tvar a velikost buněk různých druhů jednoho bakteriálního rodu. Výsledek ovlivňuje tloušťka vrstvy barviva (silný nános může po zaschnutí praskat) a koncentrace barviva.

Negativní barvení Kongo červení
- Asepticky přenést buňky do malé kapky Kongo červeně na podložním sklíčku.
- Rozetřít jemným tahem druhého sklíčka (přiloženého pod úhlem 45˚ po celé ploše podložního skla) a nechat zaschnout na vzduchu.
- Opláchnout 1% HCl, ihned slít, neoplachovat, případně dosušit filtračním papírem.
- Pozorovat při zvětšení 1000× s imerzí.
Negativní barvení pouzder nigrosinem u zástupců rodu Azotobacter
- Do kapky vody na podložním sklíčku přenést malé množství buněk ze slizovité kolonie, smíchat s kapkou nigrosinu a přikrýt krycím sklíčkem.
- Zbytek tekutiny odsát a pozorovat pod objektivem 60×.
- Šedavé buňky jsou obklopeny bílými pouzdry a pozadí je tmavé. Nigrosin nabarví buňky a pozadí, nikoli pouzdra, ta jsou takto nebarvitelná.
Negativní barvení pouzder nigrosinem u zástupců rodu Azotobacter, dobarvení buněk metylenovou modří
- Rozmíchat kapku nigrosinu s kapkou vody na podložním sklíčku, do suspenze přenést buňky, rozetřít po sklíčku a nechat zaschnout.
- Nátěr pokrýt na 3 minuty roztokem metylenové modře, opláchnout vodou a osušit.
- Pozorovat při zvětšení 1000× s imerzí.
Hodnocení
Modré buňky jsou obklopeny světlými pouzdry, pozadí je tmavé.
Negativní barvení pouzder Kongo červení u zástupců rodu Azotobacter, dobarvení buněk metylenovou modří
- Do kapky Kongo červeně na podložním sklíčku nanést kulturu, suspenzi rozetřít a nechat zaschnout.
- Převrstvit na několik sekund HCl. Kyselinu slít, neoplachovat, dosušit filtračním papírem.
- Na 3 minuty převrstvit metylenovou modří, slít, opláchnout vodou a usušit na vzduchu.
- Pozorovat při zvětšení 1000× s imerzí.
Hodnocení (obr. 47)
Modré buňky a cysty obklopené světlými pouzdry na tmavém pozadí.

Přímé barvení pouzder horkým karbolfuchsinem
Výpary karbolfuchsinu jsou jedovaté, ve cvičení se neprovádí.
Nativní preparát pro pozorování endospor u zástupců rodu Bacillus (obr. 48)
- Do kapky sterilní destilované vody na podložním sklíčku nanést kulturu, rozmíchat a překrýt krycím sklíčkem (nepřikládat svrchu na kapku, ale nejprve jednou hranou, nepřitlačovat).
- Buňky z tekutého média pozorovat přímo v bujónu bez ředění v kapce vody.
- Ihned pozorovat při fázovém kontrastu (objektiv 60× nebo 100×), preparát rychle vysychá.

Barvení endospor malachitovou zelení - Schaeffer-Fultonova metoda
- Zaschlý nátěr buněk na podložním sklíčku fixovat trojím protažením v plamenu.
- Nátěr převrstvit malachitovou zelení, zahřívat 3-4× do výstupu par po dobu 5 minut, průběžně doplňovat barvivo.
- Opláchnout vodou, převrstvit na 1–3 minuty bez zahřívání pro dobarvení kontrastním barvivem (Kongo červeň).
- Opláchnout vodou, usušit, pozorovat při zvětšení 1000× s imerzí.
Hodnocení
Zelené endospory uvnitř červených buněk, lze hodnotit tvar a umístění endospor uvnitř buněk i uvolněných endospor (obr. 49).

Zhodnocení cvičení
- Byly endospory, pouzdra, cysty a buňky dobře odlišitelné a pozorovatelné?
- Byl rozdíl ve velikosti pouzdra u izolátu z půdy a sbírkové kultury?
- Byly endospory u různých kultur umístěné stejně?
- Měly endospory stejný tvar a velikost?
Další informace k této problematice najdete v následující literatuře
- Prescott L., M., Harley J. P., Klein D. A., Microbiology, WCB, Dubuque, 1996, ISBN 0-697-29390-4.
- Songer J. G., Clostridia as agents of zoonotic disease. Vet. Microbiol., 2010, 140: 399-404.
- Seznam proteinů zahrnutých do procesu sporulace (zdroj: http://www.uniprot.org/uniprot/?query=sporulation&sort=score; 8. 3. 2016).
Kontrolní otázky
- Kterou část preparátu barvíme při negativním barvení?
- Jak je možno v preparátu zvýraznit pouzdra?
- K čemu slouží preparát barvený Schaeffer-Fultonovou metodou, jaká barviva a k čemu se při této metodě používají?
- Kolik je v bakteriální buňce přítomno endospor a jak je můžeme pozorovat?
- Kde v buňce mohou být endospory umístěny?
- Lze endospory pozorovat pod fázovým kontrastem? Pokud ano, jak se v preparátu jeví?
- Co je germinace?
- Zvláštnosti endospory (počet, umístění, tvar, složení).
- Jmenujte 2 rody sporulujících bakterií.
- Jaké výhody poskytuje negativně barvený a nativní preparát pro pozorování morfologie bakteriálních buněk?
- Jakými mikroskopickými technikami se pozorují endospory?
- K čemu slouží posouzení různého tvaru a umístění endospor u různých druhů rodu Bacillus?
- Proč je barvení spor problematické?
- Jsou negativním barvením obarveny buňky?