Fyzikální a chemické prostředky kontroly růstu mikroorganizmů
Cíl cvičení
Testování účinku vybraných fyzikálních a chemických prostředků pro kontrolu růstu mikroorganizmů v závislosti na době kontaktu a koncentraci (UV záření, dezinfekční látky: SAVO, Incidur a Ajatin).
Úvodní slovo
Faktory vnějšího prostředí mohou na mikroorganizmy působit mikrobicidně, což je nevratný inhibiční účinek s letálním koncem, nebo mikrobistaticky, kdy je účinek reverzibilní a po odeznění faktoru, který změnu vyvolal (např. vyředění na minimální koncentraci), buňky pokračují v růstu.
Inhibiční účinek faktorů je závislý na povaze a intenzitě působení, ale i na fyziologickém stavu buňky (stáří) a prostředí, ve kterém se nachází. Buňky ve vegetativní formě jsou citlivější než klidové formy, endospory, myxospory a cysty. Citlivost je ovlivněna složením buňky a buněčné stěny a rodovou, případně druhovou příslušností organizmu. Organizmy, které vytváří pigmenty, jsou např. lépe chráněny proti UV záření, záření je odráženo a pohlcováno barvivem (možné srovnání s tmavými slunečními brýlemi). Barviva v pigmentech pohlcují určitou vlnovou délku světla, která může být využita jako energie pro syntézu živin a další mechanizmy důležité pro život.
Dekontaminace je odstranění mikrobní, chemické a radioaktivní kontaminace z předmětů. Může být zabezpečena různým způsobem a tomu odpovídá též dosažený efekt. Prostý úklid, mytí nebo praní a žehlení snižuje výskyt mikroorganizmů až o 90 %.
Antisepse je zneškodňování choroboplodných zárodků v prostředí živých tkání, v ranách, na sliznicích a na kůži s použitím antiseptik. Je namířena hlavně proti mikrobům vyvolávajícím hnisání. U antiseptik není striktní požadavek na baktericidní účinek, stačí bakteriostatické působení. Antiseptika musí splňovat požadavek nejedovatosti a dobré snášenlivosti živými tkáněmi, podléhají schválení jako každý jiný lék. U antiseptik není nutná dobrá rozpustnost ve vodě.
Asepse je souhrn opatření vedoucích ke stavu, kdy je v prostředí minimum mikroorganizmů. Asepse brání přístupu mikroorganizmů k živým tkáním při chirurgických operacích používáním sterilních nástrojů, obvazových látek, šicího materiálu, pryžových rukavic, přípravou operačního pole, dezinfekcí chirurgových rukou, používáním ústenek apod. Pojem asepse zahrnuje také laboratorní a výrobní metody, u nichž je snaha zabránit mikrobiální kontaminaci např. u mikrobiologických laboratorních prací a při výrobě některých léků.
Dezinfekce je definována jako ničení či zneškodňování kontaminujících mikroorganizmů na neživých předmětech, ve vnějším prostředí (ve vodě, ve vzduchu) a v infekčním materiálu. Zahrnuje širokou paletu účinnosti proti virům, vegetativním formám bakterií a hub, ne však proti endosporám. Účinnost dezinfekce je závislá na rezistenci mikroorganizmů vůči dezinfekčním prostředkům.
Sterilizace je zbavení prostředí všech živých organizmů, včetně virů, bakterií, bakteriálních endo- i exospor, mikroskopických hub a jejich exospor. Sterilizace je v praxi zatížena určitou pravděpodobností selhání. Předmět může být považován za sterilní, je-li možno prokázat, že pravděpodobnost přítomnosti mikrobů je nejvýše 10-6.
Fyzikální metody sterilizace
Mezi sterilizaci vlhkým teplem patří frakcionovaná sterilizace, tyndalizace a sterilizace nasycenou vodní parou.
Přerušovaná, frakcionovaná sterilizace je sterilizace varem (100 °C) působícím po dobu 30 minut v 18-24 hodinových intervalech 3 dny po sobě. Sterilizovaná látka musí být v mezidobí uložena při pokojové teplotě, aby termorezistentní endospory, které var přežily, mohly vyklíčit. Následující var je pak ničí jako vegetativní formy bakterií.
Tyndalizace se používá ke sterilizaci termolabilních roztoků bílkovin, které koagulují již při teplotě 60 °C. Postup je podobný jako při frakcionované sterilizaci. Roztok se zahřívá ve vodní lázni při 56-58 °C (resp. při 60-80 °C) po 30-60 minut 3 dny po sobě.
Sterilizace nasycenou vodní parou pod tlakem (v autoklávu) se provádí nejčastěji za přetlaku 100 kPa při teplotě 120 °C po dobu 20-30 minut. Tento způsob sterilizace umožňuje zničit bezpečně všechny formy mikroorganizmů. Autokláv je tlakový sterilizátor opatřený vodoznakem pro stav vody ve vyvíječi páry (pokud není přímo napojen na přívod páry z centrálního zdroje). Je vybaven pojistným ventilem, dvěma manometry (jeden k měření přetlaku páry ve vyvíječi, druhý v pracovním prostoru), odvzdušňovacím ventilem, vodní vývěvou a teploměrem. Dokonalé odvzdušnění pracovního prostoru na začátku sterilizace je předpokladem úspěšného autoklávování (směs páry se vzduchem při 120 °C a 30 minutové expozici nemá spolehlivý sterilizační efekt). V autoklávu lze sterilizovat obvazový materiál, operační prádlo, různé roztoky, kovové lékařské nástroje, pryžový materiál. Při sterilizaci bakteriologických půd je třeba dát pozor na možnost hydrolýzy disacharidů a poškození termolabilních látek. Textilní materiál se ukládá do sterilizačních bubnů, které se vkládají do autoklávu otevřené a po skončení sterilizace jsou ihned uzavřeny. Materiál uzavřený v bubnu se považuje za sterilní jen dva dny po sterilizaci. Potom je nutno buben znovu sterilizovat, i když nebyl otevřen.
Suché teplo je méně účinné než pára pod tlakem. Má nižší koeficient vodivosti, sterilizace probíhá při vyšší teplotě a po delší expoziční dobu. Otevřený plamen se používá při žíhání bakteriologické kličky, k likvidaci pokusných zvířat a některých předmětů malé hmotnosti, např. kontaminovaných obvazů.
Horkovzdušná sterilizace skla, porcelánu a kovů se provádí v horkovzdušných sterilizátorech. Doba vlastní sterilizace se počítá od okamžiku dosažení předepsaných teplot. V přístrojích s nucenou cirkulací vzduchu se sterilizuje obvykle buď při 160 °C 60 minut nebo při 180 °C 20 minut.
Sterilizace filtrací slouží k odstraňování mikroorganizmů z tekutin tam, kde je jiný způsob dekontaminace nevhodný. Viry procházejí většinou bakteriálních filtrů. Filtry se liší dle konstrukce, velikosti pórů a použitého materiálu. Azbestové Seitzovy filtry jsou lisované z azbestu a celulózy. Filtry zadržující bakterie jsou označeny EK (Entkeimung). Filtrační vložky jsou jednoúčelové a sterilizují se i s filtračními nálevkami v autoklávu. Skleněné jenské filtry jsou z borosilikátového skla ve formě porézních destiček zatavených v nálevkách. Používají se opakovaně. Po použití se čistí koncentrovanou kyselinou sírovou nebo chromsírovou a důkladně se promývají vodou. Sterilizují se horkým vzduchem nebo v autoklávu. Membránové ultrafiltry z nitrocelulózy s různou velikostí pórů a průměru se u nás vyrábějí pod názvem Synpor. Vkládají se do speciálních kovových bubínků a sterilizují se v autoklávu. Filtrace se provádí za použití podtlaku pomocí vývěvy.
Sterilizace zářením se provádí pomocí UV nebo ionizujícího záření.
Ultrafialové záření (UV) má optimální baktericidní účinek při vlnové délce okolo 254 nm, kdy je záření maximálně absorbováno nukleovými kyselinami. Jako zářiče se používají obvykle germicidní lampy. UV záření slouží k dekontaminaci vzduchu a pracovních ploch přímo vystavených paprskům. Používá se k vyzařování operačních sálů, aseptických boxů, piteven, odběrových místností v léčebnách tuberkulózy apod. Vyzáření nemůže nahradit úklid pomocí dezinfekčních prostředků. Účinnost UV klesá se vzdáleností ozařovaného objektu.
Ionizující záření penetruje, ale nezahřívá sterilizovaný předmět a nemění vlastnosti většiny sterilizovaných látek. Zdrojem gama záření v praxi je obvykle radioaktivní kobalt. Gama záření se používá k průmyslové sterilizaci (obvazový materiál, plasty). Mezinárodně stanovená sterilizační dávka je 27 kGy.
Chemické prostředky dezinfekce
Vzorkování a mikrobiologické vyšetření používaných dezinfekčních roztoků se testuje na standardních kmenech mikroorganizmů. Výsledky se odborně interpretují s ohledem na specifické důvody prováděné kontroly. Ve zdravotnických zařízeních se odebírají vzorky naředěných používaných dezinfekčních roztoků, a co nejrychleji se transportují do mikrobiologické laboratoře ke stanovení jejich účinnosti na kontrolních kmenech, případně účinnosti na mikroby izolované na konkrétním zdravotnickém pracovišti.
Dezinfekční účinnost může být baktericidní, bakteriostatická, fungicidní (vláknité a kvasinkovité houby), fungistatická, tuberkulocidní, mykobaktericidní, sporicidní, sporistatická, virucidní (obalené a neobalené viry). Testování lze přizpůsobit podmínkám čistého, špinavého, vysoce nebo málo znečištěného prostředí. Specifický účinek chemických látek na mikroorganizmy se projevuje v závislosti na jejich koncentraci a době působení (expozice).
Kritéria kvality dezinfekčních prostředků pro volbu jejich použití: široké spektrum účinku (baktericidní, virucidní i fungicidní účinek zároveň), při trvalém používání nevzniká rezistence, netoxické, rychlý dezinfekční účinek, afinita k mikroorganizmům, k dezinfikovanému předmětu jsou inertní, stálý dezinfekční účinek za různých změn vnějších podmínek (teplota, vlhkost vzduchu, pH).
Antimikrobní látky nejčastěji přímo poškozují strukturu mikroorganizmů nebo narušují jejich základní metabolické procesy např. oxidací (sloučeniny chlóru, peroxidy, peroxid kyseliny), redukcí (aldehydy), hydrolýzou (kyseliny, louhy), dehydratací (alkoholy), koagulací bílkovin (alkoholy, fenoly), změnou permeability (detergenční látky).
- Zásady a kyseliny
- Silně anorganické kyseliny a zásady se pro své toxické a agresivní účinky používají v praxi zřídka. Např. vápenné mléko, kyselina boritá, kyselina peroctová, persteril (32–36% roztok kyseliny peroctové s 10% H2O2 a 1% H2SO4)
- Oxidační prostředky
- peroxid vodíku, manganistan draselný
- Sloučeniny halogenů
- chlorové vápno, Chloramin B, Dikonit
- Jód a jeho sloučeniny
- jódová tinktura, jodofory, Jodonal B, Jodisol
- Sloučeniny těžkých kovů
- Famosept, Merfen, Merthiolát, Thiomersal
- Alkoholy
- etanol, n-propanol, etylenoxid
- Aldehydy
- formaldehyd, formalin, glutaraldehyd
- Fenolové deriváty
- krezoly, Lysol, Orthosan BF 12
- Povrchové aktivní látky
- Ajatin, Septonex, Ophthalmo-Septonex
Ke kontrole účinnosti dezinfekce a sterilizace se používá řada testů podle povahy sterilizované látky a způsobu provádění sterilizace nebo dezinfekce, např. papírové indikátory nebo bioindikátory, stěry sterilním vatovým tampónem.
Seznam přístrojů, materiálu a mikroorganizmů
Pomůcky a chemikálie
- Petriho misky s MPA, zkumavky s 10 ml MPB
- sterilní vatové tyčinky, zkumavky, pinzety a destilovaná voda
- papír, alobal, pipety
- UV lampa
- dezinfekční činidla (Savo, Incidur, Ajatin)
Mikroorganizmy
- Pseudomonas fluorescens CCM 2115T
- Staphylococcus aureus SA 812
- Escherichia coli CCM 3954
- Saccharomyces cerevisiae
- Serratia marcescens CCM 303
- Bacillus cereus CCM 2010
Postup
Vliv doby působení UV záření na růst mikroorganizmů
- Pomocí vatové tyčinky pečlivě rozetřít mikrobiální kulturu po celém povrchu agaru v dostatečném množství a hustotě (3 skleněné misky s MPA).
- Misky rozdělit popisovačem zespodu na poloviny, umístit do boxu s UV lampou a odklopit víčko. Polovinu každé misky zakrýt alobalem.
- První misku ozařovat 10 sekund, druhou 30 sekund a poslední 60 sekund.
- Po ozáření misky zakrýt víčkem a inkubovat dnem vzhůru 24 hodin při 30 °C.
Hodnocení: Prohlédnout agarové plotny, výsledky zaznamenat. Zhodnotit vliv UV záření na růst mikroorganizmu podle jeho délky účinku. Zhodnotit i růst v zakryté části agarové plotny (kontrola). Při jaké době ozařování je znatelný úbytek kultury? Byly mikroorganizmy ovlivněny UV zářením? Závisel tento vliv na druhu mikroorganizmu a na době expozice?
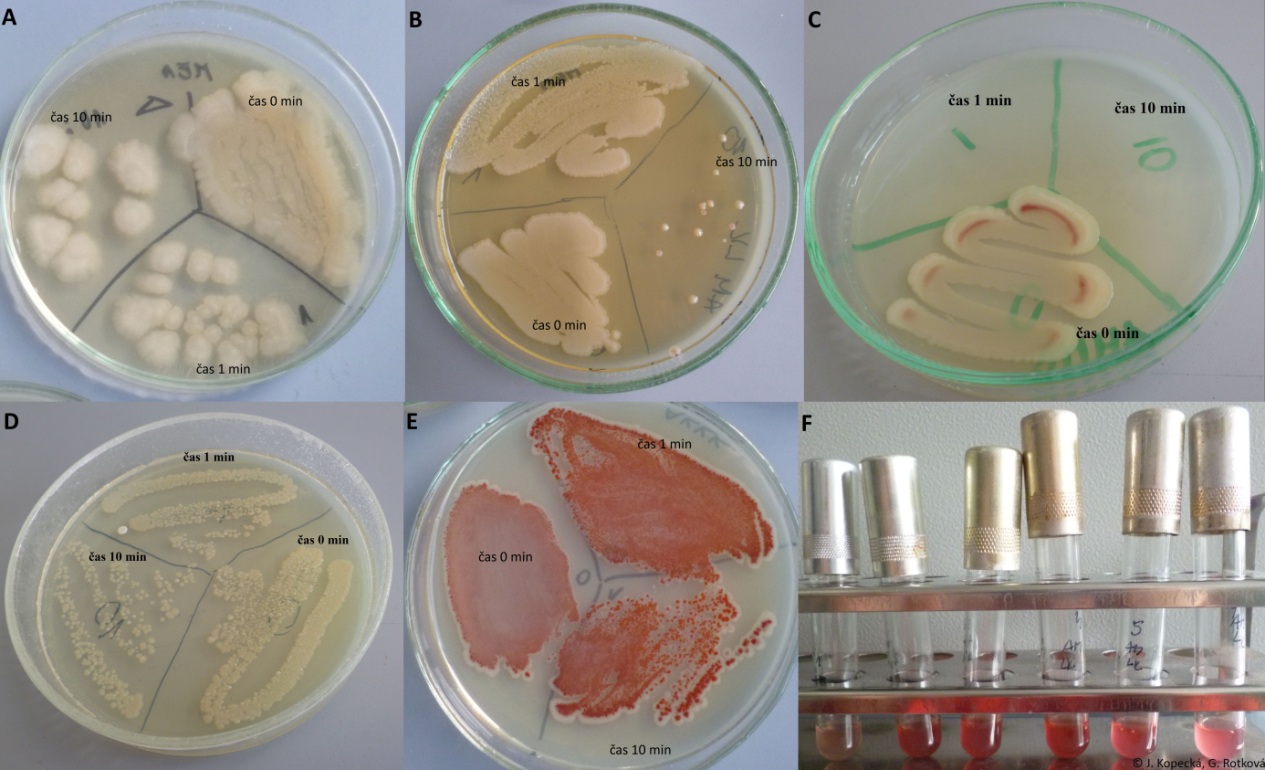
Vliv doby kontaktu na růst mikroorganizmů
- Do sterilní zkumavky připravit dezinfekční prostředek v koncentraci doporučené na obalu výrobcem
- Incidur: 0,5% roztok, celkový objem 5 ml, 25 µl prostředku a 4,975 ml vody
- Savo: 100 ml do 3 l, tj. 3,33% roztok, do 4,833 ml pipetovat 166,7 µl Sava
- Ajatin: 1% roztok
- Misku s MPA rozdělit na 3 sektory, které označíme 0; 1 a 10 minut.
- Do sektoru 0 naočkovat kulturu vatovou tyčinkou „hádkem“ (kontrola).
- Do zkumavky s dezinfekčním prostředkem přidat 500 µl kultury a protřepat.
- Ze zkumavky po 1 a 10 minutách očkovat „hádkem“ vatovou tyčinkou do odpovídajících sektorů na misce.
- Inkubovat 24 hodin při 37 °C.
Hodnocení: Prohlédnout agarové plotny, výsledky zaznamenat. Zhodnotit vliv doby působení dezinfekční látky na růst bakterie. Porovnat hustotu nárůstu. Má doba působení dezinfekční látky vliv na růst mikroorganizmu?
Vliv koncentrace na růst mikroorganizmů, stanovení minimální inhibiční koncentrace
- Sterilní zkumavky označit čísly 1 až 6.
- Do první zkumavky připravit 2% roztok Inciduru nebo 3% roztok Sava v MPB do celkového objemu 2 ml (40 µl Inciduru doplnit 1,960 ml MPB; 60 µl Sava doplnit 1,940 ml MPB).
- Do dalších 5 zkumavek pipetovat 1 ml MPB.
- Z první zkumavky odebrat 1 ml roztoku, pipetovat ho do druhé zkumavky a promíchat.
- Postupovat obdobně až k předposlední zkumavce (zkumavka 5), z ní 1 ml odebrat a vypustit do odpadní nádoby.
- Poslední zkumavka (6) neobsahuje žádný dezinfekční prostředek (kontrola růstu). Zkumavky 1 až 5 obsahují 1 ml roztoku dezinfekčního činidla s klesající koncentrací v MPB. Koncentrace prostředku v každé následující zkumavce je poloviční ve srovnání s předcházející zkumavkou.
- Do každé zkumavky naočkovat 50 µl kultury. Inkubovat 24 hodin při 37 °C.
Hodnocení: porovnat růst v různých koncentracích dezinfekční látky. Která koncentrace je dostatečná k inaktivaci dané kultury? Je ovlivněna minimální inhibiční koncentrace dezinfekce podle bakteriálního druhu a podle použité dezinfekce?
Zhodnocení cvičení
Výsledky úloh jsou zobrazeny na obr. 28 a 29.

Další informace k této problematice najdete v následující literatuře
- Kneiflová J., Hodnocení baktericidní účinnosti dezinfekčních přípravků suspenzní mikrometodou. Čs. epidemiol. 1988, 37:97–103.
- Standardní metody pro hodnocení dezinfekční účinnosti chemických látek. AHEM, příloha č. 1, 1985, 1–25.
- Melicherčíková V., Sterilizace a dezinfekce ve zdravotnictví. Praha, Grada Publishing, 1998.
Kontrolní otázky
- Proč je při ozařování agaru na misce UV světlem nutno odstranit skleněné víčko?
- Mnohé mikroorganizmy nacházející se v prostředí jsou zbarvené. Jakou výhodu může pigment představovat pro organizmus?
- Na čem závisí účinnost fyzikálních a chemických prostředků v boji proti mikroorganizmům?
- Vysvětlete pojem mikrobistatický.
- Vysvětlete pojem mikrobicidní.
- Prochází UV záření alobalem?
- Kde se můžeme setkat se sterilizací UV zářením?